GL-7-ACA酰化酶的固定化工艺条件优化
郭 璐,黎继烈,王 卫,罗 倩,朱晓媛
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
GL-7-ACA酰化酶的固定化工艺条件优化
郭 璐,黎继烈,王 卫,罗 倩,朱晓媛
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
采用单因素和Box-Behnken实验对LX-1000EP树脂固定化戊二酰-7-氨基头孢烷酸酰化酶的工艺条件进行优化。首先通过单因素设计研究载体用量、缓冲液pH值、时间、温度四个因素对固定化戊二酰-7-氨基头孢烷酸酰化酶活力的影响,在此基础上,利用响应面试验设计对LX-1000EP树脂固定化戊二酰-7-氨基头孢烷酸酰化酶的条件进行优化。载体用量、缓冲液pH值、时间、温度对固定化戊二酰-7-氨基头孢烷酸酰化酶都有影响,固定化最佳工艺条件为:载体用量3.3 g、pH值7.9、时间40 h、温度25 ℃,在此条件下固定化酶活力达到(69.5±0.8) U/g,酶活回收率达到42.41%。将响应面法应用于固定化戊二酰-7-氨基头孢烷酸酰化酶条件的优化是可行的。
戊二酰-7-氨基头孢烷酸酰化酶;LX-1000EP树脂;固定化工艺;Box-Behnken实验设计
戊二酰-7-氨基头孢烷酸酰化酶(GL-7-ACA acylase,GA)能水解戊二酰-7-氨基头孢烷酸,产生半合成头孢菌素类抗生素重要母核7-氨基头孢烷酸(7-ACA)和戊二酸。通过两步酶法批量生产7- ACA的工艺技术早已成功实现工业化,这条工艺路线中最关键的两个酶是戊二酰-7-氨基头孢烷酸酰化酶(GL-7-ACA) acylase (EC 3.1.5.11 )以及D-氨基酸氧化酶(DAAO,EC 1.4.3.3)[1-2]。GA绝大多数来自于假单胞菌中,其中有文献报道的假单胞菌类别有:sp130假单胞菌[3]假单胞菌SY-77[4]、GK16假单胞菌[5]等。当然也有来源于诸如侧孢芽孢杆菌[6]等其它种类的细菌。来自于不同细菌的GA,其催化性质也表现各不相同,这主要体现在最优的催化温度以及pH值等方面。具有此活性的菌株一般通过土壤或污水筛选获得[7-9]。游离戊二酰-7-氨基头孢烷酸酰化酶存在容易失活、在除水以外的其它溶液中不溶解、稳定性不好、反应后酶不能够回收再利用等弊端,使得其不可以在工业化生产中得到充分利用。在这种状况趋势下,固定化酶技术得以长足发展,酶的固定化是表示将酶固定或者限制在某一特定的固体载体上或是某一局部空间进行其独特的催化反应,并且能够回收和重复利用的技术,在催化反应过程中以固相状态作用于底物[10]。因此人们希望将戊二酰-7-氨基头孢烷酸酰化酶固定到载体上来改善其使用性能。但是用于酶固定化的载体大多存在固定化酶活力低、重复利用率不高、消耗成本大等缺点。为了完善上述不足同时进一步提升固定化戊二酰-7-氨基头孢烷酸酰化酶的热稳定性和pH值耐受性,本文采用国产LX-1000EP树脂材料对戊二酰-7-氨基头孢烷酸酰化酶进行固定化,这种新的固定化材料价格低廉、吸附能力强,重复利用率高,可以大批量获取。鉴于国产 LX-1000EP树脂的以上优点,将其用于戊二酰-7-氨基头孢烷酸酰化酶的固定化。为了获得固定化戊二酰-7-氨基头孢烷酸酰化酶的最适当的工艺条件,通过响应面分析方法以及Box-Behnken实验设计实施工艺条件的改善,以期为戊二酰-7-氨基头孢烷酸酰化酶的工业运用提供参考。
1 材料与方法
1.1 实验材料
戊二酰-7-氨基头孢烷酸酰化酶液:本实验室存储的毕赤酵母通过发酵后,在4 ℃温度下离心并收集发酵液,然后通过截留分子量超过10 000的中空纤维滤膜进行浓缩,最后经硫酸铵分级沉淀制备得来,纯化后的戊二酰-7-氨基头孢烷酸酰化酶液的酶活测定为70.01 U/mL[11]。
氢氧化钠、柠檬酸、95%乙醇、盐酸、磷酸二氢钠、磷酸氢二钠等都是分析纯试剂。
实验仪器:HH-S 型水浴锅,郑州长城科工贸有限公司;LX-1000EP树脂,西安蓝晓科技有限公司;恒温摇床, 上海智城公司; SHA-C恒温振荡器,江苏常州仪器厂。
1.2 实验方法
1.2.1 酶活的定义
酶活通常被定义为:在37℃的温度条件下,单位质量的固定化GA或者单位体积的GA在单位时间段内催化戊二酰-7-氨基头孢烷酸水解产生1 μmoL的7-ACA所需的酶量定义为1个活力单位(U·L-1或 U·kg-1)。
1.2.2 测定酶活的方法
酶活采用碱滴定法进行测定[12]。
1.2.3 固定化条件单因素实验
以每10 mL酶液为实验对象,选择影响固定化活力的4个主要因素,固定化时间、缓冲液pH值、固定化温度、载体投放量为单因素实验因子,分别测定不同因素、不同水平条件下固定化酶活、酶活回收率,通过单因素实验选择Box-Behnken实验的水平范围。
1.2.4 Box-Behnken实验
依照单因素实验所得到的结果,确定响应面实验的因素以及水平范围,同时通过Box-Behnken实验设计以及响应面分析,来确定GA固定化的最理想的工艺参数[13]。
2 结果与分析
2.1 酶固定化的条件与固定化酶活力的关系
2.1.1 温度与固定化酶活力的关系
温度变化对固定化酶活力产生的影响结果如图1所展示,固定化酶的活力伴随温度的不断升高而显示出先增加后降低的趋势,当温度为25℃的时候,酶活回收率以及固定化酶活力达到最高分别为35.27%和65.26 U/g 。温度增加后载体对于蛋白质的吸附量会适当提高,不过一旦高于最适合温度,酶蛋白活性中心的结构就会发生改变,酶极易变性失活,这两者的综合影响结果就会导致酶活降低。
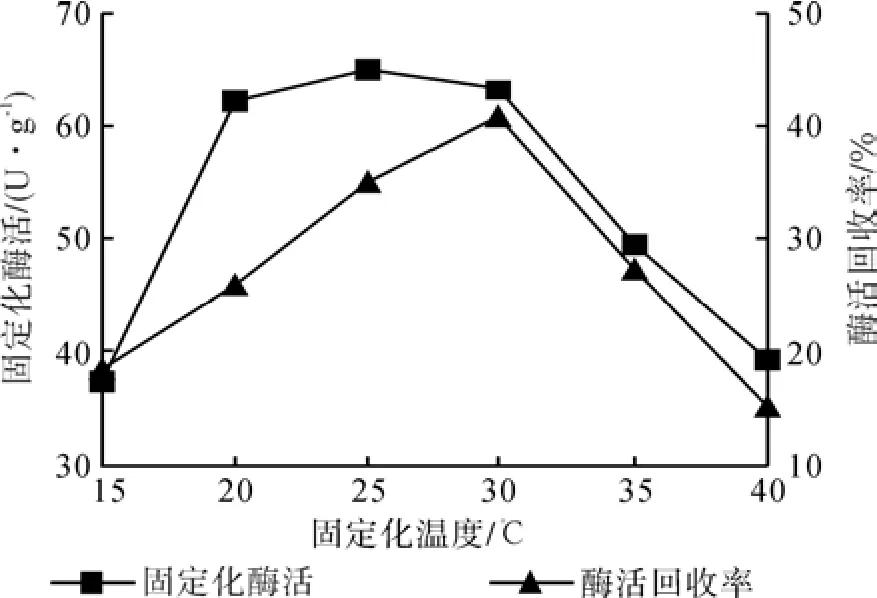
图1 温度与固定化酶活力的关系Fig.1 Effect of temperature on activity of immobilized enzyme
2.1.2 缓冲液pH值与固定化酶活力的关系
缓冲液的pH值对固定化酶活力产生的影响如图2所展示,固定化酶的活力伴随pH值的不断增加而显示出先增后减的趋势,pH 值为8.0时固定化酶活力和酶活回收率分别达到最大为69.31 U/g和41.38%。pH值在达到一定数值后,继续升高对固定化产生抑制作用。
2.1.3 载体用量与固定化酶活力的关系

图2 缓冲液pH值与固定化酶活力的关系Fig.2 Effect of buffer pH value on activity of immobilized enzyme

图3 载体用量与固定化酶活力的关系Fig.3 Effect of carrier on activity of immobilized enzyme
载体用量的多少对于固定化酶活力产生的影响结果如图3所展示,固定化酶活力伴随载体用量的递增而呈现出先增后降的趋势,在载体用量为3.0 g时,固定化酶活力和酶活回收率分别达到最大为63.39U/g和35.08%。酶活降低的缘故可能是因为载体的表面吸附了过多的酶,可能形成了一定的空间位阻,导致底物以及产物均不容易扩散,因此而影响这种酶促反应的顺利进行。
2.1.4 时间与固定化酶活力的关系
时间长短对于固定化酶活力产生的影响结果如图4中所展示,固定化酶活力伴随固定时间的增长而逐步增加,在40 h固定化酶活力达到最高为70.12 U/g,40 h后酶活呈现相对稳定的状态。引起这一现象的原因可能是因为单位质量的载体在固定GA过程中需要花费一定的时间,随后一旦载体吸附的酶量达到完全饱和的时候就不会继续吸附额外的酶,酶活也就会由此而保持相对稳定。
2.2 Box-Behnken 实验
2.2.1 Box-Behnken 实验结果和分析
为深入优化LX-1000EP树脂固定化GL-7-ACA酰化酶的条件工艺参数,根据单因素实验结果,选取水温度(X1)、缓冲液pH值(X2)、载体用量(X3)作为试验因素,以固定化酶活为响应值进行Box-Behnken实验,实验方案设计以及实验结果见表1和表2。

图4 时间与固定化酶活力的关系Fig.4 Effect of time on activity of immobilized enzyme

表1 Box-Behnken试因素及其水平Table 1 Factors and levels of variables tested in Box-Behnken experiment
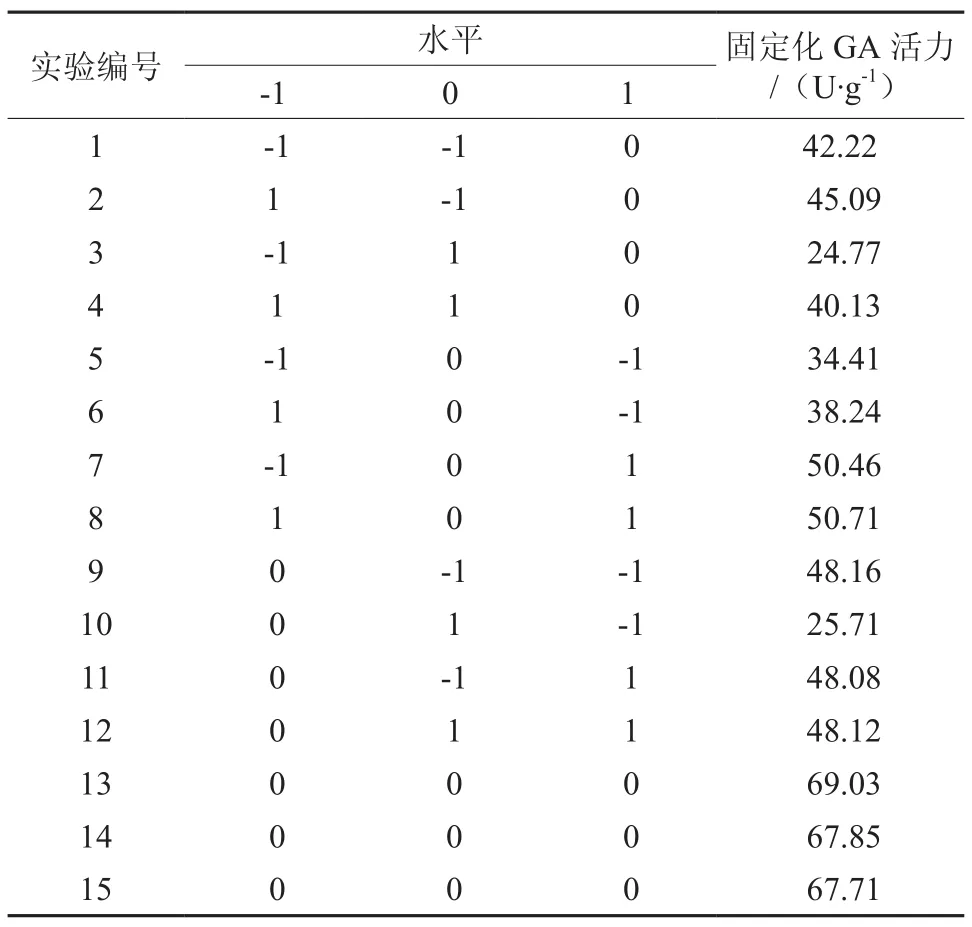
表2 Box-Behnken试验设计及其结果Table 2 Design and results of Box-Behnken experiment
2.2.2 试验二次回归拟合和试验方差分析
首先对SAS.8.1软件拟合得到的方程进行显著性检验和方差分析,然后求解回归方程从而获得显著因素的最恰当取值[14]。分析此拟合方程的方差,结果如表3所示,回归方程系数显著性检验结果如表4所示。回归方程中各种变量对指标(响应值)影响的显著性,通过F检验来加以判定,随着概率P的值越小,那么相应变量的显著程度也就越高。通过表3能够看出,模型P<0.05,这表示回归模型非常显著,失拟项P=0.050 7(P>0.05),模型失拟度不显著,其校正决定系数RAdj2=0.944 5,表示只有总变异的5.5%不能够通过此模型进行解释。相关系数R2= 0.972 2,表明此模型的拟合程度比较好,实验误差也比较小,此模型合适,回归方程能够真实地展现各种因素同响应值之间的联系。从表4中能够观察到,在实验的水平范围内显著(P<0.05)的因素为一次项X1、X2以及X3,交互项X2X3和二次项X12、X22、X32。
通过对软件得到的数据进行分析,创建二次响应面的回归模型,继而寻找到最优响应因子水平,所获得的分析结果如表3和表4所示。
各种因素经过回归拟合之后,解回归方程得到:
Y=-3803.70+20.31X1+918.45X2-18.30X3+1.25X1X2-0.18X1X3+11.25X2X3-0.58X12-62.16X22-10.14X32。
式中,Y代表固定化酶活力,U/g、X1代表温度℃、X2代表缓冲液pH值、X3代表载体用量g。
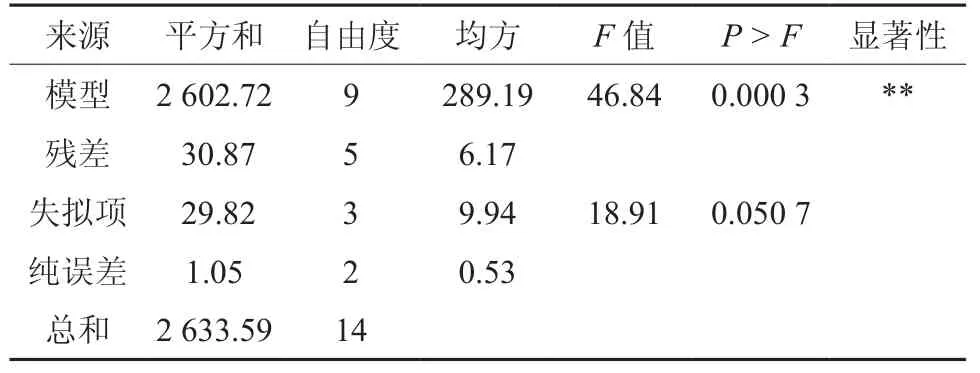
表3 响应面实验回归方程方差分析†Table 3 Variance analysis of response surface regression test

表4 回归系数显著性分析†Table 4 Significant analysis of regression coefficients
2.2.3 载体用量等三因素间的相互影响
通过分析可以知道回归方程存在稳定点,而且稳定点就是极大值。为了获得最优值X1、X2以及X3, 对回归拟合方程求一阶偏导数,一节偏导数分别针对各自的变量,并且令其等于0,获得一个三元一次方程组,求解这个方程组能够得到模型的极值点:X1=0.074、X2=-0.124、X3=0.276,即温度为25.37 ℃、缓冲液pH值取7.94、载体用量为3.28 g,固定化GA的酶活达到最大值69.52 U/g。为实验操作方便,取最优条件为温度25 ℃、缓冲液pH值7.9、载体用量3.3 g。
2.3 验证实验
为了验证通过响应面法所获取的结果是否可靠,在上面所述的通过响应面分析方法得到的最优取值下进行戊二酰-7-氨基头孢烷酸酰化酶固定化的验证实验,经5次平行实验,实际测得固定化戊二酰-7-氨基头孢烷酸酰化酶的平均活力为69.1 U/g,跟理论预测值比较误差是0.57%,酶活的回收率达42.35%,表明响应面法优化的结果适合于LX-1000EP树脂固定化戊二酰-7-氨基头孢烷酸酰化酶工艺条件,回归模型真实、可靠。
3 结 论
通过单因素试验、Box-Behnken实验设计对LX-1000EP树脂固定化GL-7-ACA酰化酶的条件进行优化,确定其最适固定条件为:载体用量3.3 g、pH值7.9、时间40 h、温度25 ℃,在此条件下固定化酶活力达到(69.5±0.8) U/g,酶活回收率达42.41%。
通过响应面法,用LX-1000EP这种较为廉价的国产树脂对GL-7-ACA酰化酶进行固定化工艺条件的优化之后,生产出来的固定化GL-7-ACA酰化酶具有以下优势:酶活性比较强,热稳定性比较好,对pH以及温度的适应性更加广泛。尤其是LX-1000EP能够大批量且比较容易获取,这一优势为今后实施大批量制备固定化的LX-1000EP奠定了非常好的基础。
[1] Lopez-gallogo F, Betencor L, H idalgo A, et al. One pot conversion of cephalosporin C to 7-aminocephalosporamic acid in the absence of hydrogen peroxide[J]. Advanced Synthesis &Catalysis, 2005, 347: 1804-1810.
[2] Tan Q, Song Q X, Wei D Z. Single pot conversion of cephalosporin C to 7- aminocephalosporanic acid using cell bound and support bound enzymes [J]. Enzyme Microbial Technology, 2006, 39:1166 -1172.
[3] Tanomand A, Abcshov R , Farajnia S. Screening of Pseudomona ssp. for cephalosporin acylase activity [J]. Research Journal of Biology Science, 2008, 3(10):1133 -1136.
[4] Shibuya Y, Matsumoto K, Fujii Y. Isolation and properties of 7β-(4-carboxy butanamido) cephalosporanic acid acylase producing bacteria [J]. Agriculture Biology Chemistry, 1981, 45:1561-1567.
[5] Lee Y S, Park SS. Two-step autocatalytic processing of the glutaryl 7-aminocephalosporanic acid acylase from Pseudomonas spp.strain GK16 [J].Journal of Bacteriology, 1998,180(17):4576-4582.
[6] Aramori I, Fukagawa M, Tsumura M, et al. Cloning and nucleotide sequencing of a novel 7β- (4- Carboxy butanamido)cephalosporanic acid acylase gene of Bacillus laterosporus and its expression in Escherichia coli and Bacillus subtilis[J].Journal Bacteriology,1991,173(24):7848-7855.
[7] H W, Park SS. T he role of a-amino group of then terminal serine of subunit for enzyme catalysis and autoproteolytic activation of glutaryl 7-aminocephalosporanic acid acylase[J].Journal of Biological Chemistry, 2000, 275(50): 39200 -39206.
[8] Chikawa S, Murai Y, Yamamoto S, et al. The isolation and properties of Pseudomonas Mutants with an enhanced productivity of 7 β-(4-carboxy-butanamido) cephalosporanic acid acylase [J]. Agriculture Biology Chemistry, 1981, 45(10): 2225-2229.
[9] K hang YH, Yoo BH. Isolation and characterization of a novel soil strain, Pseudomonas cepacia BY21 with glutaryl-7-aminocephalosporanic acid acylase activity[J].Biotechnology Lett., 2000, 22(4): 317-320.
[10] Akin D E,Morrison W H,Rigsby L L,et al. Biological delignification of plant components by the white rot fungi ceriporiopsis subvermispora and cyathus stercoreus[J]. Animal Feed Science and Technology, 1996, 63(1-4): 305 -321.
[11] 袁 强.白地霉PP1315产脂肪酶的纯化及固定化催化性能研究[D].长沙:中南林业科技大学,2010.
[12] Xue P,Lu G Z,Guo Y L, et al. A novel support of MCM-48 molecular sieve for immobilization of Penicillin G asylase[J].Journal of Molecular Catalysis B:Enzymatic, 2004, 30(4):75-81.
[13] 王 挥,张 蕾,黎继烈,等.响应面法优化黑曲霉发酵产单宁酶条件[J].中南林业科技大学学报, 2011,31(10):122-126.
[14] 范 超,黎继烈,吴 浩,等. 重组巨大芽孢杆菌产青霉素G酰化酶发酵条件研究[J].中南林业科技大学学报,2011,31(7):124-129,135.
Optimization of immobilization technology conditions for GL-7-ACA acylase
GUO Lu, LI Ji-lie, WANG Wei, LUO Qian, ZHU Xiao-yuan
(School of Life Science and Technology, Central South University of Forestry & Technology, Changsha, 410004, Hunan, China)
The immobilization technology conditions of GL-7-ACA acylase with LX-1000EP resin were optimized by using single factor analytical methodology and Box-Behnken experimental design. Firstly, the effects of carrier dosage, buffer solution pH,time and temperature on the vitality of GL-7-ACA acylase were investigated by adopting single factor design, based on which, the immobilization conditions were optimized by response surface methodology. The results show that the four factors all had effects on immobilized GL-7-ACA acylase activity, and the optimal immobilization conditions are as follows: 3.3 of the carrier dosage, pH 7.9, time 40 hours and temperature 25℃. Under these appropriate conditions above, the immobilized enzyme,s activity was 69.5±0.8U/g, the activity recovery was 42.41%. So it is feasible to optimize the immobilization conditions of GL-7-ACA acylase with LX-1000EP by using response surface methodology.
GL-7-ACA acylase;LX-1000EP resin;immobilization technology;Box-Behnken experimental design
S718.8
A
1673-923X(2013)05-0096-05
2012-12-19
国家林业局948项目(2011-4-17)
郭 璐(1987-),女,湖南娄底人,硕士研究生,研究方向为发酵工程;E-mail:guolu0227@163.com
黎继烈(1959-),女,湖南岳阳人,教授,博士,博导,研究方向为食品加工;E-mail:lijilie@163.com
[本文编校:吴 毅]

