甜叶菊甜菊糖苷含量分析用RA和STV乙醇超声提取体系优化
罗庆云,田 敏,谢越盛,林英英,王康才
(南京农业大学园艺学院,南京210095)
甜叶菊甜菊糖苷含量分析用RA和STV乙醇超声提取体系优化
罗庆云,田 敏,谢越盛,林英英,王康才
(南京农业大学园艺学院,南京210095)
为建立一种甜叶菊叶片RA和STV提取方法,促进甜叶菊种质RA和STV等甜菊糖苷含量分析用样品制备体系的优化,基于乙醇超声提取法,采用单因素结合正交设计实验,分析提取用乙醇体积分数、超声提取时间、超声提取温度等因素对甜菊叶片RA和STV提取效率的影响,优化各参数,并以现有提取体系为参照,对其优越性进行了检验。结果表明,本研究建立了一种RA和STV提取效率较现有体系明显优化的提取方法,具体操作方法为:将甜叶菊叶片粉末按料液比1∶20(m:v)加入50%(v:v)乙醇,室温振荡过夜,40℃下超声提取60min。
甜叶菊;甜菊糖苷;提取;优化;RA;STV
甜叶菊(Stevia rebaudiana Bertoni),原产于巴拉圭[1],为菊科多年生草本糖料作物,其叶含30多种甜菊糖苷类组分[2-3],自1976年引入以来,我国已成为甜叶菊主产区,甜叶菊叶提取物甜菊糖苷出口量占世界出口总量80%[4-5]。RA(莱鲍迪苷A,Rebaudioside A)和STV(甜菊糖苷,Stevioside)为甜叶菊叶片所含两种主要甜菊糖苷类组分[6-7],随着美国FDA和欧盟食品安全局对RA安全性的认可,欧美市场对“第三代糖源”RA的需求量加大[8],我国及世界各地区高RA苷含量、高RA/STV甜叶菊新品种的种植面积将进一步扩大[7]。为适应市场需求对甜叶菊品种的要求,须大力开展高RA苷含量和高RA/STV的甜叶菊新品种选育。
甜叶菊种质RA和STV含量检测是甜叶菊新品种选育的依据。甜叶菊种质RA和STV含量的测定包括提取、分离和检测3个步骤,其中,叶片所含RA和STV的高效提取是后继分离和检测的基础,只有对甜叶菊叶片所含RA和STV进行充分提取,才能对甜叶菊种质甜菊糖苷含量进行准确评估[9-14]。此外,在甜叶菊种质评估中,由于需要同时处理大量的样品,快速简便样品处理体系的建成显得非常重要。为此,本研究的目的就是为甜叶菊种质甜菊糖苷含量的检测建立一种快速、简便、高效的RA和STV提取方法,推动高RA苷含量、高RA/STV甜叶菊新品种选育。
由于RA和STV都为具有一定水溶性的化合物,目前有关甜叶菊种质RA和STV提取的方法都是以溶剂浸提法为基础发展起来的,所使用的溶剂包括水、甲醇等[10-14],并通过超声、加热等方式来促进RA和STV向溶剂传递。超声助溶乙醇提取法以操作简便、提取效率高、环境污染小而被人们广泛应用于植物化学组分的分离提取[15-17],但在甜叶菊RA和STV提取分离中的应用还未见报道。为探讨超声助溶乙醇提取法在甜叶菊RA和STV提取分离中的应用,优化现有提取体系,本研究采用单因素结合正交设计实验,对超声助溶乙醇提取法中提取用乙醇体积分数、超声时间、超声提取水浴温度等因素对RA和STV提取效率的影响进行了联合分析,优化了各提取参数,并以现有提取体系为参照,对本提取方法的优越性进行了检验。
1 材料和方法
1.1 材料处理
1.1.1 材料研究所用材料为甜叶菊扦插苗鑫农4号叶片,由安徽宿州群富甜叶菊专业合作社提供,经鉴定为菊科植物甜叶菊(S.rebaudiana)。
1.1.2 材料的预处理将所得鑫农4号叶片剔除杂质和色泽灰暗者后,80℃烘干,于研钵中研磨充分,过60目筛,于干燥器中保存备用。
1.1.3 材料的处理精确称取50mg甜叶菊粉末,加入各体积分数的乙醇1.0mL,混匀,室温振荡过夜,置相应水温水浴的KQ2200E型超声波清洗仪中超声提取相应时间后10000r/min离心10min,取上清,重复提取3次后合并上清,4℃保存备用。同时设3个提取重复。
在2.3验证对比实验中涉及的前人相关样品处理方法分别参照相应文献方法进行(表2)。其中,文献1为利用甲醇室温超声提取10min,重复提取3次合并提取液[10]。文献2是以水为提取用溶剂室温振荡浸提2h后再用正丁醇萃取的方法,重复提取3次合并提取液[11]。文献3是利用水100℃振荡浸提30min,重复提取3次合并提取液[12]。文献4是利用pH为7.0的0.01M磷酸缓冲液(钠盐)100℃振荡浸提5min,重复提取3次合并提取液[13]。文献5是利用pH为7.0的0.01M磷酸缓冲液(钠盐)68℃振荡浸提32min,重复提取3次合并提取液[14]。各提取液的精制等后续处理参照Liu[14]等方法进行。
1.2样品的检测
参照JECFA(2010)[18]方法检测各样品RA及STV含量。利用EXCEL(2007)处理各检测数据和制图。
2 结果与分析
2.1 单因素实验
2.1.1 乙醇体积分数对RA和STV提取效率的影响图1结果显示RA和STV得率受提取所用乙醇体积分数的影响较大。在料液比1∶20(m:v),室温下超声提取40min的条件下,随提取所用乙醇体积分数从0%增大至30%,RA和STV得率迅速增大,当提取所用乙醇体积分数为30%,50%和70%时,RA和STV得率受所用乙醇体积分数的影响不明显,当提取所用乙醇体积分数超过70%时,RA和STV得率下降,当提取所用乙醇体积分数为100%时,RA和STV的得率都降到最低。
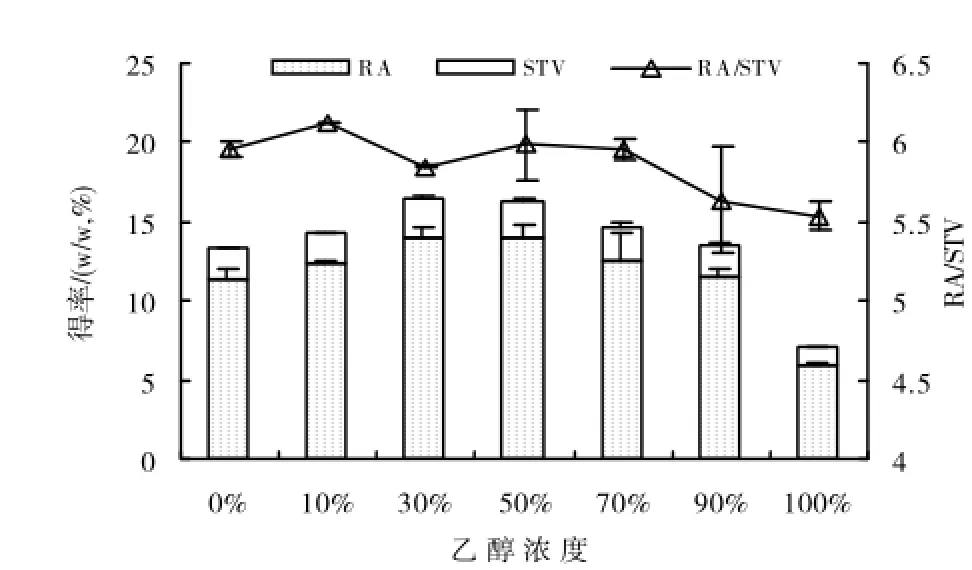
图1 提取用乙醇浓度对RA和STV得率和RA/STV的影响
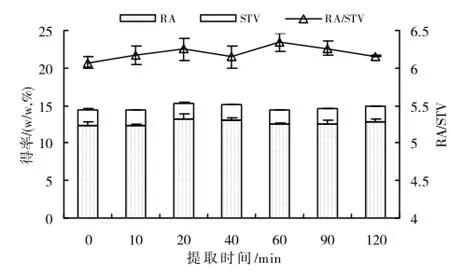
图2 提取时间对RA和STV得率和RA/STV的影响
同时,图1结果还显示RA和STV得率比例也受提取所用乙醇体积分数的影响。总的表现为随提取所用乙醇体积分数的增大而逐渐降低,当提取所用乙醇体积分数为100%时,RA和STV的得率比例最低,但是当提取所用乙醇体积分数为30%、50%和70%时,RA和STV的得率比例间差异不显著。
2.1.2 超声提取时间对RA和STV提取效率的影响根据实验2.1.1的结果,用体积分数为30%的乙醇以料液比1∶20,在室温下超声提取不同时间,以检测超声提取时间对RA和STV得率及其得率比例的影响。
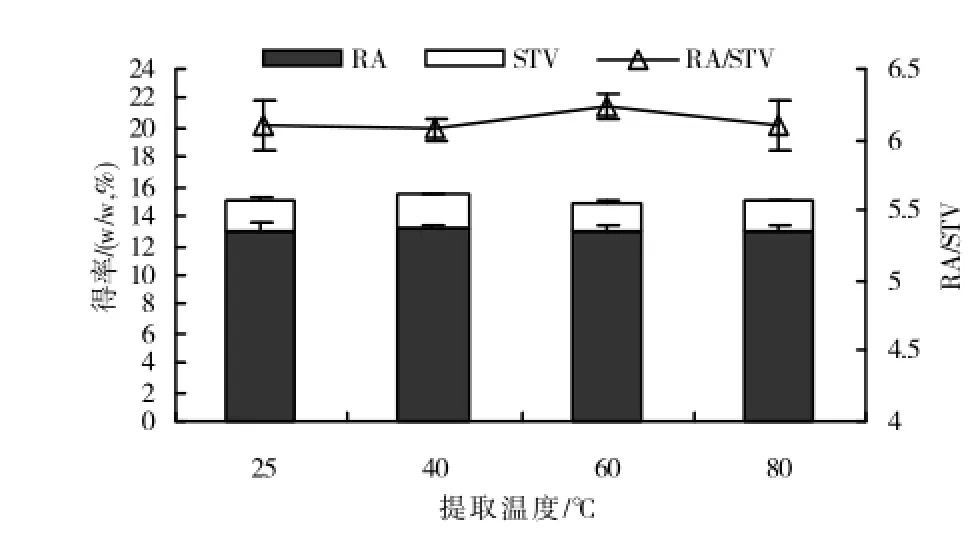
图3 提取水浴温度对RA和STV得率和RA/STV的影响

表1-1 正交设计实验结果及分析结果
图2结果显示,超声提取时间对RA和STV得率及得率比例的影响不是特别明显,但当超声提取时间小于20min时,RA和STV得率及其得率比例随超声提取时间的延长而增大,当超声提取时间大于20min时,RA和STV得率及其得率比例受超声提取所用时间的影响不明显,各处理间差异不显著。
2.1.3 超声提取温度对RA和STV提取效率的影响根据实验2.1.1和实验2.1.2的结果,用体积分数为30%的乙醇以料液比1∶20,分别在室温(25℃)、40℃、60℃和80℃下超声提取40min,以检测超声提取水浴温度对RA和STV得率及其得率比例的影响。图3结果显示,超声提取水浴温度对RA和STV得率及其得率比例的影响不明显,但当超声提取水浴温度超过40℃时,RA和STV得率表现出轻微的下降;而RA和STV得率比例受超声提取水浴温度的影响不明显,各处理间差异不显著。
2.2正交设计实验
根据实验2.1.1、实验2.1.2和实验2.1.3的结果,用正交设计实验联合分析提取用乙醇体积分数、超声提取水浴温度和超声提取时间三因素对RA和STV得率的影响,具体的实验及分析结果见表1-1、1-2。RA和STV得率受提取用乙醇体积分数、超声提取水浴温度和超声提取时间三因素影响由强到弱的顺序都表现为超声提取时间>提取用乙醇体积分数>超声提取水浴温度。在上述三因素中,除提取温度对RA和STV得率的影响都一样外(最佳提取温度为40℃),提取用乙醇体积分数和超声提取时间对RA和STV得率的影响不同。
首先,提取用乙醇体积分数对RA和STV得率影响出现极化现象,即,对RA最适合的提取用乙醇体积分数为30%,而对STV最适合的提取用乙醇体积分数为70%;而超声提取时间对RA和STV得率的影响都表现为适当延长超声提取时间可以提高RA和STV得率,对RA最适合的超声提取时间为60min,而对STV最适合的超声提取时间为40min。为实现RA和STV的充分提取和同步检测,结合表1结果,本研究将甜叶菊叶片RA和STV提取各参数确定为:提取用乙醇体积分数为50%、超声提取水浴温度为40℃、超声提取时间为60min。
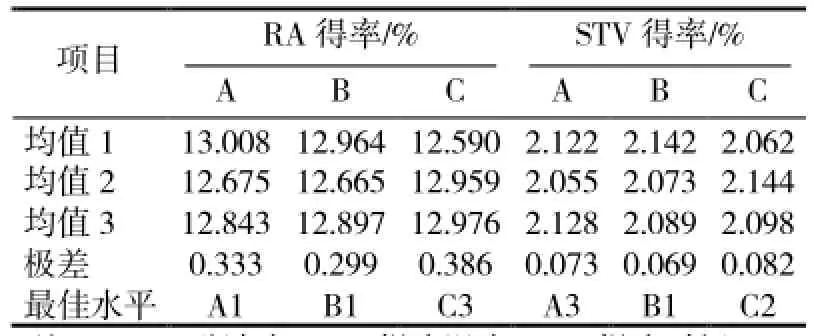
表1 -2 正交设计实验结果及分析结果
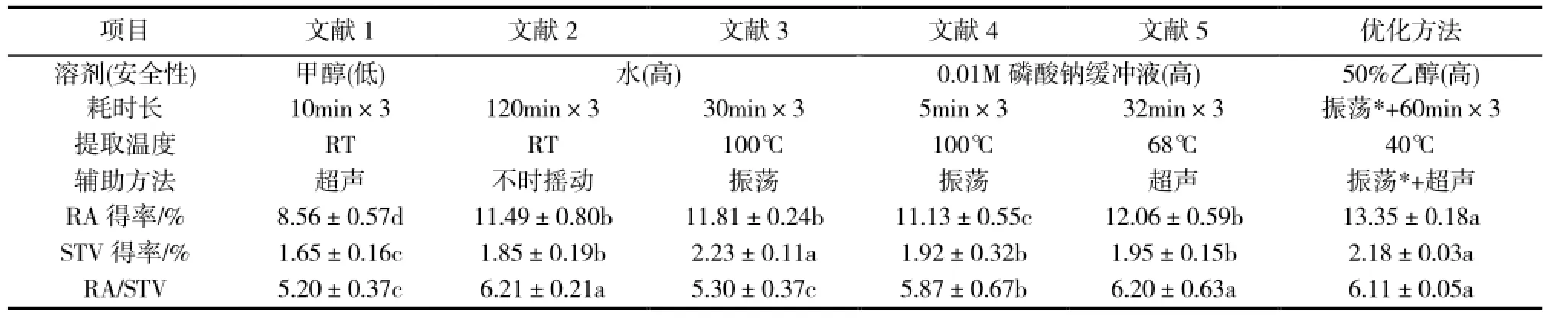
表2 本优化方法与文献方法的比较
2.3 验证对比实验
为进一步验证实验2.2所确定的超声提取各因素组合对RA和STV得率及得率比例的影响,本实验在正交设计实验2.2的基础上,联合已发表的相关方法对本研究正交设计实验2.2所确定的RA和STV提取方法进行了验证。表2的结果表明,与已发表的5种方法相比较,实验2.2所确定的方法在提高RA和STV得率、维持RA和STV得率比例参数的稳定性等方面显示出了较好的优越性,可作为准确评估甜叶菊种质叶片RA和STV含量及其比例的提取方法。
3 讨论和结论
RA和STV为现有甜叶菊栽培品种叶片中的主要甜菊糖苷类物质,随着市场对RA需求量的增加[11],须大力开展高RA苷含量和高RA/STV含量比值的甜叶菊新品种选育,为促进甜叶菊新品种的选育,有必要建立一种可用于甜叶菊种质RA和STV含量特性分析的快速、简便、高效的RA和STV提取方法。超声助溶乙醇提取法以其溶媒极性可调、操作简便、提取效率高、环境污染小而被广泛应用于植物化学组分的分离提取[15-17],但在甜叶菊RA和STV提取分离中还未见报道。为此,本研究对以水和乙醇的混合溶媒在甜叶菊种质评价时RA和STV提取上的应用进行了探讨。
正交设计实验结果表明提取用溶媒极性对RA和STV得率影响是除提取时间外影响最大的因素(表1)。现有的RA和STV提取方法都是基于单一溶媒(水或甲醇)而建立的,我们在研究中发现RA和STV具有不同的水溶性,其中RA由于其分子结构上具有3个葡萄糖基团,其水溶性较STV强,而STV的脂溶性较强(未发表资料)。图1的结果显示:RA和STV得率在纯水和纯乙醇的情况下远低于使用混合溶媒的情况,这是目前为止有关混合溶媒在RA和STV提取上的首次应用报道。这一结果同时也得到了实验2.3中相关研究结果的印证,表明在甜叶菊种质评价中,与采用纯合试剂作为提取用溶媒相比,较宜利用两极性不同的溶剂配制适宜比例的混合溶剂来提取。可以进一步推断的是,由于甜叶菊体内存在的30多种甜菊糖苷类化合物间分子结构和极性差异大,若欲进一步详细评价甜叶菊种质中各甜菊糖苷组分含量,深入评估不同极性混合溶媒在各甜菊糖苷组分提取中的可行性应是一个大的研究方向。
适宜水浴温度可促进溶质向溶媒的扩散,提高超声提取效率,图3的结果显示,与常温相比较,当水浴温度为40℃时,RA和STV的得率有所提高;但是,当水浴温度高于40℃时,RA和STV的得率反倒表现出不明显的轻微下降,这可能是由于过高的提取温度易于引起混合溶媒中乙醇的部分挥发,使提取体系中乙醇随提取时间的延长而部分减少所致。需要说明的是,为克服这一现象,本研究采用的是密闭体系,但也观察到提取用试管的局部区域出现液滴,这有可能就是在超声过程中挥发出的乙醇,从而引起与物料实际接触的溶媒中乙醇量的减少。当然,由水浴温度所引起的提取体系局部乙醇量轻微减少对RA和STV得率影响并不严重,因为实验2.2的正交设计分析结果表明提取用水浴温度对RA和STV的得率的影响在本研究所探讨的3个因素中为最小(表1),这一结果也为实验2.1.3有关超声提取水浴温度对RA和STV得率及其得率比例影响不明显的结果所印证(图3)。
实验2.3的结果表明,与现有已发表的方法相比较,依照本研究所建立的方法所得RA和STV得率明显较高,同时,数据误差小、精确性高(表2)。为此,本研究建立了一种在RA和STV得率等方面明显优于已有方法,可更充分地提取甜叶菊叶片所含以RA和STV为代表的甜菊糖苷,为更快速准确评价甜叶菊种质RA和STV含量特性奠定了基础,具有快速、简便、高效等优点,具体的提取方法为:将甜菊叶片粉末按料液比1∶20(m:v)加入50%(v:v)乙醇,室温振荡过夜,40℃下超声提取60min。
[1]黄应森,陆荣刚.甜菊栽培技术[M].南京:江苏科学技术出版社,1981
[2]Ohta M,Sasa S,Inoue A,Tamai T,Fujita I,Morita K,Matsuura F.Characterization of novel steviol glycosides from leaves of Stevia rebaudiana Morita[J].J.Appl.Glycosci.,2010,57(3):199-209.
[3]Chaturvedula VSP,Clos JF,Rhea J,Milanowski D,Mocek U,DuBois GE,Prakash I.Minor diterpenoids glycosides from the leaves of Stevia rebaudiana[J].Phytochem.Lett.2011,4(3):209-212.
[4]舒世珍.新糖料作物——甜叶菊在京试种成功[J].农业科技通讯,1979(2):19-20.
[5]舒世珍.甜菊引种三十年[J].中国种业,2010(6):21-23.
[6]何毓娟,黄彩云,李淑萍.甜叶菊的育种目标及品种选育[J].种子世界,1997(9):36-37.
[7]杨文婷,蔡乾蓉,徐应文,等.四川引种甜叶菊的糖苷含量变异及优良单株筛选[J].中国糖料,2010(2):27-30,34.
[8]王贵民,董振红,郝再彬.甜叶菊糖苷的应用和安全性的研究进展[J].中国食品添加剂,2007,6:65-69.
[9]洪维廉,陈睦传,李里焜,刘丹.甜菊不同叶龄细胞结构及其甜菊糖甙含量分布的研究[J].武汉植物学研究,1987,5(3):211-218,315-316.
[10]Claudio Gardanaa,Martina Scaglianti,Paolo Simonetti.Evaluation of steviol and its glycosides in Stevia rebaudiana leaves and commercial sweetener by ultra-high-performance liquid chromatography-mass spectrometry[J].Journal of Chromatography A, 2010,1217(9):1463-1470.
[11]Latha Sivaram,Usha Mukundan.In vitro culture studies on steviarebaudiana[J].In Vitro Cell.Dev.Biol.—Plant,2003,39(5):520-523.
[12]Ursula Woelwer-Rieck,Christa Lankes,Andreas Wawrzun,Matthias W¨ust.Improved HPLC method for the evaluation of the major steviol glycosides in leaves of Stevia rebaudiana[J].Eur Food Res Technol,2010,231(4):581-588.
[13]Antonio S.Dacome,Cleuza C.da Silva,Cec'lia E.M.da Costa,Jose'D.Fontana,Juliana Adelmann,Silvio Cla'udio da Costa. Sweet diterpenic glycosides balance of a new cultivar of Stevia rebaudiana(Bert.)Bertoni:Isolation and quantitative distribution by chromatographic,spectroscopic,and electrophoretic methods[J].Process Biochemistry,2005,40(11):3587-3594.
[14]Liu J,Li JW,Tang J.Ultrasonically assisted extraction of total carbohydrates from Stevia rebaudiana Bertoni and identification of extracts[J].Food and Bioproducts Processing,2010,88(2):215-221.
[15]谢秋涛,李高阳.超声波辅助乙醇提取法提取玫瑰色素[J].食品与机械,2012,28(3):148-150.
[16]谢阳姣,何志鹏,谢冬养,等.超声辅助乙醇提取油茶籽饼多酚工艺的优化[J].南方农业学报,2012,43(4):515-519.
[17]梁兴飞,郭宗楼.超声辅助热乙醇提取法测定浮游植物叶绿素a的方法优化[J].水生生物学报,2010,34(4):856-861.
[18]FAO.STEVIOL GLYCOSIDES[S].FAO JECFA Monographs,2010,10.
Optimization of Ultrasonic-assisted Ethanol Extraction of RA and STV for Analysis of Steviosides Content in Stevia
LUO Qing-yun,TIAN Min,XIE Yue-sheng,LIN Ying-ying,WANG Kang-cai
(College of Horticulture,Agricultural University of Nanjing,Nanjing 210095,China)
Method of ultrasonic-assisted ethanol extraction was optimized for establishing a sample preparation system for RA and STV content analysis in stevia germplasm.Firstly,3 factors of the ethanol concentration, extraction time and extraction temperature were optimized by using single factor experiments combined with orthogonal design experiments,and then the superiority of the established sample preparation system was tested by compared with 5 the existed preparation systems.Results showed that the newly established system was better than existed ones in the yields of RA and STV,and the specific operation process for the stevia leaf powder was added 20 times(m:v)50%ethanol and oscillated at room temperature overnight,and then ultrasonic extracted under 40℃for 60 minutes.
stevia;stevioside;extraction;optimization;RA;STV
566.901
A
1007-2624(2014)02-00010-04
10.13570/j.cnki.scc.2014.02.004
2013-08-30
高等学校博士学科点专项科研基金项目“磷酸化修饰对甜叶菊糖基转移酶UGT76G1糖基化Stevioside形成Rebaudioside A的调控机制研究”(20120097120033)。
罗庆云(1974-),男,重庆市垫江人,博士,讲师。研究方向:植物次生代谢生理与遗传。E-mail:qyluo@njau.edu.cn
——甜菊糖苷及其在食品中的应用

