Fenton氧化法降解HMX 废水中有机物的氧化反应动力学
焦纬洲,郭 亮,刘文丽,苏 强,李 静,许承骋,高 璟,刘有智
(1.中北大学 山西省超重力化工工程技术研究中心,山西太原030051;2.甘肃银光化学工业集团有限公司,甘肃白银730900)
引 言
HMX 具有爆速高、密度大、热安定性好等优点,是当前能量水平最高、综合性能最好的单质炸药之一[1-5],然而在其生产过程中排放的废水含有多种毒性物质,具有毒性大、难生物降解、排放量大等特点。目前,对于废水的处理主要有焚烧法、活性炭吸附法、电化学氧化等方法[6-10],这些传统的处理方法效率较低,处理后的残留物仍为污染物或危险物,需做进一步处理才能排放。
Fenton氧化法作为一种高级氧化技术,在处理难降解炸药废水中具有独特的优势。Fenton氧化法由H2O2与Fe2+组成氧化体系,通过催化分解产生羟基自由基(·OH)进攻有机物分子,并使其氧化为CO2、H2O 等无机物质,从而实现对难降解物质 的深度氧 化[11-12]。目前,关于HMX废水处理的研究报道多为模拟废水,一般都是配制的HMX溶液,其污染物成分比较单一,而对实际废水的研究很少[13]。本实验以HMX 实际生产废水为对象,对Fenton氧化体系的动力学进行了研究,为HMX 废水的处理提供一定的理论依据。
1 实 验
1.1 材料及仪器
废水来自HMX 生产过程中产生的废水,为淡黄色透明澄清液体,初始pH 值为1.8,COD 值为7000mg/L;30%(质量分数)的过氧化氢,分析纯,天津市天力化学试剂有限公司;重铬酸钾,分析纯,上海浦江化工厂;七水合硫酸亚铁(FeSO4·7H2O),分析纯,上海市第二钢铁厂。
XJ-Ⅰ型COD 消解装置,广东省医疗器械厂;pH-3C型精密pH 计,上海先导科技有限公司;TG328B电子天平,上海天平仪器厂;HZ85-2磁力搅拌器,北京中兴伟业仪器有限公司;HH-S恒温水浴锅,上海艾牧生物科技有限公司。
1.2 实验方法
取50mLHMX 废水置于烧杯中,调节废水pH值到预定值(酸性),准确称取定量的FeSO4·7H2O加入废水中,搅拌,待FeSO4·7H2O 完全溶解后,再加入一定量30%的H2O2,混合均匀后开始反应。达到设定的反应时间后,调节废水pH 值,静置沉淀后,取上层清液测定反应后废水的COD值,水样COD值的测定依据重铬酸钾法(GB/T 11914-1989)。
1.3 反应原理
Fenton氧化体系中通过一系列的链式反应,产生了大量的自由基·OH[13]。

当有机物RH 存在时,·OH 与RH 反应产生新的自由基R·,新的自由基R·又会被Fe3+氧化成新的产物和Fe2+,Fe2+能确保前面链式反应的顺利进行。
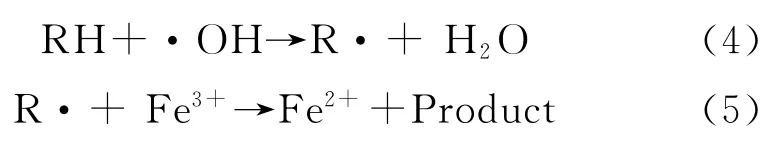
1.4 正交实验
Fenton氧化法处理废水的关键是·OH 的产量。影响·OH 的因素主要有废水初始pH 值、Fe2+的投加量、H2O2的投加量、反应温度、反应时间等。本实验中主要考察以上5个操作因素的影响,在各因素中选取5个水平进行正交实验设计。各因素所选水平如表1所示。

表1 正交实验的各因素及所选水平Table 1 Factors and selected levels of orthogonal experiment
按照正交实验设计表进行实验安排,以COD去除率为考察指标,将实验结果通过计算均值和极差,得出正交实验直观分析表(见表2),选出显著性指标、优化水平与优化水平组合。

表2 正交实验直观分析表Table 2 Direct analyzing table of orthogonal experiment
从表2可以得出5个因素对COD 去除率产生影响的顺序为:H2O2投加量>反应温度>反应时间>pH 值>FeSO4投加量。H2O2投加量是影响COD 去除率的主要因素,这是因为Fenton氧化法是由H2O2在Fe2+的催化作用下产生氧化性更强的羟基自由基来降解有机物的。因此,H2O2投加量直接决定着Fenton试剂的氧化降解效果与处理废水的有效性和经济性;根据表2确定适宜的实验条件为:H2O2投加量为2mol/L,FeSO4投加量为0.05mol/L,pH 值为3,温度为20℃,反应时间为1.5h,此时COD 去除率为68.5%。
2 动力学研究
2.1 反应速率常数的求解
分别量取3 组50mLHMX 废水置于烧杯中,调节水样pH 值为3,固定FeSO4投加量为0.05mol/L,H2O2投 加 量 为2mol/L,H2O2一 次性投加,反应时间1h,分别在20、30、40℃下进行动力学实验,取样间隔为10min,结果见图1。
从图1可以看出,反应在1h内,COD 去除率随着时间的增加基本呈直线上升趋势。若该反应为一级反应,可以用式(6)表示:

式中:Ct为反应t时刻废水的COD 值,mg/L;C0为废水的初始COD 值,mg/L;k 为反应速率常数,min;t为反应时间,min。
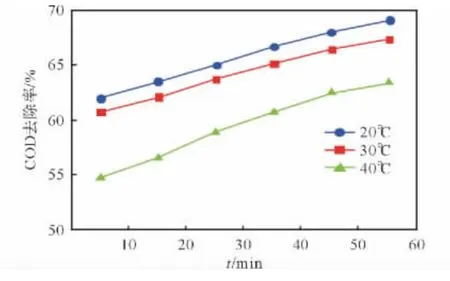
图1 不同温度下COD 去除率随时间的变化曲线Fig.1 Curves of change in the COD removal efficiency of HMX wastewater with time at different temperatures
以ln(C0/Ct)为纵坐标,时间为横坐标进行线性拟合,结果见图2。从图2 可以看出,1h 内各温度下Fenton氧化反应基本符合一级反应动力学,并且实验数据经线性回归后有很好的相关性,R2均在0.99以上。各拟合直线的斜率即为该反应温度下的反应速率常数。
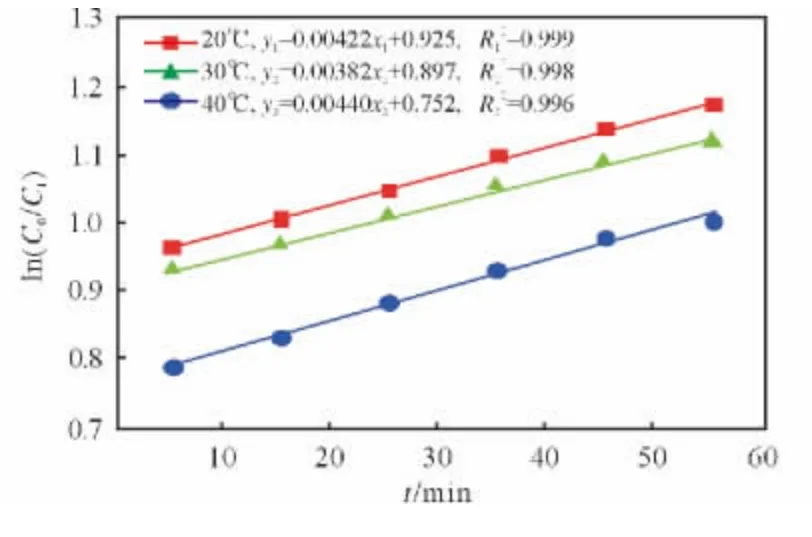
图2 反应速率常数的回归曲线Fig.2 Regress curves of reaction rate constants
2.2 反应活化能的求解
由Arrhenius方程可知:

式中:A 为指前因子,单位与k 相同;Ea为活化能,kJ/mol;R 为气体摩尔常数,8.314J/(mol·K);T为热力学温度,K。
将Arrhenius方程两边取对数,可得:
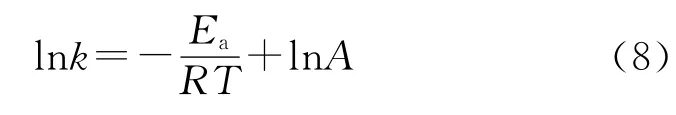
以不同温度下的反应速率常数k为研究对象,以-lnk为纵坐标,1/T 为横坐标作图并进行线性拟合,结果见图3,由拟合直线的斜率和截距可求得:Ea为7.03kJ/mol,指前因子A 为0.067 7min-1。该反应的活化能较小,可在常温下快速反应,反应1h以内,其反应速率常数可表示为:
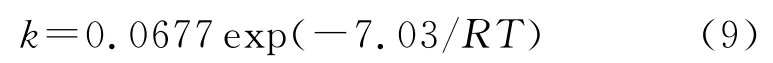

图3 反应速率常数k与温度的关系Fig.3 Reaction rate constants kvs.temperature
3 结 论
(1)通过实验得出各因素对废水处理效果影响的大小顺序为:H2O2的投加量>反应温度>pH 值>反应时间>FeSO4的投加量,并确定适宜条件为:H2O2投 加 量 为2mol/L,FeSO4投 加 量 为0.05mol/L,pH 值为3,温度为20℃,反应时间为1.5h。
(2)在实验范围内,Fenton 氧化法处理HMX废水为一级反应,该反应的活化能较小,仅为7.03kJ/mol,其反应速率常数可表示为:
k=0.0677exp(-7.03/RT)
[1] WEI Zhi-xian,XU Yan-qing,LIU Hai-yan,et al.Preparation and catalytic activities of LaFeO3and Fe2O3for HMX[J] .Journal of Hazardous Materials,2009,165:1056-1061.
[2] WANG Luo-xin,TUO Xin-lin,YI Chang-hai,et al.Ab initio calculations of the effects of H+and NH+4on the initial decomposition of HMX[J].Journal of Molecular Graphics and Modelling,2008,27:388-393.
[3] Pouretedal H R,Keshavarz M H,Yosefi M H,et al.Photocatalytic degradation of HMX and RDX wastewater with CdS/Cu Nanophotocatalyst[J].Chinese Journal of Energetic Materials,2008,16(6):745-751.
[4] Koutsospyrosa A,Pavlovb J,Fawcettb J d,et al.Degradation of high energetic and insensitive munitions compounds by Fe/Cu bimetal reduction[J].Journal of Hazardous Materials,2012,219-220:75-81.
[5] 张丹,郭伟男,余江.体相光催化处理有机废水新工艺[J].化工学报,2011,62(4):1077-1083.ZHANG Dan,GUO Wei-nan,YU Jiang.New photocatalytic reactor for treatment of organic wastewater[J].CIESC Journal,2011,62(4):1077-1083.
[6] AN Fu-qiang,FENG Xiao-qin,GAO Bao-jiao.Adsorption mechanism and property of a novel adsorption material PAM/SiO2towards 2,4,6-trinitrotoluene[J].Journal of Hazardous Materials,2009,168:352-357.
[7] 叶国祥,周烁灵,唐佳玙,等.Fe-C 微电解法预处理高浓度印染废水的研究[J].高校化学工程学报,2011,25(3):489-494.YE Guo-xiang,ZHOU Shuo-ling,TANG Jia-yu,et al.High concentration dyeing waste water pretreatment by Fe-C micro-electrolysis[J].Journal of Chemical Engineering of Chinese Universities,2011,25(3):489-494.
[8] Zoh K D,Stenstrom M K.Fenton oxidation of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX)and octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine(HMX)[J].Water Research,2002,36(5):1331-1341.
[9] 董秀芳,刘有智,李同川.焚烧法处理硝基化合物生产过程中产生的碱性废水[J].化学工程师,2005(1):25-27.DONG Xiu-fang,LIU You-zhi,LI Tong-chuan.Treat basicity wastewater during nitryl compound production by incineration method[J].Chemical Engineer,2005(1):25-27.
[10]王贵珍,李丽欣,李永真,等.毛竹活性炭制备及其对含苯酚废水吸附的研究[J].高校化学工程学报,2010,24(4):700-704.WANG Gui-zhen,LI Li-xin,LI Yong-zhen,et al.Study on the preparation of bamboo activated carbon and its phenol adsorption properties[J].Journal of Chemical Engineering of Chinese Universities,2010,24(4):700-704.
[11]Che H,Bae S J,Lee J.Degradation of trichloroethylene by Fenton reaction in pyrite suspension[J].Journal of Hazardous Materials,2011,185:1355-1361.
[12]Ayoub K,Nélieu S,Eric D.TNT oxidation by Fenton reaction:Reagent ratio effect on kinetics and early stage degradation pathways[J].Chemical Engineering Journal,2011,173:309-317.
[13]尹娟娟,袁凤英,宋伟冬,等.超声助Fenton试剂处理HMX 炸 药 废 水[J].火 炸 药 学 报,2009,32(1):55-58.YIN Juan-juan,YUAN Feng-ying,SONG Wei-dong,et al.Treatment of HMX wastewater with US/Fenton Technology[J].Chinese Journal of Explosives and Propellants,2009,32(1):55-58.

