长期双酚A暴露对成年小鼠恐惧记忆的影响*
张 勤 徐晓虹,2 刘幸毅 董芳妮 杨艳玲 张广侠
(1浙江师范大学化学与生命科学学院; 2浙江师范大学心理研究所, 浙江金华 321004)
1 前言
双酚A (bisphenol-A, BPA)是酚类化合物中具有代表性的环境内分泌干扰物, 是全球产量最高的化合物之一, 2011年产量高达1000万镑, 广泛用于生产碳酸聚酯、环氧树脂、聚苯乙烯树脂,也用于制造阻燃剂、橡胶防老化剂、抗氧化剂、涂料等精细化工产品。BPA与人类日常生活密切相关, 食品和饮料包装、婴儿奶瓶、牙科固封剂、热敏纸等材料中普遍含有BPA (Vom, Nagel, Coe, Angle, & Taylor,2012)。BPA结构与人工合成激素乙烯雌酚(Diethylstilbestrol, DES)类似, 与雌激素受体有一定的亲和力, 具有拟雌激素、抗雌激素和抗雄激素活性(Negishi et al., 2003)。目前已知发育期BPA暴露可以影响啮齿类动物成年后包括学习记忆、焦虑、社会交互等多种神经行为(陈蕾, 徐晓虹, 田栋,2009; Gonçalves, Cunha, Barros, & Martínez, 2010;Kim et al., 2011; Jašarević et al., 2013)。由于雌激素不仅影响脑的发育, 同时也参与成年脑的可塑性和认知功能(Kim, & Casadesus, 2010; Barha, Dalton,& Galea, 2010), 因此, 成年期BPA暴露对啮齿类动物脑和行为的影响受到关注。最近的研究发现,BPA可减少正常雄性大鼠的突触数目, 抑制睾丸摘除大鼠雄激素诱导的海马 CA1区棘突触的形成(Leranth, Szigeti-Buck, Maclusky, & Hajszan, 2008);BPA还可干扰成年小鼠的神经可塑性而损伤记忆形成(Eilam-Stock, Serrano, Frankfurt, & Luine,2012)。
条件性恐惧(fear conditioning)的形成既是一种学习和记忆的过程, 也是一种情绪的形成过程, 它可以激发动物在面临威胁时的一系列防御机能, 对动物的生存至关重要。条件恐惧模型广泛用于恐惧记忆的研究, 通过对动物进行厌恶性的不可逃避刺激(unconditioned stimulus, US), 如足底电击, 与中性刺激(conditioned stimulus, CS)如灯光、声音、环境等的配对训练, 使动物再次暴露于训练环境中时即表现出对CS的恐惧或焦虑反应, 如僵立(freeze)(Santos, Martinez, & Brandão, 2006)。大量证据表明,杏仁核、海马和内侧前额叶皮层在恐惧记忆的形成、保持及消退中起重要作用。毁损海马可以破坏恐惧记忆的获得与巩固(Li et al., 2006)。条件恐惧引发的僵立反应可被抗焦虑药反转, 因此也是广泛用于研究焦虑症的模型。雌激素参与调节恐惧和焦虑行为, 苯甲酸雌二醇上调卵巢摘除小鼠的恐惧记忆和焦虑状态(Morgan, & Pfaff, 2001), 据此, 我们推测环境内分泌干扰物 BPA可能影响小鼠的恐惧记忆。
学习记忆过程受表观遗传调节, 组蛋白乙酰化是表观遗传调节的重要方式。四个核心组蛋白(H2A,H2B, H3和H4)的翻译后修饰, 特别是组蛋白乙酰化, 涉及到转录的调节和记忆的形成(Korzus,Rosenfeld, & Mayford, 2004; Wood et al., 2005)。有人发现, 场景性条件恐惧(contextual fear conditioning)训练显著上调海马组蛋白H3 (histone 3)乙酰化水平,这一过程依赖 N-甲基-D-天门冬氨酸(N-methy-D-aspartate, NMDA)和细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)的活化,能够被 NMDA受体拮抗剂或 ERK阻断剂所阻断(Levenson et al., 2004)。而且ERK可以调节转录因子如 cAMP应答元件结合蛋白(cAMP-response element binding protein, CREB)的活性, 由后者开启记忆相关基因的转录。因此, 场景性条件恐惧记忆的形成需要 NMDA受体的开启、ERKs的活化,以及最终的转录调节(Levenson et al., 2004)。假如BPA影响条件恐惧记忆, 那么是否与组蛋白乙酰化的改变有关呢?本文将对此进行探讨。
2 实验材料和方法
2.1 动物模型制备与分组
清洁级9周龄ICR雄性小鼠, 体重25~30 g, 购于浙江金华药检所。小鼠购入后随机分笼饲养, 昼夜 12小时交替, 室温 26±2℃, 湿度 50~60%, 食物与水自由摄取。待小鼠适应1周后, 随机分为0.4、4、40 mg/kg/d BPA暴露组和花生油溶媒对照组(n
=26), 每天上午8点开始灌胃BPA, 连续染毒90 d。染毒剂量根据前期实验确定(刘幸毅 等, 2013)。每周称量小鼠体重, 调整灌胃体积。染毒结束后三天进行行为学检测。2.2 场景性条件恐惧行为训练和检测
场景性条件恐惧实验根据文献报道的方法(Chwang, O'Riordan, Levenson, & Sweatt, 2006; 吴冰, 胡波, 隋建峰, 2010)在有机玻璃室(30.5 cm ×30.5 cm × 43.5 cm)中进行, 底部为导电的不锈钢栅。将小鼠放入条件恐惧箱中适应 3 min, 同时测定其僵立时间。24 hr后开始恐惧训练, 将小鼠放入原条件恐惧箱中适应2 min后给予电击(1 s, 45 V),间歇2 min后再次给予电击, 共给予3次电击。电击结束后动物在条件恐惧箱中停留 30 s后放回鼠房。1 hr或24 hr后进行恐惧记忆检测。检测时, 将小鼠再次放入条件恐惧箱内3 min, 记录3 min内小鼠的僵立时间, 而后取出。每组有10只小鼠在恐惧训练后1 hr进行记忆检测, 另外10只小鼠在训练后24 hr检测。僵立行为是一种普遍见于啮齿类的防御行为, 表现为刻板式的蹲伏姿势, 除呼吸运动以外的所有肌肉运动均消失至少1 s以上, 是啮齿类恐惧表达的行为方式(Blanchard, & Blanchard,1969)。每个动物训练及测试完成后都用100%酒精清洁反射箱, 然后进行下一只小鼠的行为操作。所有动物行为用小动物行为分析系统(TSE System GmbH, 德国)实时记录。
2.3 蛋白样品的制备
在条件恐惧训练前、训练后1 hr和24 hr每组分别随机取6只小鼠(n
= 6)断头取脑, 冰上分离双侧海马保存于-80℃冰箱。按 1:10比例加入相应体积的RIPA (强)蛋白裂解液, 匀浆后, 4℃下12,000 g离心 10 min, 取上清加入上样缓冲液后煮沸 3~5 min变性, 分装, -20℃保存, 用于NMDA受体亚基NR1、ERK1/2、p-ERK1/2、组蛋白去乙酰化酶 2(histone deacetylase 2, HDAC2)和β-actin的蛋白检测。沉淀重悬于200 µl 0.25 M HCl, 4℃过夜, 4℃下12,000 g离心10 min, 取上清加入上样缓冲液后煮沸3~5 min变性, 分装, -20℃保存, 用于组蛋白H3和乙酰化组蛋白H3K14的蛋白检测。2.4 Western blot分析
取 15~20 μl蛋白样品按常规方法进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳。将蛋白湿转至硝酸纤维素(NC)膜上后, 用 5%脱脂牛奶封闭 2 hr; 分别与一抗 NR1 (1:600, Santa Cruz Biotechnology, USA)、ERK1/2和p-ERK1/2 (1:400,Cell signaling Technology, USA)、H3K14 (1:1000,Upstate Biotechnology, USA)、HDAC2和H3 (1:1000,碧云天, 中国)、β-actin (1:1000, Cell signaling Technology, USA) 4℃孵育过夜, TBST (20 mmol/L Tris-HCl, pH = 7.5; 0.15 mmol/L NaCl)漂洗 3×10 min; 二抗孵育1 hr, 漂洗3×10 min; 显色, 用免疫化学发光试剂(ECL)反应 1~2 min后, 用保鲜膜覆盖NC膜, X-胶片(美国Kodak公司)曝光。扫描仪扫描蛋白条带图后, 用 Quantity one (Bio-rad Laboratories, USA)软件半定量分析条带光密度。
2.5 数据统计
所有数据用平均值±标准误表示, 采用 SPSS 17.0统计软件分析。场景性条件恐惧行为数据及蛋白检测结果均采用重复双因素(BPA暴露×电击)方差分析(Two-way repeated ANOVAs), 然后进行Tukey's 检验。p
<0.05作为具有统计学差异显著性。3 结果
3.1 BPA暴露对成年小鼠恐惧记忆的影响
双因素方差分析表明, BPA暴露×电击交互作用(F
(6,140) = 15.821,p
<0.001)、主因素剂量(F
(3,148) = 27.490,p
<0.001)或电击(F
(2,149) =89.37,p
<0.001)均极显著影响小鼠的僵立时间。与电击前相比, 正常小鼠在遭电击后1 hr、24 hr的僵立时间均显著延长(p
<0.01,p
<0.05), 表现出很强的场景性条件恐惧反应, 说明恐惧性条件反射成功建立。长期 BPA暴露促进恐惧的形成和保持。与对照组相比, BPA (40 mg/kg/d)延长成年小鼠恐惧训练后1 hr和24 hr的僵立时间(p
<0.01,p
<0.05), 而BPA (4 mg/kg/d)显著延长恐惧训练后1 hr的僵立时间(p
<0.05), 表明成年小鼠长期暴露于BPA不仅提高恐惧记忆的获得, 还可延长恐惧记忆的保持, 减缓恐惧记忆消退(图1)。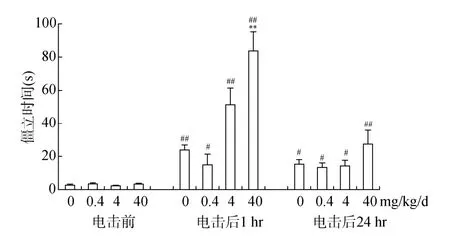
图1 长期BPA暴露对成年雄性小鼠条件恐惧训练后僵立时间的影响(M±SE, n = 10)
3.2 BPA暴露对海马NMDA受体NR1亚基表达的影响
考虑到场景性条件恐惧记忆与海马 NMDA受体的密切关系, 进一步测定了小鼠恐惧训练前、后海马NMDA受体NR1亚基的表达水平。双因素方差分析表明, BPA暴露×电击交互作用(F
(6,60) =6.717,p
<0.001)、剂量(F
(3,68) = 4.978,p
= 0.004)或电击(F
(2,69) = 66.093,p
<0.001)主因素均极显著影响小鼠海马NR1表达。条件恐惧训练诱导海马NR1表达水平升高, 特别是在恐惧训练后1 hr (p
<0.05)。长期BPA (0.4, 4, 40 mg/kg/d)暴露显著下调恐惧训练前海马NR1的基础表达水平(均为p
<0.05), 却促进了条件恐惧训练对 NR1的诱导作用。与同一时间点的对照组相比, 恐惧训练后 1 hr和 24 hr的BPA (4, 40 mg/kg/d)暴露小鼠NR1表达水平均明显升高(p
<0.05), 表明成年期BPA暴露不仅影响海马NR1基础表达, 也影响场景性条件恐惧形成及保持过程中NR1表达(图2)。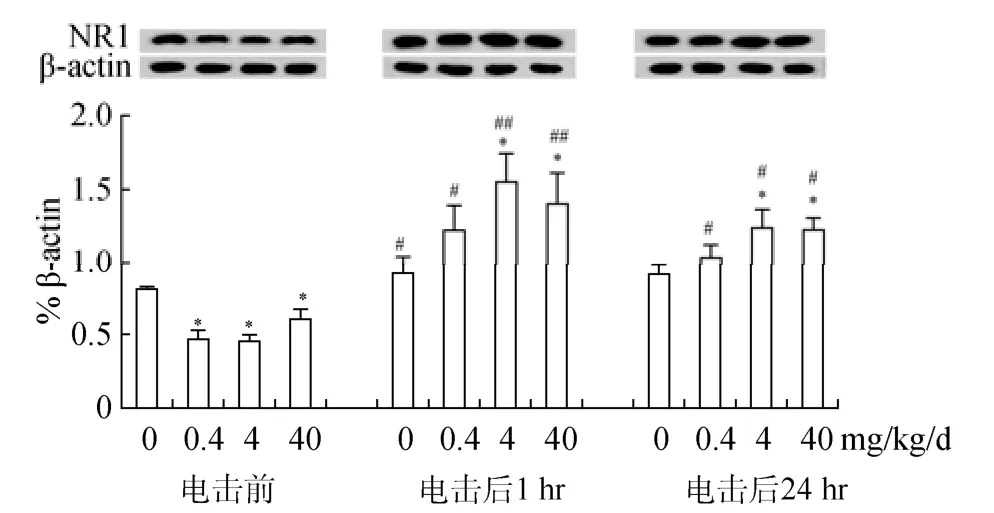
图2 长期 BPA暴露对成年雄性小鼠海马脑区 NMDA受体NR1亚基表达水平的影响(M±SE, n = 6)
3.3 BPA暴露对海马组蛋白乙酰化水平的影响
组蛋白乙酰化水平的提高被认为是场景性条件恐惧形成所必需的, 因此我们猜测 BPA对成年小鼠恐惧记忆的影响是否与组蛋白乙酰化水平的改变有关。与以往的报道一致(Levenson et al.,2004), 条件恐惧训练显著提高海马 H3K14水平(p
<0.05), 降低HDAC2的表达(p
<0.05)。BPA暴露×电击交互作用(F
(6,60) = 2.766,p
= 0.019)、剂量(F
(3,68) = 6.942,p
<0.001)或电击(F
(2,69) = 44.130,p
<0.001)主因素均极显著影响海马H3K14水平, 而电击对HDAC2表达有极显著影响(F
(2,69) = 38.679,p
<0.001)。恐惧训练前, 各组H3K14水平没有明显差异(图 3), 但 BPA暴露小鼠的 HDAC2表达上调(p
<0.05) (图4)。与同一时间点的对照组相比, BPA(4和/或40 mg/kg/d)显著上调恐惧训练后1 hr及24 hr 海马 H3K14水平(p
<0.05,p
<0.05); 同时, 训练前因BPA (0.4、4、40 mg/kg/d)暴露增加的HDAC2表达在训练后1 hr及24 hr 被消除, 与训练前的同一处理组相比, 均表现出明显降低(p
<0.01,p
<0.05)(图3、4)。这些结果提示BPA提高组蛋白去乙酰化酶的基础水平, 相反, 却增加场景性条件恐惧形成和保持过程中的组蛋白乙酰化水平。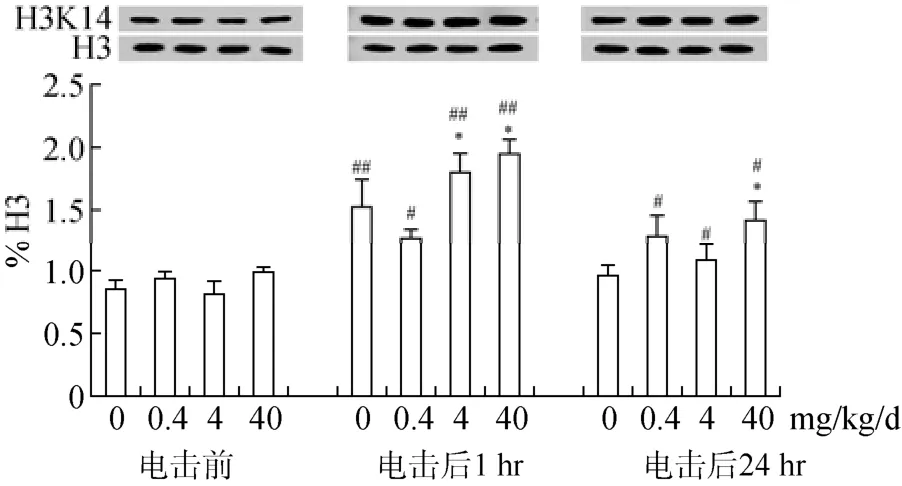
图3 长期BPA暴露对成年雄性小鼠海马脑区组氨酸H3乙酰化(H3K14)表达水平的影响(M±SE, n = 6)
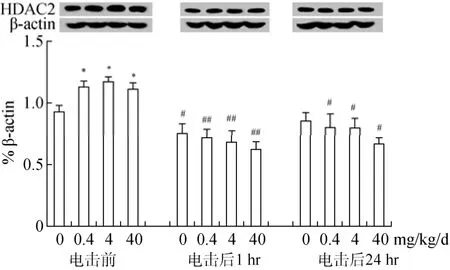
图4 长期BPA暴露对成年雄性小鼠海马脑区组氨酸去乙酰化酶2(HDAC2)表达水平的影响(M±SE, n = 6)
3.4 BPA暴露对成年小鼠场景性条件恐惧诱导的ERK1/2活性的影响
ERK参与包括场景性条件恐惧在内的海马依赖性学习记忆形成, 因此, 我们推测 ERKs信号通路可能介导 BPA 对条件恐惧记忆的影响。双因素方差分析结果表明, BPA暴露×电击交互作用(F
(6,60) = 2.42,p
= 0.037)、剂量(F
(3,68) = 4.336,p
= 0.008)或电击(F
(2,69) = 16.533,p
<0.001)主因素均显著影响海马ERK1/2 磷酸化(p-ERK1/2)水平。条件恐惧训练诱导海马 p-ERK1/2表达, 与恐惧训练前同一处理组相比, 无论是对照组还是 BPA暴露组训练后1 hr和24 hr的p-ERK1/2水平均显著升高(p
<0.05,p
<0.01) (图5)。90 d的BPA 暴露对成年雄性小鼠海马ERK1/2及其p-ERK1/2表达均没有明显影响, 然而, BPA促进了恐惧训练对ERK1/2的活化作用。与同一时间点对照组相比, BPA (4, 40 mg/kg/d)显著增加小鼠恐惧训练后1 hr的p-ERK水平(p
<0.05,p
<0.01), 40 mg/kg/d BPA显著上调训练后24 hr的p-ERK水平(p
<0.05) (图5)。这些结果表明, 条件恐惧训练增强海马 ERK1/2磷酸化活性,而长期 BPA暴露对场景性条件恐惧训练诱导的ERK活化有促进作用。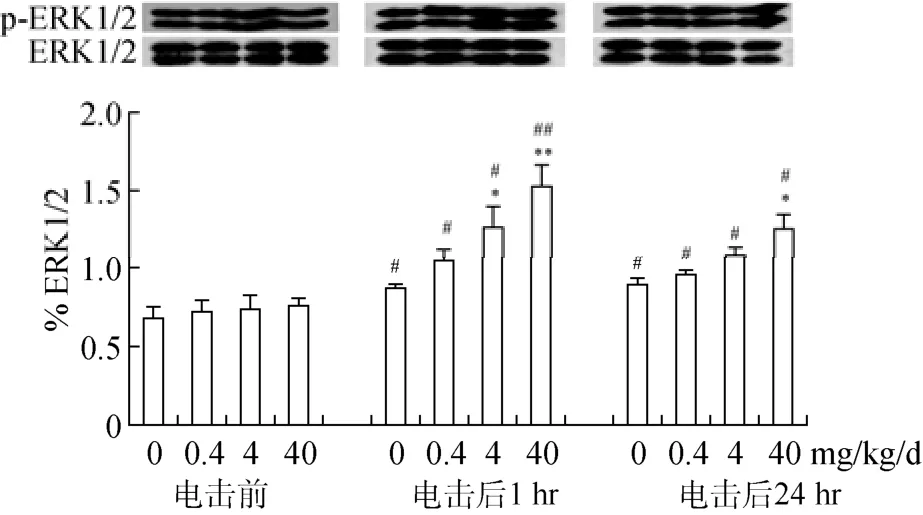
图5 长期 BPA暴露对成年雄性小鼠海马脑区 ERK1/2磷酸化(p-ERK1/2)的影响(M±SE, n = 6)
4 讨论
BPA作为一种广泛存在的环境雌激素污染物,它的神经发育毒性受到广泛关注, 而 BPA对成年神经系统的影响却知之甚少。本研究首次发现, 长期 BPA暴露可增强成年雄性小鼠恐惧记忆的获得与保持, 并促进条件恐惧训练诱导的海马 NMDA受体亚基NR1表达, H3K14水平升高和HDAC2水平降低; 同时, 恐惧训练诱导的ERK1 /2磷酸化进一步增强。这些结果提示, 长期BPA暴露可能通过ERK信号通路介导海马NMDA受体和/或组蛋白乙酰化水平的提高而增强小鼠场景性条件恐惧记忆的形成和保持。
恐惧记忆是一种海马依赖性的情感记忆, 其增强可导致恐惧情绪的形成(Morgan et al., 2001)。场景性条件恐惧模型常用于啮齿类动物恐惧记忆获得、保持和消退的研究, 而僵立反应被认为是反映恐惧的一个客观指标(Li et al., 2006)。本研究发现,长期暴露于BPA (4和40 mg/kg/d)明显延长成年雄性小鼠恐惧训练后1 hr和24 hr的僵立时间, 提示BPA可增强恐惧记忆的获得与保持。与此相反, 我们以往的研究发现围产期或青春期 BPA暴露损伤小鼠的空间和被动回避学习记忆(Xu, Zhang, Wang,Ye, & Luo, 2010; Xu, Tian, Hong, Chen, & Xie,2011); Eilam-Stock等也发现急性BPA暴露损伤成年雄性小鼠空间及视觉记忆(Eilam-Stock et al.,2012)。但本研究结果与最近日本学者的报道相一致, 他们发现围生期暴露于 BPA可增强青年小鼠的恐惧记忆(Matsuda et al., 2013)。这些结果差异提示某种负性干预对负性情绪相关记忆的影响可能不同于对其它学习记忆功能的作用, 但这还需要进一步的研究证据。恐惧被认为与焦虑相关联, 焦虑症患者临床上出现过度焦虑的同时, 表现出恐惧和行为逃避等一系列症状; 而抗焦虑药如氟辛克生(flesinoxan)可抑制恐惧记忆的获得及保持(Burghardt, Sullivan, McEwen, Gorman, & LeDoux,2004)。因此, 场景性条件恐惧模型也广泛用于焦虑机制的研究。值得注意的是, 本实验室前期研究发现, 生命早期 BPA暴露增强仔鼠成年后的焦虑情绪(Xu et al., 2012)。其他研究者也有类似报道。如,哺乳期 BPA暴露降低雄性仔鼠在高架十字迷宫开放臂的时间(Cox, Gatewood, Howeth, & Rissman,2010); 暴露于 BPA的新生大鼠成年后焦虑和攻击行为增强(Patisaul & Bateman, 2008)。这些结果与本实验中 BPA延长恐惧训练后的僵立时间所表现出的恐惧记忆增强相一致, 提示长期 BPA暴露增强雄性小鼠恐惧记忆, 加剧其焦虑样情绪。
谷氨酸 NMDA受体是脑内兴奋性突触后的必需组分, 与突触可塑性密切相关, 在学习记忆过程中起关键作用(Takahashi, Niimi, & Itakura, 2010;Sison & Gerlai, 2011)。同样, NMDA受体也是条件恐惧记忆获得和巩固所必需(Pietersen et al., 2006)。本研究发现, 虽然BPA 抑制海马NMDA受体亚基NR1的基础表达水平, 但BPA (4, 40 mg/kg/d)显著促进恐惧记忆形成和保持过程 NR1表达的上调,表明长期 BPA暴露可以增加成年雄性小鼠海马NMDA受体对行为训练刺激的敏感性, 并因此促进条件恐惧记忆。
研究表明学习记忆过程发生表观遗传修饰, 组蛋白乙酰化是其中一种重要方式。组蛋白乙酰化酶(histone acetylase, HAT)促使组蛋白乙酰化, 降低其与 DNA核酸骨架的结合能力, 使核小体结构打开,促进基因的转录; 而组蛋白去乙酰化酶(histone deacetylase, HDAC)则通过组蛋白去乙酰化作用抑制基因的转录(Kouzarides, 2007)。HAT与 HDAC相互拮抗, 使细胞内的乙酰化和去乙酰化处于动态平衡, 精确调控基因的转录与表达(Choi & Howe,2009)。研究发现, 神经元的组蛋白乙酰化在学习记忆中发挥调节作用, 场景性条件恐惧训练显著上调海马组蛋白 H3乙酰化水平, 这一现象在恐惧训练后1 hr尤为显著(Chwang et al., 2006; Levenson et al., 2004), 而组蛋白去乙酰化酶抑制剂丁酸钠和曲古抑菌素 A可以促进恐惧记忆(Guan et al., 2009;Gundersen & Blendy, 2009)。与这些研究结果相一致, 本研究发现, 场景性条件恐惧训练显著上调正常小鼠海马脑区H3K14水平, 同时下调HDAC2表达。有研究发现母体暴露于 BPA可改变仔鼠出生后 DNA甲基化状态并因此影响特异基因表达(Kundakovic & Champagne, 2011), 而本研究发现,长期BPA暴露可以改变成年小鼠海马HDAC2的基础表达水平, 表明BPA影响包括DNA甲基化和组蛋白乙酰化等表观遗传修饰的多种方式。此外, 本研究进一步发现, 长期BPA (4和40 mg/kg/d)暴露还可促进恐惧训练引起的 H3K14增加和 HDAC2降低, 提示组蛋白乙酰化增强可能是 BPA促进恐惧记忆的一个原因。有人发现, 神经组织过表达HDAC2的转基因小鼠空间记忆受损的同时, 树突密度、突触数目和神经可塑性降低, 海马CA1区高频刺激诱导的长时程增强(LTP)减弱; 而敲除HDAC2则增加突触数目和学习记忆能力, 并上调synaptophysin等一些参与神经可塑性的突触蛋白的基因表达(Guan et al., 2009)。因此, 推测长期BPA暴露可能促进恐惧记忆诱导的组蛋白乙酰化,后者增强相关脑区的突触可塑性而最终影响恐惧记忆。
ERK/MAPK是脑内参与突触可塑性的重要信号通路。有报道海马脑区ERK/MAPK的激活为联想性记忆所必需(Athos, Impey, Pineda, Chen, &Storm, 2002)。与以往的报道一致, 本实验发现条件恐惧训练可明显提高海马脑区p-ERK1/2水平。长期BPA暴露不影响p-ERK1/2的基础水平, 但促进了恐惧训练后 p-ERK1/2表达, 这一结果与恐惧记忆的增强、以及 NR1和组蛋白乙酰化水平的升高相一致。有研究发现, 场景性条件恐惧上调海马脑区组蛋白H3乙酰化水平的作用依赖于NMDA受体和ERK1/2的活化, 海马CA1区NMDA受体激活可增加组蛋白H3乙酰化, 该作用可因ERK信号通路的阻断而抑制(Levenson et al., 2004)。NMDA受体的激活升高细胞内Ca水平, 后者激活蛋白激酶A (protein kinase A, PKA)和蛋白激酶 C (protein kinase C, PKC), 并经一系列级联反应激活ERK1/2,一旦 ERK1/2被激活, 即转到核内调节组蛋白乙酰化而改变基因表达, 最终影响长时记忆的形成和巩固(Chwang et al., 2006)。因此, 我们推测本研究发现的长期 BPA暴露促进恐惧记忆的形成和保持可能通过ERK1/2信号通路增强海马脑区组蛋白乙酰化水平而进行。值得注意的是, 长期BPA暴露下调条件恐惧训练前海马NR1表达却上调HDAC2表达的基础水平, 但对 ERK1/2基础值没有影响, 提示与 BPA对条件恐惧训练后组蛋白乙酰化的影响机制不同, 长期BPA暴露对NMDA受体及组蛋白乙酰化基础值的影响可能不依赖于ERK1/2的活化。
综上所述, 长期暴露于 BPA可促进成年雄性小鼠恐惧记忆的获得和保持, 该作用可能与海马组蛋白乙酰化和 NMDA受体水平的提高有关, 而ERK1/2信号通路可能参与这一作用。恐惧记忆持续保持在较高水平可导致病理性恐惧的发生, 并引起焦虑和抑郁等情绪而损害人类的身心健康, 甚至有可能会导致精神疾病(吴冰 等, 2010)。近年来,焦虑症、抑郁症、恐惧症等精神疾病的发病率呈上升趋势, 推测除了重大创伤, 压力等是造成精神疾病的因素外, 人们在生活中长期接触 BPA也可能是一个不容忽视的原因。
Athos, J., Impey, S., Pineda, V. V., Chen, X., & Storm, D. R.(2002). Hippocampal CRE-mediated gene expression is required for contextual memory formation.Nature Neuroscience,5
(11), 1119–1120.Barha, C. K., Dalton, G. L., & Galea, L. A. (2010). Low doses of 17α-estradiol and 17β-estradiol facilitate, whereas higher doses of estrone and 17α- and 17β-estradiol impair,contextual fear conditioning in adult female rats.Neuropsychopharmacology,35
(2), 547–559.Blanchard, R. J., & Blanchard, D. C. (1969). Crouching as an index of fear.Journal of Comparative and Physiological Psychology,67
(3), 370–375.Burghardt, N. S., Sullivan, G. M., McEwen, B. S., Gorman, J.M., & LeDoux, J. E. (2004). The selective serotonin reuptake inhibitor citalopram increases fear after acute treatment but reduces fear with chronic treatment: a comparison with tianeptine.Biological Psychiatry,55
(12),1171–1178.Chen, L., Xu, X. H., & Tian, D. (2009). Environmental estrogen bisphenol-A effect on brain and behavioral development.Science in China
,39
(12),
1111–1119.[陈蕾, 徐晓虹, 田栋. (2009). 环境雌激素双酚A对脑和行为发育的影响.中国科学,39
(12), 1111–1119.]Choi, J. K., & Howe, L. J. (2009). Histone acetylation: truth of consequences?Biochemistry and Cell Biology,87
(1),139–150.Chwang, W. B., O'Riordan, K. J., Levenson, J. M., & Sweatt, J.D. (2006). ERK/MAPK regulates hippocampal histone phosphorylation following contextual fear conditioning.Learning and Memory, 13
(3), 322–328.Cox, K. H., Gatewood, J. D., Howeth, C., & Rissman, E. F.(2010). Gestational exposure to bisphenol A and cross-fostering affect behaviors in juvenile mice.Hormones and Behavior,58
(5), 754–761.Eilam-Stock, T., Serrano, P., Frankfurt, M., & Luine, V. (2012).Bisphenol-A impairs memory and reduces dendritic spine density in adult male rats.Behavioral Neuroscience, 126
(1),175–185.Gonçalves, C. R., Cunha, R. W., Barros, D. M., & Martínez, P.E. (2010). Effects of prenatal and postnatal exposure to a low dose bisphenol A on behavior and memory in rats.Environmental Toxicology and Pharmacology,30
(2),195–201.Guan, J. S., Haggarty, S. J., Giacometti, E., Dannenberg, J. H.,Joseph, N., Gao, J.,… Tsai, L.-H. (2009). HDAC2 negatively regulates memory formation and synaptic plasticity.Nature,459
(7243), 55–60.Gundersen, B. B., & Blendy, J. A. (2009). Effects of the histone deacetylase inhibitor sodium butyrate in models of depression and anxiety.Neuropharmacology,57
(1), 67–74.Jašarević, E., Williams, S. A., Vandas, G. M., Ellersieck, M. R.,Liao, C., Kannan, K.,… Rosenfeld, C. S. (2013). Sex and dose-dependent effects of developmental exposure to bisphenol A on anxiety and spatial learning in deer mice(Peromyscus maniculatus bairdii) offspring.Hormones and Behavior,63
(1), 180–189.Kim, H. J., & Casadesus, G. (2010). Estrogen-mediated effects on cognition and synaptic plasticity: What do estrogen receptor knockout models tell us?Biochimica et Biophysica Acta,1800
(10), 1090–1093.Kim, M. E., Park, H. R., Gong, E. J., Choi, S. Y., Kim, H. S.,& Lee, J. (2011). Exposure to bisphenol A appears to impair hippocampal neurogenesis and spatial learning and memory.Food and Chemical Toxicology,49
(12),3383–3389.Korzus, E., Rosenfeld, M. G., & Mayford, M. (2004). CBP histone acetyltransferase activity is a critical component of memory consolidation.Neuron,42
(6), 961–972.Kouzarides, T. (2007). Chromatin modifications and their function.Cell,128
(4), 693–705.Kundakovic, M., &Champagne, F. A. (2011). Epigenetic perspective on the developmental effects of bisphenol A.Brain, Behavior, and Immunity,25
(6), 1084–1093.Leranth, C., Szigeti-Buck, K., Maclusky, N. J., & Hajszan, T.(2008). Bisphenol A prevents the synaptogenic response to testosterone in the brain of adult male rats.Endocrinology,149
(3), 988–994.Levenson, J. M., O'Riordan, K. J., Brown, K. D., Trinh, M. A.,Molfese, D. L., & Sweatt, J. D. (2004). Regulation of histone acetylation during memory formation in the hippocampus.The Journal of Biological Chemistry,279
(39), 40545–40559.Li, X., Inoue, T., Abekawa, T., Weng, S., Nakagawa, S., Izumi,T., & Koyama, T. (2006). 5-HTreceptor agonist affects fear conditioning through stimulations of the postsynaptic 5-HT1A receptors in the hippocampus and amygdala.European Journal of Pharmacology,532
(1–2), 74–80.Liu, X. Y., Xu, X. H., Zhang, Q., Zhang, G. X., Ji, J. L., Dong,F. N., et al. (2013). The effects of environmental endocrine disrupter bisphenol A on learning-memory and synaptic structure of adult mice.Acta Psychologica Sinica,45
(9),981–992.[刘幸毅, 徐晓虹, 张勤, 张广侠, 季佳琳, 董芳妮, 等.(2013). 环境雌激素双酚 A 对成年小鼠学习记忆和突触结构的影响.心理学报, 45
(9), 981–992.]Matsuda, S., Matsuzawa, D., Ishii, D., Tomizawa, H., Sajiki, J.,& Shimizu, E. (2013). Perinatal exposure to bisphenol A enhances contextual fear memory and affects the serotoninergic system in juvenile female mice.Hormones and Behavior,63
(5), 709–716.Morgan, M. A., & Pfaff, D. W. (2001). Effects of estrogen on activity and fear-related behaviors in mice.Hormones and Behavior,40
(4), 472–482.Negishi, T., Kawasaki, K., Takatori, A., Ishii, Y., Kyuwa, S.,Kuroda, Y., & Yoshikawa, Y. (2003). Effects of perinatal exposure to bisphenol A on the behavior of offspring in F344 rats.Environmental Toxicology Pharmacology,14
(3), 99–108.Patisaul, H. B., & Bateman, H. L. (2008). Neonatal exposure to endocrine active compounds or an ERbeta agonist increases adult anxiety and aggression in gonadally intact male rats.Hormones and Behavior,53
(4): 580–588.Pietersen, C. Y., Bosker, F. J., Postema, F., Fokkema, D. S., Korf, J., &den Boer, J. A. (2006). Ketamine administration disturbs behavioural and distributed neural correlates of fear conditioning in the rat.Progress in Neuro- Psychopharmacology and Biological Psychiatry,30
(7), 1209–1218.Santos, J. M., Martinez, R. C., & Brandão, M. L. (2006).Effects of acute and subchronic treatments with fluoxetine and desipramine on the memory of fear in moderate and high-intensity contextual conditioning.European Journal of Pharmacology,542
(1–3), 121–128.Sison, M., & Gerlai, R. (2011). Associative learning performance is impaired in zebrafish (Danio rerio
) by the NMDA-R antagonist MK-801.Neurobiology of Learning and Memory,96
(2), 230–237.Takahashi, E., Niimi, K., & Itakura, C. (2010). Impairment of spatial short-term memory following acute administration of the NMDA receptor antagonist in heterozygous rolling Nagoya mice carrying the Ca V 2.1 alpha1 mutation.Behavioural Brain Research,213
(1), 121–125.Vom Saal, F. S., Nagel, S. C., Coe, B.L., Angle, B. M., &Taylor, J. A. (2012). The estrogenic endocrine disrupting chemical bisphenol A (BPA) and obesity.Molecular andCellular Endocrinology,354
(1–2), 74–84.Wood, M. A., Kaplan, M. P., Park, A., Blanchard, E. J.,Oliveira, A. M., Lombardi, T. L., & Abel, T. (2005).Transgenic mice expressing a truncated form of CREB-binding protein (CBP) exhibit deficits in hippocampal synaptic plasticity and memory storage.Learning Memory,12
(2), 111–119.Wu, B., Hu, B., & Sui, J. F. (2010). Effects of 860 MHz microwave on context conditioned fear in mice.Chinese Journal of Behavioral Medicine and Brain Science,19
(8), 677–679.[吴冰, 胡波, 隋建峰. (2010). 860 MHz微波辐射对小鼠场景性条件恐惧的影响.中华行为医学与脑科学杂志,19
(8), 677–679.]Xu, X. H., Hong, X., Xie, L. D., Li, T., Yang, Y.., Zhang, Q., &Liu, X. Y. (2012). Gestational and lactational exposure to bisphenol-A affects anxiety- and depression-like behaviors in mice.Hormones and Behavior, 62
(4), 480–490.Xu, X. H., Tian, D., Hong, X., Chen, L., & Xie, L. D. (2011).Sex-specific influence of exposure to bisphenol-A between adolescence and young adulthood on mouse behaviors.Neuropharmacology,61
(4), 565–573.Xu, X. H., Zhang, J., Wang, Y. M., Ye, Y. P., & Luo, Q. Q.(2010). Perinatal exposure to bisphenol-A impairs learning-memory by concomitant down-regulation of N-methyl-D-aspartate receptors of hippocampus in male offspring mice.Hormones and Behavior, 58
(2), 326–333.
