KiSS⁃1基因对人胰腺癌Capan⁃2细胞的增殖及侵袭的影响
王春晖,乔宠,周文平,麻树仁
(1.中国人民解放军沈阳军区总医院肝胆外科,沈阳 110016;2.中国医科大学附属盛京医院妇产科,沈阳 110004;3.中国人民解放军沈阳军区总医院内镜中心,沈阳 110016)
KiSS⁃1基因对人胰腺癌Capan⁃2细胞的增殖及侵袭的影响
王春晖1,乔宠2,周文平1,麻树仁3
(1.中国人民解放军沈阳军区总医院肝胆外科,沈阳 110016;2.中国医科大学附属盛京医院妇产科,沈阳 110004;3.中国人民解放军沈阳军区总医院内镜中心,沈阳 110016)
目的研究KiSS⁃1基因对人胰腺癌Capan⁃2细胞增殖、侵袭的影响。方法 经脂质体介导瞬时转染上调Capan⁃2细胞中KiSS⁃1基因的表达,采用实时荧光定量PCR和Western blot技术检测Capan⁃2细胞中KiSS⁃1mRNA及其蛋白肽metastin的表达。采用MTT法分析KiSS⁃1对Capan⁃2细胞增殖能力的影响;Matrigel铺被的transwell侵袭实验检测KiSS⁃1对Capan⁃2细胞侵袭能力的作用。结果KiSS⁃1转染Capan⁃2细胞36hKiSS⁃1mRNA开始增多,到48hKiSS⁃1mRNA及其蛋白肽metastin表达明显增强,达到峰值。与空质粒转染组和空白对照组相比,KiSS⁃1转染Capan⁃2细胞48h后,细胞体外侵袭能力显著下降,侵袭指数显著降低(P均<0.01),侵袭力抑制率达到56.5%(P均<0.01),但转染KiSS⁃1对Capan⁃2细胞增殖能力无明显影响(P均>0.05)。结论KiSS⁃1是胰腺癌的转移抑制基因,可作为基因治疗的新靶点。
KiSS⁃1;胰腺癌;增殖;侵袭
胰腺癌是预后最差的消化道恶性肿瘤之一,在我国发病率逐年上升,目前胰腺癌已占我国肿瘤相关死亡率的第六位。尽管研究者已经从多个角度进行胰腺癌的相关研究,但是由于胰腺癌具有局部侵袭力高、早期转移局部淋巴结等特点,大多数胰腺癌在获得诊断时已是局部进展性或发生转移,不但使胰腺癌患者在就诊时就丧失根治性手术的机会,同时也是根治术后患者死亡的主要原因[1]。因此胰腺癌的转移机制的研究及抗肿瘤转移治疗成为近年来研究热点之一。KiSS⁃1是一种肿瘤转移抑制基因,其编码的蛋白肽metastin含有54个氨基酸。本课题组从人类正常胰腺组织中克隆该基因并成功构建了真核表达载体[2]。本课题组的前期研究发现KiSS⁃1及其蛋白肽metastin表达降低与胰腺癌的TNM分期及侵袭和转移密切相关[3]。提示KiSS⁃1基因及其蛋白metastin可能在胰腺癌进展过程中起到转移抑制的作用,但是目前对KiSS⁃1基因抑制胰腺癌转移的具体作用机制仍不十分清楚。本研究中以中等转移活性的人胰腺癌Capan⁃2细胞系作为研究对象,通过转染上调KiSS⁃1基因及其蛋白的表达,并探讨KiSS⁃1对胰腺癌细胞增殖、侵袭能力的影响,为胰腺癌转移基因治疗提供实验依据。
1 材料与方法
1.1 材料
人胰腺癌细胞Capan⁃2细胞系,PcDNA⁃3/KiSS⁃1真核表达质粒由本室保存;RPM1640培养基、胎牛血清及青霉素、链霉素均购自Gibco公司;TRIzol Re⁃agent、逆转录试剂盒、Lipofectamine®2000转染试剂购自美国Invitrogen公司;SYBRGreen mix购自BIO⁃RAD公司;BCA蛋白分析试剂盒购自Thermo Fisher公司;兔抗人metastin(1⁃54)购自Phoenix公司、兔抗人β⁃actin抗体购自Abcam公司、噻唑蓝(MTT)、二甲基亚砜(DMSO)为Sigma公司产品;ECL化学发光试剂盒购自Amersham公司、X⁃ray胶片、显影剂、定影剂购自Kodak公司。Transwell小室、Matrigel和FN均购自BD公司;引物序列由大连宝生物公司合成,由Primer 5.0软件设计。其余试剂均为国产分析纯试剂。
1.2 细胞培养
Capan⁃2细胞系使用含10%胎牛血清的RPM1640培养基,添加1%的青霉素、链霉素,置于37℃、5%CO2、相对湿度为90%的培养箱中培养,48~72h换液1次,用0.25%胰蛋白酶常规消化,按1∶4或1∶5比例传代,在对数生长期进行实验。
1.3 脂质体转染
当细胞融合度达到约90%时,按转染说明书进行转染,同时以空质粒转染(空质粒转染组)和不转染任何质粒,仅用脂质体处理(空白对照组)的细胞作为对照。细胞以8×105/孔接种在六孔板中,转染12h后换液,加入含有抗生素的完全培养液,继续培养48h。
1.4 Real⁃time PCR检测KiSS⁃1mRNA的表达
收集转染前及转染后24h、36h和48h的上述各组细胞,用TRIzol法提取各组细胞的总RNA,逆转录合成cDNA。应用ABI7300荧光定量PCR仪按SYBRGreen mix说明书进行检测。预变性95℃3min,变性95℃15s,退火延伸60℃1min,在60℃读取数据;共40个循环。KiSS⁃1上游引物为5′⁃ACT⁃CACTGGTTTCTTGGCAGCT⁃3′,下游引物为 5′⁃CAGAGGCCACCTTTTCTAATGG⁃3′;内参照β⁃actin上游引物为5′⁃ACCAACTGGGACGACATGGAGAAAA⁃3′,下游引物为5′⁃TACGGCCAGAGGCGTACAGGGATAG⁃3′。Real⁃time PCR总反应体系为25μL,其中 cDNA2.5μL(100ng),SYBR®Green Realtime PCRMaster Mix 12.5μL,上下游引物(10μmol/L)各0.5μL。采用2-△△Ct法分析目的基因mRNA的相对表达量。以上实验重复3次。
1.5 Western blot检测metastin的表达
同上分别收集转染前及转染后24h、36h和48h上述各组细胞,取适量RIPA裂解液及蛋白酶抑制剂,冰上孵育30min,4℃12000g离心30min,取上清。采用BCA法进行蛋白定量。以50μg蛋白样品/泳道上样,15%的SDS⁃PAGE胶电泳分离,电泳结束后将PAGE胶上的蛋白用Bio⁃Rad电转移系统于4℃200mA电转移60min至PVDF膜上;用含5%脱脂奶粉的TBST室温摇床封闭2h.将然后用含5%脱脂奶粉的TBST稀释相应的一抗(兔抗人metastin 1∶500,兔抗人β⁃actin(1∶1000),将PVDF膜浸泡于一抗孵育液中,4℃孵育过夜,TBST充分洗涤PVDF膜5~6次,5min/次,以HRP标记的羊抗兔IgG二抗用封闭液1∶20000稀释,室温摇床孵育1h,TBST充分洗涤PVDF膜5~6次,5min/次。每张膜滴加适量的ECL底物液,孵育数分钟。待荧光带明显后,用滤纸吸去多余的底物液,覆上保鲜膜,X线胶片压片后依次放入显影液显影、定影液定影。用BIO⁃RADQuantity One软件扫描胶片灰度值,以metastin/β⁃actin的相对表达量进行半定量分析。以上实验重复3次。
1.6 噻唑蓝(MTT)法检测细胞增殖
在96孔细胞培养板中接种细胞,3×103/孔,每孔体积100μL,设6个复孔,同上转染并培养24h后,每孔加入20μLMTT溶液(5mg/mL),孵育4h,终止培养,去上清,每孔加入100μL二甲基亚砜(DMSO),震荡10min。选择490nm波长,在酶标仪上测定各孔的吸光值,记录结果。连续检测5d,测得的数据以时间为横坐标,吸光值为纵坐标,绘制细胞的生长曲线。
1.7 Matrigel铺被的Transwell侵袭实验检测细胞侵袭能力变化
于Transwell小室滤膜内表面均匀涂布Matrigel,20μg/孔,外表面涂FN5μg/孔,37℃放置3h,于上下两个小室加入无血清培养基,并放置于培养箱中水化2h。倾去培养液后在下室加入600μL含10%胎牛血清的培养液,上室加入5×104/mL细胞悬液500μL(2.5×104/室),每种细胞做3个小室为平行样,实验重复3次。37℃、50mL/LCO2培养48h后取出,小心用棉签擦去基质胶和上室内的细胞,染色,显微镜观察、取10个视野,计数取平均值。以穿过无Matrigel膜的细胞数作为对照,计算侵袭指数和侵袭力抑制率。侵袭指数=实验组侵袭细胞数/对照组侵袭细胞数×100%;细胞侵袭力抑制率=(对照组侵袭细胞数-实验组侵袭细胞数)/对照组侵袭细胞数。
1.8 统计学处理
2 结果
2.1 转染后胰腺癌细胞株中KiSS⁃1mRNA及其蛋白肽metastin的表达
Real⁃time PCR结果显示与转染前相比,转染后36h,Capan⁃2细胞中KiSS⁃1mRNA表达增加,KiSS⁃1转染Capan⁃2细胞36hKiSS⁃1mRNA开始增多,达到转染前的 1.2倍(P<0.01),而到 48hKiSS⁃1mRNA表达明显增强,并达到峰值,为转染前的1.9倍(P<0.01,图1)。 Western blot显示转染前Capan⁃2细胞中几乎检测不到KiSS⁃1的蛋白肽metastin的表达,转染后36h,metastin开始增多,到48h metast⁃in表达明显增加(图2)。
2.2 转染后胰腺癌细胞株Capan⁃2增殖能力的变化
MTT结果显示转染KiSS⁃1的Capan⁃2细胞株与空质粒转染组及空白对照组相比,增殖活性未见明显差异(P>0.05),空质粒转染组及空白对照组相比增殖活性也无明显差异(P>0.05,图3)。


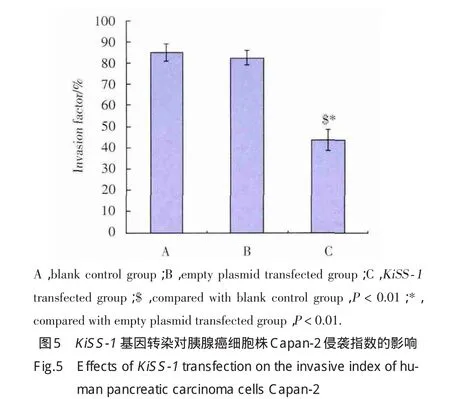
2.3 KiSS⁃1转染抑制胰腺癌细胞株Capan⁃2的侵袭能力
结果表明,成功转染外源性KiSS⁃1基因的胰腺癌细胞Capan⁃2穿透Matrigel基底膜的细胞数显著低于空质粒转染组及空白对照组细胞(P均<0.01)(图4),侵袭指数显著降低(P均<0.01,图5),侵袭力抑制率达到56.5%,显著低于空质粒转染组及空白对照组细胞(P均<0.01,图6)。空质粒转染组及空白对照组细胞相比,侵袭穿膜细胞数无明显差异(P>0.05)。


3 讨论
临床研究发现转移性胰腺癌患者1年生存率低于20%,5年生存率小于5%[4],高度转移性是胰腺癌难以缓解并最终死亡的主要原因。近年来胰腺癌的转移机制的研究及抗肿瘤转移治疗成为研究热点,目前关于胰腺癌中肿瘤转移抑制基因的研究尚少。KiSS⁃1基因为一种肿瘤转移抑制基因,最初由Lee等在人类恶性黑色素瘤细胞中发现[5],Ohtaki等利用定量PCR研究发现KiSS⁃1mRNA主要表达在胎盘组织中,其次在睾丸、胰腺、肝脏、小肠和脑组织中[6]。本课题组在2005年在国际上首次从人类正常胰腺组织中成功克隆KiSS⁃1基因,并成功构建了KiSS⁃1真核表达质粒[2]。
我们的前期研究发现人类胰腺癌组织中KiSS⁃1mRNA的表达显著低于正常胰腺组织,其表达与临床TNM分期、有无转移和神经侵犯密切相关[7],但与组织学分级无关,表明胰腺癌的转移与KiSS⁃1的低表达可能有关,但具体机制不清。
为此,我们选取了几乎没有KiSS⁃1表达的、具有中等转移活性的胰腺癌细胞株Capan⁃2作为研究模型,采用转染的方法使KiSS⁃1基因过表达,研究KiSS⁃1基因对胰腺癌细胞增殖和侵袭能力的影响。我们发现KiSS⁃1基因转染后,KiSS⁃1mRNA和metastin的表达明显增加,胰腺癌细胞Capan⁃2的增殖能力无明显改变,表明KiSS⁃1基因及其蛋白肽metastin对胰腺癌细胞Capan⁃2的增殖能力无明显作用[8]。这与KiSS⁃1基因在黑色素瘤中作用是一致的[5,9]。但还有研究发现KiSS⁃1过表达可抑制胃癌BGC⁃823细胞的增殖能力。目前认为KiSS⁃1对于肿瘤细胞的增殖的作用是有细胞特异性的。Masui等在胰腺癌细胞株AsPC⁃1和PANC⁃1细胞培养液中添加外源性的metastin,发现外源性的metastin对于这两种细胞株的增殖能力无影响[8],因此可以推测在胰腺癌中KiSS⁃1及其蛋白肽metastin并不能抑制原发灶肿瘤细胞的生长。
本研究发现KiSS⁃1基因转染后体外培养的胰腺癌细胞Capan⁃2侵袭能力显著下降,而空质粒转染及脂质体转染试剂本身对胰腺癌细胞株的侵袭能力无影响,说明KiSS⁃1基因过表达对于胰腺癌转移具有明显的抑制作用。但是Masui等研究发现了一个奇怪的现象:当外源性给予metastin时,对于胰腺癌细胞株AsPC⁃1的迁移并不受metastin的影响,而PANC⁃1细胞的迁移则被1μmol/L和10μmol/L的metastin所抑制,而且这两种细胞株的侵袭能力并不受metastin的影响[8]。他们认为外源性给予metast⁃in对于胰腺癌细胞的迁移抑制与其表达的受体GPR54水平有关,且无明显侵袭抑制效应。
研究发现KiSS⁃1基因在不同的肿瘤细胞中发生的作用及其机制均不同,如在膀胱上皮肿瘤KiSS⁃1基因通过降低NFkB与MMP⁃9启动子的结合,来抑制MMP⁃9基因的转录,进而减少MMP⁃9的合成,达到抑制肿瘤细胞机动性、趋化性和侵袭性的作用[11]。在胃癌中KiSS⁃1则通过活化p38MAP激酶来抑制MMP⁃9的表达,从而抑制胃癌细胞的侵袭[10]。因此我们认为在本研究中KiSS⁃1过表达对于Capan⁃2的侵袭能力的抑制,应该是KiSS⁃1mRNA增加的效应,而不是其蛋白肽metastin增加的效应。在胰腺癌Capan⁃2细胞中KiSS⁃1的过表达究竟通过什么方式抑制细胞侵袭的机制和信号传导通路需要进一步研究。
总之,本研究发现内源性上调KiSS⁃1基因的表达可显著抑制胰腺癌细胞株Capan⁃2的侵袭,KiSS⁃1可能成为抗胰腺癌转移的治疗靶点。靶向增加胰腺癌细胞中KiSS⁃1表达的基因治疗可能是治疗胰腺癌转移的新策略。
[1]Hidalgo M.Pancreatic cancer[J].NEngl JMed,2010,362(17):1605-1617.
[2]王春晖,乔宠,戴显伟.人KiSS⁃1基因克隆及其真核表达载体的构建[J].中国医科大学学报,2005,34(3):218-219.
[3]Wang CH,Qiao C,Ma SR,et al.Expression of KiSS⁃1in human pan⁃creatic cancer and relationship with their invasion and metastasis[J].Chin JMod Med,2005,15(11):1620-1623,1631.
[4]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CACancer JClin,2011,61(2):69-90.
[5]Lee JH,Miele ME,Hicks DJ,et al.KiSS⁃1,a novel human malig⁃nant melanoma metastasis suppressor gene[J].JNatl Cancer Inst,1996,88(23):1731-1737.
[6]Ohtaki T,Shintani Y,Honda S.Metastasis suppressor gene KiSS⁃1encodes pepitide ligand of a G⁃protein⁃coupled receptor[J].Na⁃ture,2001,411(6837):613-617.
[7]王春晖,乔宠,戴显伟.人胰腺癌KiSS⁃1基因mRNA表达及其临床意义[J].中华肿瘤防治杂志,2006,13(3):207-210.
[8]Masui T,Doi R,Mori T,et al.Metastin and its variant forms sup⁃press migration of pancreatic cancer cells[J].Biochem Biophys Res Commun,2004,315(1):85-92.
[9]Nash KT,Welch DR.The KISS1metastasis suppressor:Mechanistic insights and clinical utility [J].Frontiers Biosci,2006,11:647-659.
[10]Lee KH,Kim JR.KiSS⁃1suppresses MMP⁃9expression by activat⁃ing p38MAPkinase in human stomach cancer[J].Oncol Res,2009,18(2⁃3):107-116.
(编辑 裘孝琦)
EffectsofKiSS⁃1onHumanPancreaticCarcinomaCapan⁃2CellProliferationandInvasion
WANGChun⁃hui1,QIAOChong2,ZHOUWen⁃ping1,MAShu⁃ren3
(1.Department of Hepatobiliary Surgery,General Hospital of Shenyang Millitary Region,Shenyang 110016,China;2.Department of Obstetrics and Gynecology,Shengjing Hospital,China Medical University,Shenyang 110004,China;3.Endoscopy Medical Center,General Hospital of Shenyang Millitary Region,Shenyang 110016,China)
ObjectiveTo investigate the effects ofKiSS⁃1on the proliferation and invasion abilities of human pancreatic carcinoma Capan⁃2cells.Metods Transient transfection with Lipofectamine was used to up⁃regulate the expression ofKiSS⁃1in Capan⁃2cells.Tested the expression ofKiSS⁃1mRNAand Kisspeptin⁃metastin by real⁃time quantitative PCRand Western blot.MTTassay was used to detect the influence of KiSS⁃1on Capan⁃2cell proliferation.Transwell assay with Matrigel coated was used to evaluate the in vitro invasion ability.ResultsTheKiSS⁃1mRNAex⁃pression of Capan⁃2cells was significantly up⁃regulated 36hours after transfection.KiSS⁃1mRNAand metastin reached the peak 48hours after transfection.Comparedwithemptyplasmidtransfectedgroupandblankcontrolgroup,invasionabilityandinvasionindexofCapan⁃2cellwassignifi⁃cantly decrease 48hours afterKiSS⁃1transfection(P<0.01),meanwhile,the inhibition rates of Capan⁃2cell invasiveness was 56.5%.There were no significant difference of proliferation after transfection compared with empty plasmid group and blank control group(P<0.05).ConclusionKiSS⁃1isametastasissuppressorgeneofpancreaticcancer,whichcanbeusedasanoveltargetforgenetherapy.
KiSS⁃1;pancreatic cancer;proliferation;invasion
R735.9
A
0258-4646(2014)04-0304-04
http://www.cnki.net/kcms/detail/21.1227.R.20140429.1439.006.html
全军医学科学技术研究“十一五”计划青年学者课题(06Q014);辽宁省博士启动基金(20071038)
王春晖(1972-),男,副主任医师,博士.E-mail:wangchh_2013@163.com
2013-12-17
网络出版时间:2014-04-2914:39

