去甲氧基姜黄素对人膀胱癌T24细胞增殖及凋亡的影响研究
倪晓辰,陈砚凝,武新慧,张爱莉,赵志红
膀胱癌是我国泌尿系统最常见的恶性肿瘤,近年来膀胱癌的发病率呈显著增加趋势。膀胱癌的治疗目前仍以手术治疗为主,但是由于膀胱癌术后极易复发,且复发后肿瘤具有向更高级别恶性程度发展的趋势,严重影响了患者的预后,为膀胱癌的临床治疗带来极大挑战,所以研究预防其复发的理想药物具有重大的临床意义。去甲氧基姜黄素(demethoxycurcumin,DMC)对人膀胱癌的作用尚不清楚。本研究观察了DMC对膀胱癌T24细胞增殖及凋亡的影响,并初步探讨了其诱导T24细胞凋亡的分子机制,为进一步研究DMC治疗膀胱癌提供了理论依据。
1 材料与方法
1.1 细胞培养与药物准备 人膀胱癌T24细胞株用含10%胎牛血清(FBS)的RPMI-1640培养基培养,待细胞生长达90%融合后,用消化液〔含0.25%胰蛋白酶、0.02%乙二胺四乙酸(EDTA)、磷酸盐缓冲液(PBS)〕消化传代,至细胞生长达80%融合时进行实验。将DMC粉末充分溶解于二甲基亚砜(DMSO)中,制备成浓度为160 μM的储液,等分装10份后置于-20 ℃避光保存备用。将细胞分为实验组和对照组,实验组细胞加入不同浓度的DMC进行孵育,对照组加入等体积DMSO进行孵育。
1.2 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)实验 将T24细胞用消化液消化,并吹打成单细胞悬液,并将约100 μl的细胞悬液(约1×104个细胞)接种于96孔板各孔中,贴壁后实验组分别加入不同浓度的DMC(10、20、40、80、160 μM)刺激48 h。对照组使用0.1%(体积比)的DMSO孵育相同时间。倒置显微镜观察后每孔加入20 μl MTT(5 mg/ml)溶液,并于37 ℃下孵育3 h,然后弃去培养液,每孔各加入DMSO 150 μl,混匀后于570 nm处比色测定。以上各组设6个复孔,重复3次。
1.3 流式细胞学分析 将各组细胞用消化液彻底消化并吹打成单细胞悬液,1 000 r/min离心5 min,离心半径为16 cm。用PBS漂洗数次后,将细胞重悬在500 μl结合缓冲液中,之后各组加入5 μl的Annexin V 和 10 μl的碘化丙啶(PI)。染色后用流式细胞仪(FCM)检测各组细胞的凋亡率。细胞凋亡采用Annexin V/ PI双染凋亡检测试剂盒进行检测。
1.4 Western印迹分析 采用Western印迹法检测增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(Santa cruz)、细胞周期抑制蛋白p27(cell signaling)、Caspase 3(cell signaling)及其底物多聚ADP-核糖聚合酶(poly ADP-ribose polymerase,PARP)(cell signaling)、p-mTOR(Ser2448)/mTOR(cell signaling)等蛋白的变化。采用凝胶成像分析软件Quantity One对待测条带的灰度与内参照(β-actin)条带灰度的比值进行相对定量分析。
2 结果
2.1 DMC抑制T24细胞增殖 MTT显示,实验组用不同浓度的DMC孵育48 h后,细胞增殖活力均低于对照组,差异有统计学意义(P<0.05,见图1)。Western印迹法显示,用不同浓度的DMC(20、40、80 μM)处理T24细胞48 h,PCNA相对表达量均低于对照组,p27相对表达量均高于对照组,差异有统计学意义(P<0.05,见表1);且随DMC浓度的增加PCNA相对表达量逐渐减低,p27相对表达量逐渐增高。

注:与对照组比较,*P<0.05,△P<0.01
图1 不同浓度DMC对T24 细胞增殖活力的影响
Figure1 Effects of different concentrations of DMC on the proliferation of T24 cells
2.2 DMC诱导T24细胞凋亡 流式细胞学检测发现,不同浓度DMC(20、40、80 μM)处理T24细胞48 h后,细胞发生明显的凋亡,细胞凋亡率均高于对照组,差异有统计学意义(P<0.05,见图2)。Western印迹法显示,不同浓度DMC(20、40、80 μM)处理T24细胞48 h后,pro-caspase 3、cleaved-caspase 3、pro-PARP、cleaved-PARP的相对表达量与对照组比较,差异均有统计学意义(P<0.05,见表2)。

Table1 Comparison of relative expression of PCNA and p27 in control group and different concentrations DMC groups
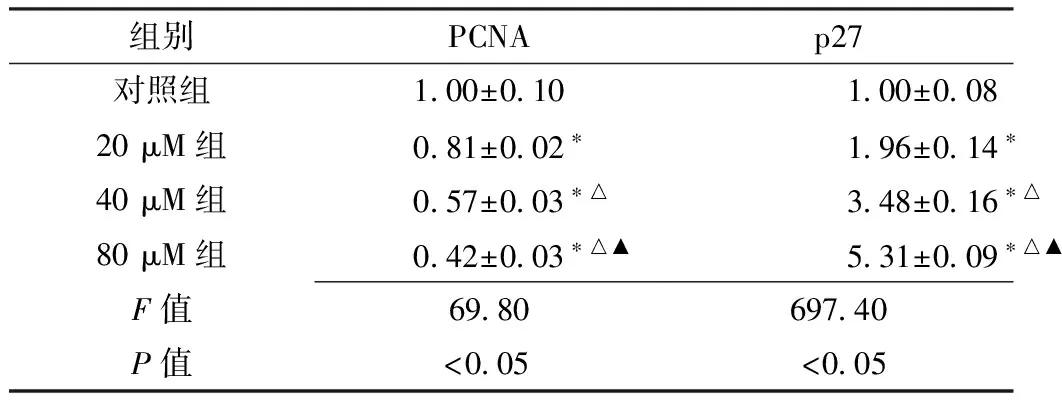
组别PCNAp27对照组1 00±0 101 00±0 0820μM组0 81±0 02∗1 96±0 14∗40μM组0 57±0 03∗△3 48±0 16∗△80μM组0 42±0 03∗△▲5 31±0 09∗△▲F值69 80697 40P值<0 05<0 05
注:PCNA=增殖细胞核抗原;与对照组比较,*P<0.05;与20 μM组比较,△P<0.05;与40 μM组比较,▲P<0.05

注:与对照组比较,*P<0.01
图2 不同浓度DMC对T24细胞凋亡率的影响
Figure2 Effects of different concentrations of DMC on apoptosis in T24 cells

Table2 Comparison of relative expression of pro-caspase 3,cleaved-caspase 3,pro-PARP and cleaved-PARP in control group and different concentrations DMC groups
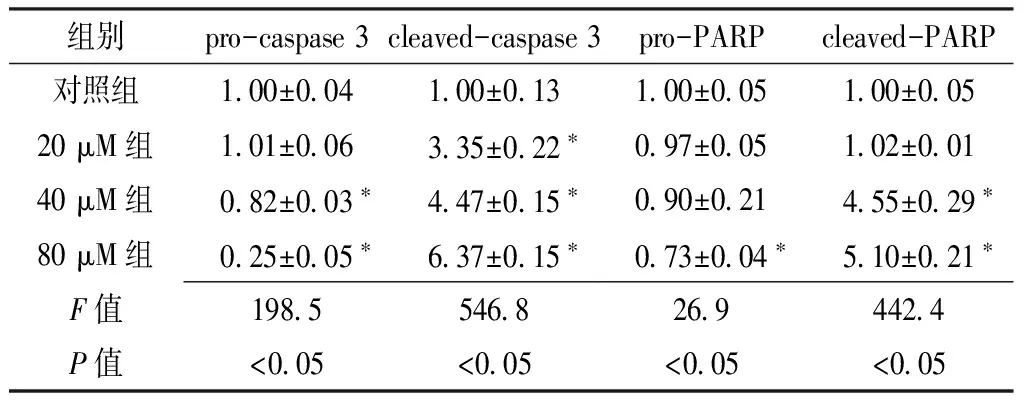
组别pro-caspase3cleaved-caspase3pro-PARPcleaved-PARP对照组1 00±0 041 00±0 131 00±0 051 00±0 0520μM组1 01±0 063 35±0 22∗0 97±0 051 02±0 0140μM组0 82±0 03∗4 47±0 15∗0 90±0 214 55±0 29∗80μM组0 25±0 05∗6 37±0 15∗0 73±0 04∗5 10±0 21∗F值198 5546 826 9442 4P值<0 05<0 05<0 05<0 05
注:与对照组比较,*P<0.05
2.3 DMC抑制mTOR的活化 用浓度为40 μM的DMC分别刺激T24细胞0、15、30、60和120 min,采用Western印迹法检测与细胞增殖密切相关的mTOR通路磷酸化的变化显示,不同时间点p-mTOR的相对表达量比较,差异有统计学意义(P<0.05);且刺激30、60、120 min时的p-mTOR的相对表达量均低于0 min时,差异有统计学意义(P<0.05)。不同时间点mTOR的相对表达量比较,差异无统计学意义(P>0.05,见表3)。

Table3 Comparison of relative expression of p-mTOR ang mTOR in different times

时间(min)p-mTORmTOR01 00±0 01 1 00±0 05151 00±0 02 1 00±0 05300 79±0 03∗0 99±0 04600 77±0 04∗1 00±0 031200 37±0 03∗0 97±0 04F值305 600 27P值<0 05>0 05
注:与0 min比较,*P<0.05
3 讨论
多年来,膀胱癌一直是我国泌尿系统最常见的恶性肿瘤,发病率呈逐年上升趋势,且复发率高[1]。膀胱癌术后常用膀胱灌注化学药物预防复发,但效果不甚理想且局部反应较大。研究证实,姜黄素对于膀胱癌、前列腺癌、结肠癌及乳腺癌等多种肿瘤均具有抑制性[2-3],能够显著减少肿瘤细胞数,缩小肿瘤细胞体积。但姜黄素对膀胱癌的作用尚不清楚。
DMC作为姜黄素的结构类似物,也同样具有抗肿瘤效应[4],可强烈抑制前列腺癌细胞的增殖[5]。其稳定性较传统姜黄素更强,能够显著延长药物的作用时间和体内t1/2。本研究发现,实验组用不同浓度的DMC孵育48 h后,细胞增殖活力均低于对照组,提示DMC能够显著抑制T24细胞的增殖活力,且具有剂量及时间依赖性。PCNA参与DNA的合成过程,是常用的细胞增殖标志物,该蛋白的表达量与细胞的增殖状态密切相关[6]。p27是细胞周期抑制物,在增殖活跃的细胞中,该蛋白表达量下调,并成为肿瘤治疗的潜在靶点[7]。本研究发现,用不同浓度的DMC(20、40、80 μM)处理T24细胞48 h,PCNA相对表达量均低于对照组,p27相对表达量均高于对照组;且随DMC浓度的增加PCNA相对表达量逐渐减低,p27相对表达量逐渐增高,提示DMC能够下调PCNA的表达量,上调p27表达量。因此,推测DMC抑制T24细胞增殖的机制可能与该化合物下调PCNA及上调p27的表达量有关。
诱导恶性肿瘤细胞凋亡是抗肿瘤药物作用的重要机制之一。姜黄素可以通过Caspase非依赖性方式诱导PC-3细胞发生凋亡[8]。本研究发现,在DMC处理的T24细胞中,细胞凋亡率高于对照组,且随给药浓度的增加及时间的延长而增加。Caspase 3是Caspase凋亡途径中的主要执行者,前体Caspase 3被剪切后形成有功能的剪切体[9]。PARP是Caspase 3的底物,其与DNA修复等有关,当Caspase 3激活后,PARP即被剪切,从而发挥功能[9]。本研究发现,不同浓度DMC(20、40、80 μM)处理T24细胞48 h后,pro-caspase 3、cleaved-caspase 3、pro-PARP、cleaved-PARP的相对表达量与对照组比较有明显差异,由于有活性的Caspase 3剪切体表达量增加,该酶的底物PARP剪切体表达量也显著增加,因此DMC诱导的T24细胞凋亡可能与该化合物诱导激活Caspase 3依赖的凋亡通路有关。mTOR通路在肿瘤增殖与生长、维持代谢与稳态、参与凋亡与自噬等多种生物学过程中起到重要作用[10]。本研究还发现,用浓度为40 μM的DMC分别刺激T24细胞0、15、30、60、120 min,采用Western印迹法检测与细胞增殖密切相关的mTOR通路磷酸化的变化显示,不同时间点p-mTOR的相对表达量有明显差异,且刺激30、60、120 min时的p-mTOR的相对表达量均低于0 min时;不同时间点mTOR的相对表达量无明显差异。说明在给予DMC(40 μM)刺激30 min后,可显著抑制mTOR的磷酸化水平,因此DMC可能通过抑制mTOR的磷酸化而发挥对膀胱癌的抑制作用,提示DMC抑制T24细胞增殖的分子机制可能与抑制mTOR通路活化有关。
综上所述,本研究发现DMC可通过多个靶点对膀胱癌细胞发挥显著的抗肿瘤活性,对于临床上膀胱癌的治疗有较广阔的应用价值,为今后开发新一代抗肿瘤药物提供了新的思路。然而DMC在动物体内是否也同样有类似的抗肿瘤效果仍需进一步研究证实。
1 吴阶平.吴阶平泌尿外科学 [M].山东:山东科学技术出版社,2004:965-966.
2 Teiten MH,Gaascht F,Cronauer M,et al.Anti-proliferative potential of curcumin in androgen-dependent prostate cancer cells occurs through modulation of the wingless signaling pathway[J].Int J Oncol,2011,38(3):603-611.
3 Lee YK,Park SY,Kim YM,et al.Regulatory effect of the AMPK-COX-2 signaling pathway in curcumin-induced apoptosis in HT-29 colon cancer cells[J].Ann N Y Acad Sci,2009,1171:489-494.
4 Yodkeeree S,Ampasavate C,Sung B,et al.Demethoxycurcumin suppresses migration and invasion of MDA-MB-231 human breast cancer cell line[J].Eur J Pharmacol,2010,627(1/3):8-15.
5 Ni X,Zhang A,Zhao Z,et al.Demethoxycurcumin inhibits cell proliferation,migration and invasion in prostate cancer cells[J].Oncol Rep,2012,28(1):85-90.
6 López de Saro FJ.Regulation of interactions with sliding clamps during DNA replication and repair[J].Curr Genomics,2009,10(3):206-215.
7 He W,Wang X,Chen L,et al.A crosstalk imbalance betwee p27(Kip1) and its interacting molecules enhances breast carcinogenesis[J].Cancer Biother Radiopharm,2012,27(7):399-402.
8 Hilchie AL,Furlong SJ,Sutton K,et al.Curcumin-induced apoptosis in PC3 prostate carcinoma cells is caspase-independent and involves cellular ceramide accumulation and damage to mitochondria[J].Nutr Cancer,2010,62(3):379-389.
9 Cohen GM.Caspases:the executioners of apoptosis[J].Biochem J,1997,326(Pt 1):1-16.
10 Polivka J Jr,Janku F.Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway [J].Pharmacol Ther,2014,142(2):164-175.

