PGC-1α对C2C12成肌细胞增殖的影响
林亚秋, 谈永萍, 赵燕英, 贺庆华, 罗敏, 邱翔, 钟红梅
(1.西南民族大学生命科学与技术学院, 四川 成都 610041; 2.西南民族大学学报编辑部, 四川 成都 610041)
PGC-1α对C2C12成肌细胞增殖的影响
林亚秋1, 谈永萍1, 赵燕英1, 贺庆华1, 罗敏2, 邱翔1, 钟红梅1
(1.西南民族大学生命科学与技术学院, 四川 成都 610041; 2.西南民族大学学报编辑部, 四川 成都 610041)
PGC-1α(Peroxisome Proliferators Activated Receptor gamma coactivator 1 alpha)是一种核受体转录辅助激活因子,广泛参与机体的生物氧化和能量代谢活动.本实验以小鼠C2C12成肌细胞为材料, 通过转染pcDNA3.1-flag-PGC-1α真核表达载体, 并且与转染空载体的实验对照组比较, 利用荧光定量PCR检测转染效果, 利用MTT比色法检测PGC-1α对成肌细胞增殖的影响; 结果显示, PGC-1α在C2C12成肌细胞中被成功超表达, 在转染后的2 -5 d, 转染真核表达载体组与转染空载体组相比, 显著抑制细胞增殖(P<0.05), 但在第6 d差异不显著.
PGC-1α; C2C12成肌细胞; 增殖
骨骼肌是生物体能量代谢的主要场所之一.骨骼肌纤维的类型根据代谢可分为氧化型和糖酵解型两种, 不同类型的肌纤维具有不同的特性, 主要表现在其收缩功能、线粒体成分和代谢特性等方面[1], 最终对肉质形成具有不同的调控作用[2].报道指出, 肌肉中氧化型纤维比例高, 肌肉肉色红润, 肌内脂肪含量高, 肌肉细嫩, 风味良好; 反之肌肉中酵解型纤维比例高, 则肉色发白, 品质下降[3-4].肌纤维发育是一个动态的过程, 可发生肌纤维类型转化的现象, 因此, 从肌纤维类型转化的角度来改变骨骼肌纤维类型组成, 进而改善其品质在动物育种领域具有重要的理论与实际意义.
PGC-1α属于与能量代谢关系最密切的PGC-1(Peroxisome Proliferators Activated Receptor gamma coactivator 1)转录辅助活化因子家族成员, 最早由Puigservre于1998年在研究小鼠棕色脂肪组织时所发现的一种新型核受体转录辅助激活因子[5].随后同家族的PGC-1β[6]、PRC[7]也相继被发现.目前报道指出, PGC-1α广泛存在于包括哺乳类、鸟类、爬行类和鱼类等在内的多种脊椎动物中[8].PGC-1α可以辅助激活多种转录因子, 如核受体家族成员ER、PPARγ[9], 非核受体家族成员SREBP[10], FOXO1[11]及SOX9[12], 广泛参与调节与生物氧化和能量代谢的相关的过程.PGC-1α具有较明显的组织表达和信号转导特异性, 组织表达特异性指该基因主要表达于如心脏、肝脏、骨骼肌等富含线粒体的组织中, 而在白色脂肪组织、小肠、大肠中的表达水平相对较低[13].Lin等2002年发现PGC-1α可使小鼠的Ⅱ型肌纤维出现Ι型肌纤维的特征[14].此后许多学者分别采用不同的技术方法对PGC-1α在人和不同动物(如小鼠和鸡等)肌纤维类型转化中的作用进行了相关研究, 指出PGC-1α在肌纤维类型转化中具有重要的调控作用, 但是具有物种特异性.关于PGC-1α在成肌细胞增殖中的作用尚未见报道, 因此本实验以小鼠C2C12细胞为材料, 通过转染pcDNA3.1-flag-PGC-1α质粒使其超表达, 研究PGC-1α对成肌细胞增殖的影响, 研究结果为阐明PGC-1α在肌肉发育过程中的作用提供重要数据.
1 材料与方法
1.1 实验材料和主要试剂
本实验所用小鼠PGC-1α超表达载体—pcDNA3.1-flag-PGC-1α由本实验室构建保存, C2C12成肌细胞由本实验室冻存备用.
高糖DMEM/F12细胞培养基与胰蛋白酶购自Gibco公司; Sofast 基因转染试剂购自太阳马公司; 胎牛血清购自杭州四季青公司; Trizol试剂与SYBR Premix Ex Taq II TM购自大连TaKaRa公司; MTT购自Sigma公司; Taq DNA聚合酶与反转录试剂盒均购自Fermentas公司; 无内毒素质粒小提试剂盒购自AXYGEN公司.
1.2 方法
1.2.1 C2C12成肌细胞的培养
从液氮罐中取出装有细胞的冻存管, 快速置于37 ℃水浴中, 轻摇1 min使其溶解, 然后加入10倍冻存液体积的培养基, 1050 rpm离心, 4 min, 弃上清, 将细胞接种于含10 %胎牛血清(Fetal Bovine Serum, FBS)的高糖DMEM培养基中, 在37 ℃, 5 %CO2的培养箱中静置培养. 待细胞将长至90 %以上的时候进行传代, 接种到96孔和6孔培养板中, 在37 ℃, 5 %的CO2培养箱中培养.
1.2.2 细胞转染
将实验室已有的pcDNA3.1-flag-PGC-1α真核表达质粒在大肠杆菌中重新活化并扩大培养, 经上海生工有限公司测序鉴定正确后按照质粒小提试剂盒说明书提取质粒待用于转染.
待细胞密度在90 %左右开始进行转染, 转染前对细胞进行饥饿处理, 于2 h 前换一半无血清无双抗的DMEM培养基.然后按照Sofast转染试剂盒说明书操作转染到6孔和96孔培养板中.
1.2.3 转染效果的检测
收集转染后第2 d的C2C12成肌细胞, 然后用Trizol试剂提取收集的细胞总RNA, 利用琼脂糖凝胶电泳鉴定提取RNA的完整性, 利用紫外分光光度计测定提取总RNA的OD值.取鉴定好的1 μg总RNA以Oligo (dT)为引物合成cDNA第一链.利用Primer Premier5.0软件, 设计PGC-1α和β-actin基因特异引物(表1), 然后利用荧光定量PCR检测PGC-1α的超表达效果.荧光定量PCR反应体系如下: SYBR Premix Ex Taq II TM PCR 10 μL,上下游引物(10 μmol/L)各0.5 μL, cDNA 1μL, 最后加灭菌水至20 μL.反应条件为: 95 °C预变性1 min, 95 °C变性30 s, 退火30 s(56.8 ℃/60 ℃), 45个循环, 72°C 延伸30 s.所获得的荧光定量数据采用2-ΔΔCt方法进行分析[15].
1.2.4 MTT比色
分别对转染pcDNA3.1-flag-PGC-1α真核表达载体和空载体组的2-6 d的细胞进行MTT比色测定.在测定前四个4 h, 于96孔培养板中加入20 μL MTT溶液, 4 h后终止培养.弃去培养液后, 每孔加入150 μL DMSO, 恒温摇床上震荡10 min, 选择波长490 nm, 在酶联检测仪上测定各孔的吸光度值.
1.2.5 数据分析
数据采用生物统计软件SPSS 13.0进行分析, 数据用平均值±标准误( mean±SE) 表示, 显著性检验分析采用ANOVA进行, 差异显著P<0.05, 差异极显著P<0.01.

表1 基因特异引物序列Table 1 Primers for specific genes
2 结果
2.1 转染pcDNA3.1-flag-PGC-1α后PGC-1α表达的变化
转染pcDNA3.1-flag-PGC-1α真核表达载体后的C2C12细胞, 提取第2天细胞总RNA, 经过荧光定量PCR检测PGC-1α mRNA 的表达水平, 如图1所示, 转染了pcDNA3.1-flag-PGC-1α真核表达载体组PGC-1α mRNA 的表达水平极显著高于转染空载体组.证明我们转染的pcDNA3.1-flag-PGC-1α真核表达载体使细胞中PGC-1α的表达水平升高.
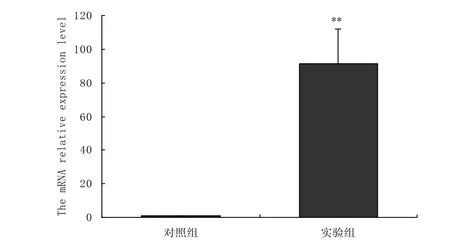
图1 荧光定量PCR分析转染pcDNA3.1-flag-PGC-1α后PGC-1α表达的变化Fig.1 Real-time fluorescence quantitative PCR analysis of PGC-1α in C2C12 myoblast transfected with pcDNA3.1-flag-PGC-1α
2.2 pcDNA3.1-flag-PGC-1α对C2C12细胞增殖的影响
转染pcDNA3.1-flag-PGC-1α真核表达载体后的C2C12细胞, 用含10 %FBS的高糖DMEM/F12培养基培养, 在转染后的第2-6 d分别用MTT比色法处理细胞.由结果可知(图2), 在转染后的第2-5 d, 转染pcDNA3.1-flag-PGC-1α真核表达载体组与转染空载体组相比, 显著抑制细胞增殖, 但在第6 d差异不显著, 原因可能是在第6 d已经无超表达效果.
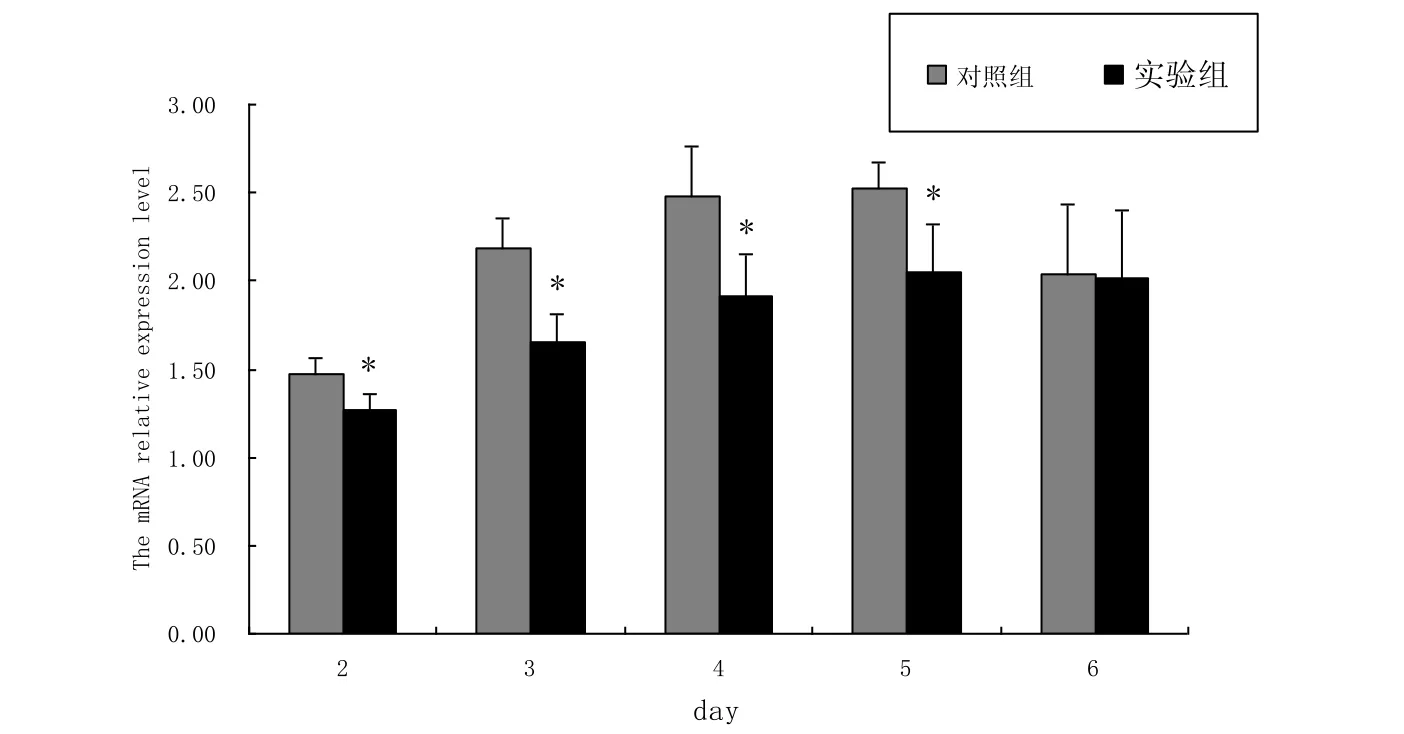
图2 PGC-1α对C2C12细胞增殖的影响Fig.2 The effect of PGC-1α on C2C12 cell proliferation
3 讨论
肌纤维是肌肉组织的基本组织单位, 其形成是一个复杂的过程, 其中成肌细胞分化是肌纤维发生中的关键一步, 因此研究成肌细胞增殖和分化具有重要的理论和实际意义.PGC-1α作为转录辅助活化因子在机体能量代谢中发挥重要作用[16].近几年关于PGC-1α在骨骼肌中的作用, 尤其是在肌纤维类型转化中的作用成为学者研究的焦点问题.Yamaguchi等指出, 在连续的温和热应激下PGC-1α可使人成肌细胞中Ⅱ型肌纤维向Ⅰ型肌纤维转化[17]; Nikolić等指出通过向体外培养的人成肌细胞中转染PGC-1α逆转录病毒载体使PGC-1α超表达, 发现Ⅱa型肌纤维的标志基因MyHCⅡa mRNA表达水平被显著降低, MyHCI/MyHCⅡa mRNA比率被显著增加[18].Ueda等研究指出, 温度刺激PGC-1α表达后可使鸡胸肌部分Ⅱb型转化为Ⅱa型肌纤维[19].本实验室前期研究结果表明PGC-1α在C2C120-8 d均存在表达, 在第4 d和第6 d表达水平最高, 且通过生肌抑制素MyoG的表达来促进C2C12细胞的分化[20].但关于PGC-1α对C2C12细胞增殖的作用如何尚未见报道, 为了确定其是否在增殖的过程中发挥作用, 本实验通过转染pcDNA3.1-flag-PGC-1α真核表达载体, 使PGC-1α基因超表达, 然后利用MTT比色法检测了其对成肌细胞增殖的影响.结果发现在转染后的第2-5 d, 转染pcDNA3.1-flag-PGC-1α真核表达载体组与转染空载体组相比, 显著抑制成肌细胞增殖, 但其作用机理尚需要进行深入研究.
[1]BERCHTOLD M W, BRINKMEIER H, MUNTENER M.Calcium ion in skeletal muscle: its crucial role for muscle function, plasticity, and disease[J].Physiol Rev,2000,80 (3):1215-1265.
[2]PICARD B, JURIE C, DURIS M P,et al.Consequences of selection for higher growth rate on muscle fibre development in cattle[J].Livestock Science, 2006, 102(1/2):107-120.
[3]LEFAUCHEUR L, MILAN D, ECOLAN P,et al.Myosin heavy chain composition of different skeletal muscles in Large White and Meishan pigs[J].J Anim Sci, 2004, 82(7):1931-1941.
[4]BOWKER B C, BOTREL C, SWARTZ D R.Influence of myosin heavy chain isoform expression and postmortem metabolism on the ATPase activity of muscle fibers[J].Meat Sci, 2004, 68(4):587-594.
[5]PUIGSERVRE P, WU Z, PARK C W,et al .Acold-inducible coactivator of nuclear receptors linked to adaptive Thermogenesis[J].Cell,1998,92(6):829-839.
[6]LIN J, PUIGSERVER P, DONOVAN J, et al.Peroxisome proliferators activated receptor gamma coactivator 1 beta(PGC-1 beta), a novel PGC-1 related transcription coactivator associated with host cell factor [J].J Biol Chem,2002, 277(3):1645-1648.
[7]ANDERSSON U, SCARPULLA R C.PGC-1 related coactivator, a novel, serum-inducible coactivator of nuclear respiratory factor 1 dependent transcription in mammalian cells [J].Mol Cell Biol,2001,21(11):3738-3749.
[8]LEMOINE CMR, LOUGHEED SC, MOYES CD.Modular Evolution of PGC-1α in Vertebrates[J].J Mol Evol, 2010, 70(5):492-505.
[9]PUIGSERVER P, SPIEGELMAN B M.Peroxisome proliferators activated receptor-gamma co-activator 1 alpha (PGC-1 alpha): transcriptional coactivator and metabolic regulator [J].Endocr Rev,2003,24(1):78-90.
[10]LIN J, YANG R, TARR P T, et al.Hyperlipidemic effects of dietary saturated fats mediated through PGC-1 β coactivation of SREBP [J].Cell,2005,120(2):261-273.
[11]PUIGSERVER P, RHEE J, DONOVAN J, et al.Insulin regulated hepatic gluco neogenesis through FOXO1-PGC-1α interaction[J].Nature, 2003, 423 (6939):550-555.
[12]KAWAKAMI Y, TSUDA M, TAKAHASHI S, et al.Transcriptional coactivator PGC-1α regulates chondrogenesis via association with Sox9[J].Proc Natl Acad SCI USA, 2005,102(7):2414-2419.
[13]BUGGER H, ABEL E D.Molecular mechanisms for myocardial mitochondrial dysfunction in the metabolic syndrome [J].Clin Sci,2008,14(3):195-210.
[14]LIN J, WU H, TARR PT, et al. Transcriptional co-activator PGC-1a drives the formation of slow-twitch muscle fibre[J].Nature, 2002 ,418(6899):797-801.
[15]LIVAK KJ, SCHMITTGEN TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2−△△Ctmethod [J].Methods,2001, 25:402-408.
[16]LIU C, LIN JD.PGC-1 coactivators in the control of energy metabolism[J].Acta Bioch Bioph Sin, 2011,43(4):248-57.
[17]YAMAGUCHI T, SUZUKI T, ARAI H, et al.Continuous mild heat stress induces differentiation of mammalian myoblasts, shifting fiber type from fast to slow[J].Am J Physiol Cell Physiol, 2010 ,298(1):C140-148.
[18]NIKOLIĆ N, RHEDIN M, RUSTAN AC, et al.Overexpression of PGC-1α Increases Fatty Acid Oxidative Capacity of Human Skeletal Muscle Cells[J].Biochem Res Int, 2012,2012:714074-714087.
[19]UEDA M, WATANABE K, SATO K, et al.Possible role for avPGC-1 in the control of expression of fiber type,along with avUCP and avANT mRNAs in the skeletal muscles of cold-exposed chickens[J].FEBS lett, 2005, 579(1):11-17.
[20]LIN YQ, ZHAO YY, LI RW,et al.PGC-1α is associated with C2C12 myoblast differentiation[J].Cent Eur J Biol, 2014, 9(11): 1030-1036.
Influence of PGC-1α on C2C12 myoblast proliferation
LIN Ya-qiu1, TAN Yong-ping1, ZHAO Yan-ying1, HE Qing-hua1, LUO Min2, QIU Xiang1, ZHONG Hong-mei1
(1.School of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.; 2.Journal of Southwest University for Nationalities, Chengdu 610041, P.R.C.)
Peroxisome proliferator-activated receptor co-activator 1α (PGC-1α) is a functional activator of peroxisome proliferator-activated receptor, involved in biological oxidation and energy homeostasis.In the present study, a plasmid pcDNA3.1-flag-PGC-1α was constructed and transfected into C2C12 cells.PGC-1α over-expressions were detected using real-time quantitative PCR.Furthermore, the influence of PGC-1α on C2C12 cell viability was examined by MTT.The results showed that PGC-1α was over-expressed in C2C12 cells, the cell proliferation was significantly inhibited in PGC-1α transfection groups versus control groups (empty vector transfection) in the 2ndto 5thdays after transfection (P<0.05).However, the inhibition effect was not significant on the 6thday.
PGC-1α; C2C12 myoblast; proliferation
Q591
A
1003-4271(2014)06-0814-04
10.3969/j.issn.1003-4271.2014.06.03
2014-09-19
林亚秋(1976-), 女, 汉族, 内蒙古阿荣旗人, 副教授, 博士.
国家自然科学基金(No.31201990)和四川省应用基础项目(2014JY0088)

