马属动物梨形虫病的PCR鉴别诊断方法研究
,
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室农业部畜禽病毒学重点开放实验室,甘肃兰州 730046)
马属动物梨形虫病的PCR鉴别诊断方法研究
龚真莉,刘光远
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室农业部畜禽病毒学重点开放实验室,甘肃兰州 730046)
本研究基于对马属动物梨形虫病18s rRNA 基因序列的分析,建立了一种PCR检测方法。该方法可通过两步PCR反应同步检测马的两种梨形虫病(马泰勒虫和驽巴贝斯虫),具有省时和敏感性较高的特点。通过实验分别评估了此方法的特异性和敏感性,并对20份田间血样进行检测。试验结果表明该方法具有较高的特异性和敏感性。对田间样品的阳性检测率明显高于普通的显微镜观察法。说明此方法具有较好的可行性,可以尝试在基层实验室推广。
马属动物;梨形虫病;PCR;诊断方法
马属动物是国内仅次于牛和羊的主要家畜种群,在我国现有的农业生产条件下,马属动物依然是大部分农村(特别是山区和广大西部地区)的主要使役动物。目前,该动物的梨形虫病流行非常广泛,危害非常严重。国外对该病的研究较多,主要集中于免疫诊断和免疫预防研究,我国对这类病原研究很少,主要局限于普通临床和病原学方面。近年来,此病在我国的流行呈上升趋势,对畜牧业造成的危害极为严重,特别是一些西部贫穷地区,对马属动物几乎是灾难性的。
近年在甘肃中东部和青海等一些地区发生的“马属动物疑难病”危害极大,难以控制,在流行几年后方确诊为马的巴贝斯虫病。因此,建立简便、快捷、准确、及时的分子诊断方法是十分必要的。
近年来,聚合酶链式反应(PCR)是一种新型的分子生物学检测方法,使快速准确检测马巴贝斯虫病成为可能[1]。并且已经有试验表明PCR在检测马的巴贝斯虫的敏感性比显微镜检测方法高[2],比如巢式PCR和/或者原位杂交可以达到较高的敏感性。然而,这些方法仍然相对费时并且要求复杂的程序[3]。因此,有必要发展相对简单的、适合常规实验室快速检测的PCR方法。本研究中,我们基于对18s rRNA基因分析,设计了三对(五条)引物,建立了一种PCR检测方法,可通过两步反应同步特异性检测马的两种巴贝斯虫病(马泰勒虫和驽巴贝斯虫)。
1 材料与方法
1.1 工具酶与试剂盒 全血基因组DNA提取试剂盒购自Gentra公司;rTaq酶、DNA连接试剂盒、DNA回收试剂盒和质粒提取试剂盒购自大连宝生物工程有限公司;限制性内切酶购自Promega公司;琼脂糖购自美国Biowest公司;其它试剂均为国产分析纯级产品。
1.2 虫体获得 马泰勒虫及驽巴贝斯虫虫血为实验室保藏虫种接种宿主动物毛驴感染获得。
1.3 DNA提取 取少量虫体感染血液,使用Gentra公司基因组DNA提取试剂盒,按其说明书使用步骤提取马泰勒虫及驽巴贝斯虫的基因组DNA,并测定其浓度。
1.4 引物设计、PCR扩增及测序 鉴别诊断所需引物参考国外已发表的马泰勒虫及驽巴贝斯虫的18S rRNA基因序列设计合成。将所获得的基因片段经胶回收,连接pMD18-T载体,送公司测序,最后通过BLAST分析同源性。引物合成及测序均由大连宝生物工程有限公司合成。引物序列详见表1。

表1 扩增马泰勒虫和驽巴贝斯虫的引物
PCR扩增体系(50μL)为:10×PCR buffer 5μl,dNTP mixture 4μL,上下游引物各1μL,虫体DNA 2μL,rTaq DNA聚合酶0.5μL,加灭菌去离子水至终体积50μL。混匀后置PCR扩增仪中,扩增程序为:96℃预变性10min,94℃变性1 min,通用引物退火温度为58℃,特异性引物退火温度为58.5℃,退火时间均为1 min,72℃延伸40s,共35个循环后72℃延伸10 min。
1.5 特异性试验 利用实验室已有其它种属动物的巴贝斯虫基因组DNA、泰勒虫基因组DNA及已知无此类寄生虫与病毒感染的阴性动物全血基因组DNA进行相同条件、相同方法检测,以检验此方法的特异性。
1.6 敏感性试验 将染虫率大致相当的两种虫血提取基因组DNA,并按10倍梯度稀释,再分别用马泰勒虫、驽巴贝斯虫通用引物进行PCR扩增,判定该方法的敏感性。
1.7 田间样品的检测及与显微镜观察方法的对比 对实验室人工感染虫体但经显微镜检查始终未检出虫体的毛驴虫血DNA,及若干份田间发病毛驴、临床症状疑似该病的样品基因组DNA,以及实验室确认未感染过马属动物巴贝斯虫病的三份阴性动物对照样品DNA,分别通过显微镜检查及本实验中建立的PCR方法进行检测,对比两者的阳性检出率。
2 结果
2.1 虫体基因组DNA提取 分别提取已知实验室人工感染马泰勒虫和驽巴贝斯虫单一种的毛驴虫血基因组DNA,两者的染虫率均为7%~10%。并提取已知马属动物巴贝斯虫阴性动物全血基因组DNA作为对照。DNA琼脂糖凝胶电泳可见已成功获得DNA(图1)。测定的DNA浓度分别为10mg/mL(马巴贝斯虫)和2.84mg/mL(驽巴贝斯虫)。

图1基因组DNA电泳图
2.2 PCR方法及测序结果分析 Bab-F和Bab-R引物对为马属动物巴贝斯虫检测的通用引物,可以同时检测感染的两种虫体。此对引物扩增马泰勒虫和驽巴贝斯虫的目的片段分别为960bp和906bp(图2)。Com-Bec和Cab-R为驽巴贝斯虫特异性引物对,目的片段约为589bp,Com-Bec和Equi-R为马泰勒虫特异性引物,目的片段约为420bp(图3)。对照组均未出现DNA条带。扩增获得的各片段均进行胶回收、连接至pMD18-T载体并测序,结果表明与GenBank中登陆的基因序列(序列号为Babesia equi Z15105;Babesia caballi AY309955)的同源性均达到97%以上,此结果与实验设计相符,说明该方法具有可行性。
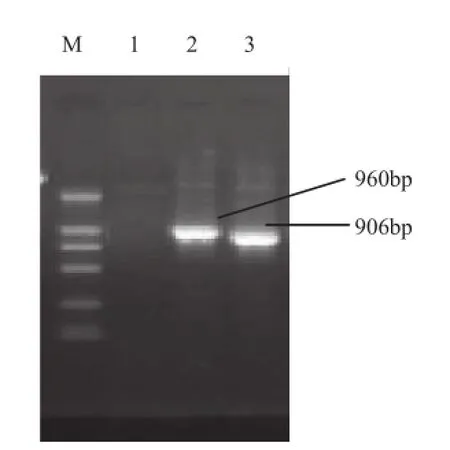
图2通用引物PCR扩增结果

图3特异性引物PCR扩增结果
2.3 PCR方法的特异 实验室已有其它种属动物的巴贝斯虫基因组DNA、泰勒虫基因组DNA及已知阴性马类动物全血基因组DNA进行相同条件、相同方法检测,结果均无DNA条带产生,说明此方法具有可靠的特异性(图4)。

图4 PCR方法特异性检测结果
2.4 PCR方法的敏感性 分别对驽巴贝斯虫和马巴贝斯虫基因组DNA进行10倍系列稀释,同样条件进行PCR扩增。结果表明,该方法对驽巴贝斯虫基因组DNA的检测下限为2.8×10-3μg/μL,对马巴贝斯虫基因组DNA的检测下限为1×10-5μg/μL(图5、图6)。

图5 PCR方法检测驽巴贝斯虫敏感性结果
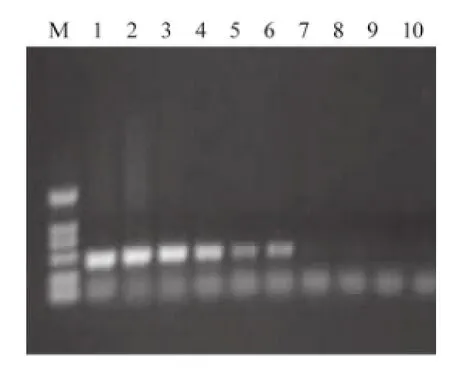
图6 PCR方法检测马泰勒虫敏感性结果
2.5 田间样品的检测结果及与显微镜方法的对比通过对实验室人工感染毛驴的3份血样及采自青海省贵南县部分乡镇的7份马血、10分毛驴血样分别进行PCR方法和显微镜镜检进行检测。检测结果表明,建立的PCR诊断方法的敏感性显著高于传统的显微镜检测方法(表2)。

表2 PCR方法与显微镜方法的对比
3 讨论
梨形虫在自然感染病例中,诊断极为困难,目前的检测手段非常落后,仅依靠末梢血液涂片镜检来确诊病例,检出率和准确率很低。同时,在血液涂片中发现病原时往往已是病程的中后期,错过了病畜的最佳治疗期,导致病畜愈后不良,损失严重。国内大多数基层兽医工作者对梨形虫认识不够,诊断困难,经常发生误诊或诊断不及时而导致病畜愈后不良或死亡。
近年来,国外已经报道了若干有关马属动物巴贝斯虫病的PCR检测方法。但是这些方法都有其不足之处,有的实验程序复杂、实验要求高,如:巢式PCR方法,ELISA检测等方法对于基层实验室来说存在实验试剂、检测仪器昂贵以及实验时间长、对实验人员技术要求高等缺点。目前,对于马属动物巴贝斯虫病的检测来说,特别对于发病率较高的广大西部地区,检测手段和实验室仪器相对落后。所以,发展一种敏感性高、特异性好、耗时较少的适用于田间动物的快速诊断方法十分必要。
在本研究中,利用三对(五条)引物、两个反应体系即可进行马属动物梨形虫病的检测,并且可以准确鉴别马泰勒虫和驽巴贝斯虫两个虫种。此方法用时短,易操作,对于基层工作人员技术要求相对较低。该方法敏感性较高,可检测隐性感染动物,可作为寄生虫感染的早期诊断方法,有助于疾病的预防和早期治疗。
[1] Bashiruddin J B, Cammà C, Rebêlo E. Molecular detection of Babesia equi and Babesia caballi in horse blood by PCR amplifcation of part of the 16S rRNA gene[J]. Vet Parasitol,1999,84(1/2):75-83.
[2] Rampersad J, Cesar E, Campbell M D, et al .A field evaluation of PCR for the routine detection of Babesia equi in horses[J].Vet Parasitol, 2003, 114(2):81-87.
[3] Vieira T S, Vieira R F, Finger M A,et al. Seroepidemiological survey of Theileria equi and Babesia caballi in horses from a rural and from urban areas of Paraná State, southern Brazil[J].Ticks and Tick-borne Diseases, 2013,4(6) :537-541.
Establishment of PCR differentially diagnostic method for Equine Piroplasmosis
Gong Zhenli,Liu Guangyuan
(Key Laboratory of Animal Virology of Ministry of Agriculture, State Key Laboratory of Veterinary Etiological Biology,Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou, Gansu 730046)
In this study,a PCR assay was developed based on the analysis of 18s rRNA gene sequences of Babesia equi and Babesia caballi. This method could be performed by a two-step PCR reaction to detect the two piroplasmosis (Babesia equi and Babesia caballi ), with high sensitivity and time-saving. The specifcity and sensitivity of the method were evaluated, and 20 feld blood samples were tested. The results showed that the method was of high specifcity, sensitivity and stability. Positive detection rate in the feld samples with this method was signifcantly higher than that with the ordinary microscope method indicating good feasibility for promotion in the grassroots laboratory.
Equine;Piroplasmosis;PCR;diagnostic method
S852.723;S858.21
:A
:1005-944X(2014)05-0074-04

