塞来昔布对大鼠骨组织的影响
刘衍志,陈 艳,高 翔,苏艳杰,崔 燎
(广东天然药物研究与开发重点实验室,广东医学院,广东湛江524023)
·实验研究·
塞来昔布对大鼠骨组织的影响
刘衍志,陈 艳,高 翔,苏艳杰,崔 燎
(广东天然药物研究与开发重点实验室,广东医学院,广东湛江524023)
目的探讨塞来昔布对大鼠骨组织的影响。方法16只3月龄雌性SD大鼠随机分为两组:正常对照组和塞来昔布给药组,每组8只。塞来昔布组大鼠每天灌胃给予塞来昔布50 mg·kg-1,正常对照组给予等量生理盐水。给药时间为8周,每周记录大鼠体重。实验结束时取大鼠左侧股骨用双能X线骨密度仪(DXA)测定骨密度,用三点弯曲法测定股骨生物力学特性,然后再用离子发射光谱仪测定股骨中的Ca、P、Mg的含量。另取大鼠胫骨中段皮质骨做不脱钙骨磨片测定骨形态计量学参数。结果塞来昔布50 mg·kg-1用药8周与对照组相比,明显降低大鼠股骨骨密度,但是对皮质骨骨量、骨形成率、矿化沉积率、股骨最大载荷和断裂载荷等均未产生显著性损害,也并未降低股骨中Ca、P、Mg的含量。结论塞来昔布用药8周明显降低股骨骨密度,但并未进一步损害皮质骨骨量、骨形成、骨矿无机质含量和骨生物力学特性。
塞来昔布;类风湿关节炎;骨组织;大鼠
目前临床上已有报道类风湿关节炎在治疗的过程中,患者的骨骼质量会受到不同程度的损害[1,2]。这种损害主要来源于两个方面,一个是类风湿关节炎本身,研究报道患者即使无药物的干预,炎症本身也会对骨骼产生一系列的影响[3,4],另一个来源于治疗类风湿关节炎所使用的药物。塞来昔布(Celecoxib,Cel)是一种Cox-2选择性抑制剂,是临床常用的治疗类风湿关节炎的药物。以往的研究报道,长时间使用塞来昔布,在控制病情的同时也会对骨骼带来一些负面的影响。然而,塞来昔布药物的长期使用对骨质量的影响并不明了。这是因为类风湿关节炎在治疗的过程中,疾病本身对骨骼的影响很可能掩盖药物对骨骼的真实作用,反过来也一样;而且在治疗疾病的过程中,往往是多种药物的联合使用,这可能遮掩了单一药物对骨骼的实际作用。为了更合理地在临床上使用塞来昔布,减少其可能对骨骼产生的副作用,本研究以正常大鼠作为实验对象,从骨形态计量学、骨密度、骨生物力学、骨成分等多方面,探讨长期使用塞来昔布时,药物自身对骨骼的影响。
1 材料与方法
1.1 材料
1.1.1 动物 雌性SD大鼠,广东省医学实验动物中心提供,动物合格证号:SCXK(GUANG DONG)2008-0002。
1.1.2 仪器与试药 PRODIGY型骨密度仪(美国GE公司);MTX 858 Mini Bionix型材料测试系统(美国MTSSystem公司);IRIS/AP型ICP离子性发射光谱仪(美国IJA公司);塞来昔布胶囊(西乐葆)(美国辉瑞制药公司生产,批号:J20080059)。
1.2 方法 将16只正常健康的3月龄雌性SD大鼠随机分为:正常对照组(Con)和塞来昔布给药组(Cel),每组8只。大鼠适应性喂养两周后,塞来昔布组每只大鼠用灌胃的方式给予塞来昔布50 mg·(kg·d)-1,正常对照组大鼠给予等量的生理盐水灌胃。实验计划给药8周,每周记录大鼠体重。实验结束后大鼠用3%戊巴比妥麻醉,心脏取血处死。动物处死前13 d和14 d在大鼠皮下注射四环素(50 mg· kg-1),另在处死前3 d和4 d在大鼠颈部皮下注射钙黄绿素(10 mg·kg-1),进行大鼠体内骨形成双荧光标记。分离右侧胫骨中段制作不脱钙骨磨片,进行骨组织形态计量学分析。分离大鼠左侧股骨,用骨密度仪(DXA)进行骨密度(BMD)扫描分析,随后左股骨及另取第六腰椎椎体利用材料测试系统进行三点弯曲力学和腰椎压缩生物力学检测。将做完生物力学的左股骨收集,用6 mol·L-1盐酸消化,得到滤液,以滤液-双蒸水=1∶200比例稀释,然后用离子性发射光谱仪测定Ca、P、Mg等元素的含量,再依据标准品含量及样品稀释倍数计算股骨中Ca、P、Mg等元素的含量。
2 数据统计及分析
3 结果
从第3周开始给药后,在整个实验给药期间,塞来昔布组大鼠体重与对照组体重相比,无显著性差异,仅在第7周后略有下降,结果见图1。
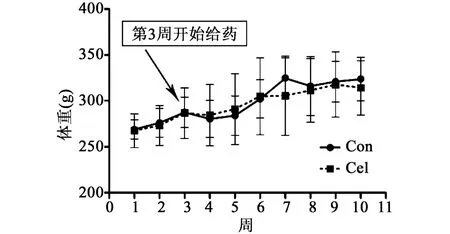
图1 塞来昔布用药8周对大鼠体重的影响
与对照组相比,塞来昔布组股骨骨密度明显下降(P<0.05),结果见图2。
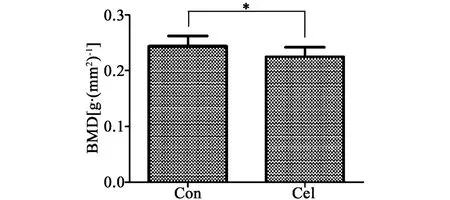
图2 塞来昔布用药8周对大鼠股骨骨密度的影响注:与对照组相比,*P<0.05
塞来昔布组与对照组相比,大鼠胫骨中段骨骨髓面积百分数(%Ma.Ar)和皮质骨面积百分数(% Ct.Ar)均无显著性差异,结果见图3。
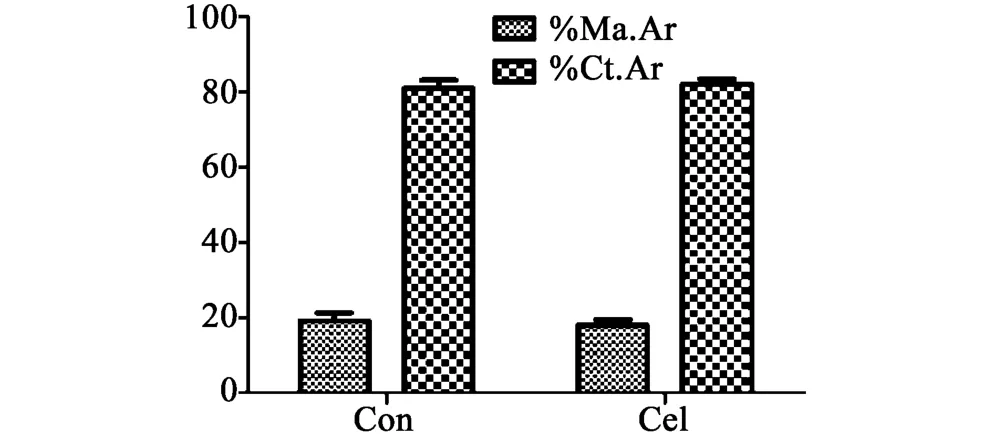
图3 塞来昔布用药8周对大鼠胫骨中段骨骨形态计量学静态数据的影响
塞来昔布组大鼠胫骨中段骨骨组织计量学动态参数荧光周长百分率、矿化沉积率、骨形成率与对照组相比均无显著性差异,结果见表1。
与对照组相比,塞来昔布组及地塞米松组,股骨中Ca、P、Mg含量均无明显改变,结果见图4。
塞来昔布组与对照组相比,弹性载荷和最大载荷无明显改变,骨生物力学参数无显著性差异,结果见图5。
表1 塞来昔布用药8周对大鼠胫骨中段骨骨形态计量学动态数据的影响(±s)

表1 塞来昔布用药8周对大鼠胫骨中段骨骨形态计量学动态数据的影响(±s)
注:L.Pm代表皮质骨外圈骨荧光周长,%L.Pm代表皮质骨外圈骨荧光周长百分率,MAR代表矿化沉积率,BFR代表骨形成率,E-L.Pm代表皮质骨内圈骨荧光周长,E-%L.Pm代表皮质骨内圈骨荧光周长百分率
组别 L.Pm(mm) %L.Pm(%) MAR(μm·d-1)BFR[μm·(d·100)-1]E-L.Pm(mm) E-%L.Pm(%)3 0.34±0.12 9.31±3.34 0.29±0.18 7.57±4.52塞来昔布给药组 4.38±2.56 51.23±30.65 1.02±0.45 40.48±25.0正常对照组 3.52±0.87 40.76±9.57 0.89±0.34 38.51±22.32

图4 塞来昔布用药8周对大鼠股骨骨矿物质含量的影响

图5 塞来昔布用药8周对大鼠股骨三点弯曲力学参数的影响
4 讨论
本研究结果表明,塞来昔布给药8周对大鼠的体重没有明显的影响,与对照组相比无显著性差异。在实验过程中,塞来昔布组大鼠的胃口和行为均未观察到异常。但在股骨骨密度的检测中发现,大鼠股骨骨密度较正常组明显降低,有统计学差异。提示,长期使用塞来昔布会对骨骼产生负面影响。以往有临床数据显示,患者长期使用塞来昔布可能损伤正常的骨骼功能,导致骨密度下降。临床观察与我们的实验结果一致[5]。我们进一步从骨形态计量学方面检测了大鼠皮质骨的静态和动态指标,发现皮质骨骨量并未减少,骨形成的相关指标也与对照组无显著性差异,提示塞来昔布并未抑制骨形成。这与以往一些文献报道一致,虽然本实验与文献报道用的不是相同的模型[6]。然而,同样也有报道显示,Cox-2选择性抑制剂在体内抑制骨转换导致成骨抑制以及对成骨细胞和破骨细胞的功能有潜在的干扰[7,8]。Muller等[9]进一步报道只有一小部分NSAIDs抑制作用可见于成骨分化阶段,据推测,NSAIDs对骨细胞或者骨前体细胞的影响可能是通过抑制前列腺素的合成介导的,因为前列腺素2具有刺激骨形成的作用,针对这个有争议的结果,有报道给出了更好的解释,处在炎症状态还是非炎症状态,塞来昔布对骨形成产生的结果可能不同,Yoon等[10]实验发现NSAIDs对炎症状态和非炎症状态下的骨髓基质干细胞的成骨分化会产生不同的结果,在炎症状态下使用高浓度Cox-2抑制剂,骨髓基质干细胞的成骨分化会受到抑制,而在非炎症状态下则不会。
本实验利用ICP检测股骨中的骨矿物质Ca、P、Mg的含量试图解释骨密度下降,但并未发现股骨中矿物质的显著减少。提示塞来昔布的使用使骨密度降低的原因并不在于骨矿无机物质方面。在本课题组另外进行的塞来昔布使用12周对正常大鼠骨质量的影响实验中,发现塞来昔布组大鼠血清中抗酒石酸酸性磷酸酶明显增高,使用骨形态计量学对大鼠胫骨上段松质骨的破骨细胞分析结果显示(数据未列出),塞来昔布组大鼠骨吸收明显加强,破骨细胞数量增多,破骨细胞周长百分数明显增加。这提示塞来昔布的使用造成骨密度的降低源于破骨细胞活性的增加,骨吸收加强所导致。那么骨密度的降低对大鼠骨生物力学是否会产生显著影响?本实验利用测完骨密度大鼠的左侧股骨以及新分离的第六腰椎椎体,进一步探讨大鼠的骨生物力学参数性能,与对照组相比,大鼠股骨弹性载荷,最大载荷和断裂载荷均未见显著性降低,但腰椎最大压缩载荷有下降趋势。这说明塞来昔布造成的骨密度降低可能是单纯的破骨细胞活性增强,但是骨吸收增强的幅度尚没有实质性改变皮质骨的大小和厚度,且在成骨活动和骨成分并未发生明显退化的情况下,塞来昔布8周的使用,虽然减少了骨密度,但还不足以造成大鼠骨骼明显的力学性能下降。
5 结论
本实验通过采用骨形态计量学,骨密度,骨生物力学,骨矿物质含量等多方面检测表明长期使用高剂量的塞来昔布会引起骨密度的降低,骨折风险增加,但塞来昔布8周的使用尚不足以引起正常大鼠明显的骨量、骨矿物质含量和骨生物力学的降低。
[1]Guler-Yuksel M,Klarenbeek NB,Goekoop-Ruiterman YP,et al.Accelerated hand bone mineral density loss is associated with progressive joint damage in hands and feet in recent-onset rheumatoid arthritis[J].Arthritis Res T-her,2010,12(3):R96.
[2]Kim SY,Schneeweiss S,Liu J,et al.Risk of osteoporotic fracture in a large population-based cohort of patients with rheumatoid arthritis[J].Arthritis Res Ther,2010,12(4):R154.
[3]Vis M,Guler-Yuksel M,Lems WF.Can bone loss in rheumatoid arthritis be prevented?[J].Osteoporos Int 2013,24(10):2541-2553.
[4]Schett G,Teitelbaum SL.Osteoclasts and Arthritis[J].J Bone Miner Res,2009,24(7):1142-1146.
[5]O′Connor JP,Lysz T.Celecoxib,NSAIDs and the skeleton[J].Drugs Today(Barc),2008,44(9):693-709.
[6]Kasukawa Y,Miyakoshi N,Srivastava AK,et all.The selective cyclooxygenase-2 inhibitor celecoxib reduces bone resorption,but not bone formation,in ovariectomized mice in vivo[J].Tohoku JExp Med,2007,211(3):275-283.
[7]Goodman S,Ma T,Trindade M,et al.COX-2 selective NSAID decreases bone ingrowth in vivo[J].J Orthop Res,2002,20(6):1164-1169.
[8]Murnaghan M,Li G,Marsh DR.Nonsteroidal anti-inflammatory drug-induced fracture nonunion:an inhibition of angiogenesis?[J].JBone Joint Surg Am,2006,88(Suppl3):140-147.
[9]Muller M,Raabe O,Addicks K,et al.Effects of nonsteroidal anti-inflammatory drugs on proliferation,differentiation and migration in equinemesenchymal stem cells[J].Cell Biol Int,2011,35(3):235-248.
[10]Yoon DS,Yoo JH,Kim YH,et al.The effects of COX-2 inhibitor during osteogenic differentiation of bonemarrow-derived human mesenchymal stem cells[J].Stem Cells Dev,2010,19(10):1523-1533.
Effects of celecoxib on bone in SD rats
LIU Yan-zhi,CHEN Yan,GAO Xiang,SU Yan-jie,CUILiao
(Guangdong Key Laboratory for Research and Development of Natural Drug,Guangdong Medical College,Zhanjiang 524023,China)
ObjectiveTo determine the effects of celecoxib on bone tissue in SD rats.MethodsSixteen 12-weeks-old female SD ratswere randomly allocated into 2 groups with 8 rats in each group:intact control(saline,daily,oral gavage)and celecoxib(50 mg·kg-1,daily,oral gavage).Ratswere administered by celecoxib for 8 weeks and were weighted weekly.The left femur of the rats was used to scan by DXA forbonemineral density(BMD),determined by three bending test for bonemechanical properties and analyzed by ICP for the content of Ca,P,Mg in the femur.The cortex bone of middle tibiaswere processed for bone histomorphometry analysis.ResultsCelecoxib decreased femur BMD significantly while did not deteriorate cortex bonemass,bone formation and biomechanic properties significantly at a dose of 50 mg·kg-1daily for 8 weeks in rats.ConclusionThe results indicated that celecoxib had impairmenton BMD.Buthad no further deterioration on cortex bonemass,bone formation,bonemineral composition and biomechanic properties.
Celecoxib;RA;Bone tissue;Rat
R965
:A
2095-5375(2014)07-0373-004
国家自然科学基金(No.81273518);广东省科技计划项目(No.2012B060300027);广东医学院青年基金(No.XQ1310)
刘衍志,男,研究方向:骨质疏松的机制及防治,E-mail:liuyanzhi02@163.com
崔燎,女,博士研究生,教授,研究方向:骨质疏松的机制及防治、骨细胞生物学及分化调控、肿瘤药理学,Tel:0759-2388305,E-mail:cuiliao@163.com

