荧光定量PCR检测生鲜猪肉中金黄色葡萄球菌的应用研究
李苗云,惠利娜,赵改名,刘 杰,黄现青,高晓平
(河南农业大学食品科学技术学院,河南省肉制品加工与质量安全控制重点实验室,河南 郑州 450002)
金黄色葡萄球菌是引起细菌性食物中毒的重要病原菌之一[1],肉、蛋、奶等动物性食品极易受其污染[2].当食品遭其污染而又在符合其生长所需的温度、湿度、pH值和营养条件环境下时,细菌增值到一定数量所产生的肠毒素将引发食用者产生恶心、呕吐和下痢等中毒症状,对食品安全造成了严重威胁.我国生鲜肉的消费量大,流通和运输环节包装简单或者不包装,增加了其在运输、储存以及消费过程中受到二次污染的机率.因此,金黄色葡萄球菌成为中国肉品检测过程中重要的检测项目之一.实时荧光定量PCR技术因其敏感度高、特异性强等优点被广泛应用到微生物的检测中[3].金黄色葡萄球菌的nuc基因是金黄色葡萄球菌DNA片段高保守序列[4,5],该基因编码金葡菌耐热核酸酶,具有特异性[6,7].国内外对此进行了大量的研究,苏明权等[8]成功构建了金黄色葡萄球菌重组质粒标准品和金黄色葡萄球菌实时荧光定量PCR方法,该方法主要应用于临床感染诊断及商品检验检疫;张巧艳[9]研究了基于SYBR Green I荧光定量PCR快速检测生乳及乳制品中的沙门氏菌.VINCENZINA等[10]研究发现,基于Tapman的方法比基于SYBR Green 的荧光定量PCR方法灵敏度低,SYBR Green荧光定量PCR能够实现快速、准确、高通量的鉴别原料奶中金黄色葡萄球菌的肠毒素基因.而且HORSON[11]利用SYBR Green荧光定量PCR的方法检测金黄色葡萄球菌的entA基因,指出SYBR Green方法具有操作简单便捷、快速定量、比特异性序列染料标记的探针价格便宜等明显优势.本试验以生鲜猪肉为材料,建立金黄色葡萄球菌的荧光定量PCR方法,与传统平板计数法同时建立生鲜肉中金黄色葡萄球菌生长曲线,探讨荧光定量PCR方法定量检测生鲜肉中金黄色葡萄球菌的应用范围.
1 材料与方法
1.1材料
1.1.1 试验材料 生鲜猪肉(猪背最长肌).
1.1.2 菌株 金黄色葡萄球菌(Staphyloccocusaureus)ASI.1861、沙门氏菌(Salmonella) ASI.1859F3 由双汇技术中心惠赠;大肠杆菌(Escherichiacoli)O157:H7 NCTC12900、单增李斯特菌(L.monocytogenes)ATCC54002、绿脓杆菌(P.aeruginosa)ATCC15442和乙型溶血性链球菌(Betahemolyticstreptococcus)32210-4a由河南省出入境检验检疫局微生物实验室惠赠.
1.1.3 试剂与仪器
1.1.3.1 主要试剂 BP培养基及添加剂(OXOID,英国)、细菌基因组DNA提取试剂盒(上海生物工程有限公司)、SYBRPremix Ex TaqTM PCR试剂盒(Takara公司)、Tris(北京赛博科技有限公司).根据GenBank中金黄色葡萄球菌特异性nuc基因序列以及相关文献[6]报道的该基因序列,Gene ID:1120790,并使用Primer 5.0和Oligo 6软件设计引物,上游引物:5′-GCGATTGATGGTGATACGGTT-3′,下游引物:5′-AGCCAAGCCTTGACGAACTAAAGC-3′,扩增长度279 bp,由Takara生物技术有限公司合成.
1.1.3.2 仪器 ABI 7500荧光定量PCR仪,美国ABI公司;UVP凝胶成像系统,美国UVP公司;Biometra梯度PCR仪,德国Biometra公司;DYY-12型电泳仪,北京六一仪器厂;全自动螺旋接种仪,英国Don Whitley Scientific公司;全自动菌落分析仪,英国Synbiosis公司.
1.2方法
1.2.1 荧光定量PCR检测方法的建立
1.2.1.1 菌株培养 无菌操作,挑取营养琼脂斜面金黄色葡萄球菌标准菌株接种到液体TSB-YE培养基中.37 ℃、180 r·min-1振荡培养过夜后待用.其他5株测试菌株接种到TSB液体培养基中,培养方法同金黄色葡萄球菌.
1.2.1.2 模版DNA的提取 取1 mL菌液,10 000 r·min-1离心1 min,1×TE溶液清洗后,用上海生物工程细菌基因组DNA提取试剂盒,提取金黄葡萄球菌和其他5株测试菌株的基因组核酸.
1.2.1.3 实时荧光定量PCR方法的建立和优化 参照Takara公司SYBR®Premix Ex TaqTM (RNaseH Plus)说明书进行,并对退火温度和引物添加量进行优化.
荧光定量PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,63 ℃退火34 s,共40个循环.用温度梯度PCR仪在59~65 ℃(温度梯度PCR仪自动生成6个温度点)PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,63 ℃退火30 s,72 ℃延伸90 s,共35个循环,72 ℃延伸10 min.PCR扩增后,1.8%普通琼脂糖凝胶电泳,根据电泳条带亮度初步选择最佳退火温度.同时结合相应的融解曲线,筛选出PCR反应的最佳退火温度.
1.2.1.4 特异性试验 对提取的所有细菌基因组DNA分别进行荧光定量PCR试验,其中携带nuc基因的金黄色葡萄球菌作为阳性对照菌株, 其他致病菌作为阴性菌株来检验引物的特异性.荧光定量PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,63 ℃退火34 s,循环40次;在63 ℃退火34 s阶段收集荧光值, 并在上述扩增条件后增加63 ℃至95 ℃的融解曲线分析步骤.
1.2.1.5 灵敏性试验 将金黄色葡萄球菌的菌悬液用无菌生理盐水进行10倍倍比稀释,共做8个稀释度,提取基因组核酸后进行荧光定量PCR扩增,得到明显融解峰的最低浓度即为方法的检出限.同时,分别将稀释的菌液接种于BP培养基上,37 ℃条件下恒温培养18~24 h,用菌落分析仪计数.
1.2.2 荧光定量PCR检测生鲜猪肉中金黄色葡萄球菌
1.2.2.1 样品制备及接种 用无菌生理盐水对培养的菌液进行稀释,制成浓度约为103cfu·mL-1的菌悬液.同时,无菌条件下,去除猪背最长肌表面筋膜,将其分割成大小约25 cm2,厚约2~3 cm的组织块,无菌操作取样品于菌悬液中浸蘸15 s,滤网上静置15~20 min后,用无菌托盘包装,置于20 ℃生化培养箱中进行恒温贮藏.
1.2.2.2 实时荧光定量PCR方法和平板计数方法对肉样的检测对比 每隔8 h按照GB 4789.2—2010方法处理样品,用全自动螺旋接种仪接种菌悬液至BP平板上,平板至于37 ℃培养箱中恒温培养18~24 h,用菌落分析仪计数.同时,参照1.2.1方法对菌悬液提取DNA,进行荧光定量PCR方法检测.用2种方法的数据进行对比分析.
1.3统计分析
生鲜猪肉中金黄色葡萄球菌在20 ℃条件下的生长曲线数据采用Excel 2007进行统计分析.
2 结果与分析
2.1金黄色葡萄球菌荧光定量PCR检测方法的建立
2.1.1 退火温度的优化结果 用梯度PCR仪对退火温度进行(59~65 ℃)优化,扩增产物EB染色后,1.8%琼脂糖凝胶电泳结果如图1所示.由图1可知,PCR产物条带在62.2~63.3 ℃最亮,扩增效率最高,由此初步确定退火温度在63℃左右时较好,然后在荧光定量PCR仪上用标准菌DNA进行验证(图2).
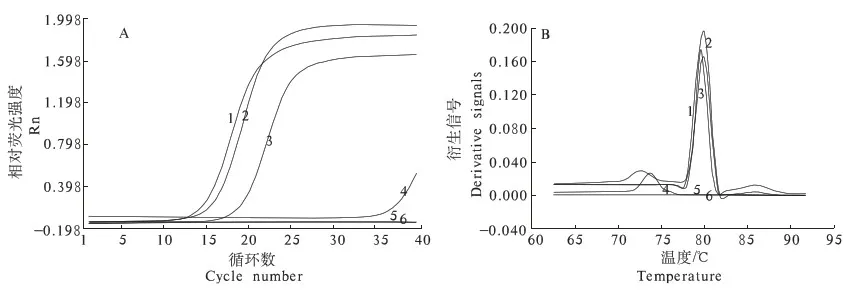
由图2可知,退火温度设为63 ℃时,PCR反应曲线Ct值在15左右,融解温度在79 ℃左右,荧光值的起跳幅度△Rn很显著.由此可以确定退火温度为63 ℃时,PCR扩增效率和特异性都很好,最终选定退火温度为63 ℃.
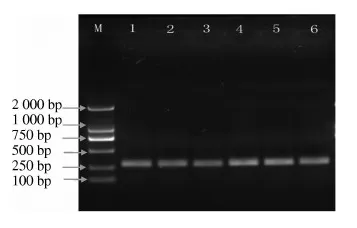
M-Maker(DL2000);1~6.退火温度为59.3,60.2,61.2,62.2,63.3,64.2 ℃
M-Maker(DL2000);1 to 6.annealing temperature :59.3,60.2,61.2,62.2,63.3,64.2 ℃
图1退火温度优化结果
Fig.1Theresultsofoptimizingtheannealingtemperature

A.扩增曲线;B.对应的融解曲线1.退火温度63 ℃; 2.阴性对照
2.1.2 引物浓度的优化结果 由图3可知,随着引物添加量的减少,扩增曲线的Ct值逐渐变大,引物量越高,扩增效率越高.当引物添加1 μL时,其Ct值明显小于2 μL和3 μL(图3-A),但引物添加量为3 μL时阴性对照出现了引物二聚体(图3-B),特异性降低.引物添加2 μL时Ct值和3 μL相比并不大,且特异性良好.综合分析确定最佳引物添加量为2 μL.
2.1.3 特异性结果 由图4可知,阳性标准菌株金黄色葡萄球菌和其他致病菌菌株进行荧光定量PCR扩增,仅金黄色葡萄球菌检测到荧光信号,特异性融解曲线Tm为80 ℃左右,符合融解曲线通常呈现单一峰形的要求[12].其他5株测试菌和阴性对照均为一平直的线,Ct值无法读取,检测结果均为阴性.没有引物二聚体引起的假阳性扩增信号,说明反应体系的特异性强.
2.1.4 灵敏度试验结果 由图5可知,当金黄色葡萄球菌的浓度在2.17×108~2.17×101cfu·mL-1范围时,均有扩增信号出现,当金黄色葡萄球菌梯度稀释至21.7 cfu·mL-1时仍有明显的融解峰.因此该方法的灵敏度为21.7 cfu·mL-1.这与HORSMON[11]报道的检测限在同一水平.同时制备如图6所示的荧光定量PCR标准曲线,在102~108cfu·mL-1范围内呈良好的线性关系,相关系数为0.989.
2.2荧光定量PCR在生鲜猪肉金黄色葡萄球菌中的应用
用平板计数方法和荧光定量PCR方法对20 ℃温度条件下生鲜猪肉中金黄色葡萄球菌的生长特性进行研究发现,2种方法均能形成典型的“S”型生长曲线(图7).将2种结果进行对比,发现微生物初始数量为2.56 log(cfu·g-1),在18 h内2种方法的检测结果重合,为3.12 log(cfu·g-1),在24 h以后进入稳定期,荧光定量PCR检测结果逐渐高于平板计数结果,终点值分别为5.11 log(cfu·g-1),6.64 log(cfu·g-1).当金黄色葡萄球菌繁殖达到最高点进入稳定期和衰亡期,由于猪肉中的蛋白质、脂肪和碳水化合物等营养物质,被逐步分解成一系列的产物如胺、吲哚、硫醇、硫化氢、脂肪酸、甘油、醛、酮等化合物以及各种有机酸,或同时产生醇和CO2气体等[13].猪肉表面有害代谢产物积聚、pH逐渐下降,金黄色葡萄球菌繁殖速度减慢,细胞活性变低,死亡菌数逐渐增加,导致BP平板计数结果在稳定期以后呈现缓慢下降的趋势.但是有研究表明即使在细胞凋亡之后,DNA也不会迅速裂解,在细胞凋亡8 h之后几乎不能观察到DNA裂解,24 h以后DNA裂解才明显[14].因此,DNA的裂解相对于细胞凋亡有一定的滞后性,这可能是在进行荧光定量PCR检测时,其检测细菌数量明显高于平板计数方法的原因.
A.扩增曲线;B.对应的融解曲线 A.The amplification curve;B.Melting curve
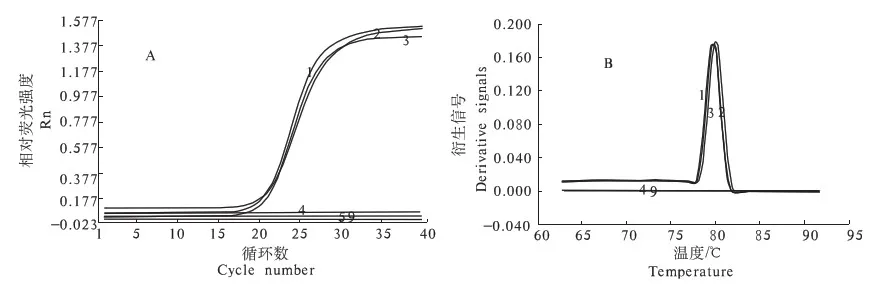
A.扩增曲线;B,对应的融解曲线; 1-3.金黄色葡萄球菌;4.沙门氏菌;5.乙型溶血性链球菌; 6.大肠杆菌O157:H7;7.单增李斯特菌;8.绿脓杆菌;9.阴性对照.
A. The amplification curve;B.Melting curve; 1-3.Staphyloccocusaureus; 4.Salmonella; 5.Betahemolyticstreptococcus; 6.EscherichiacoliO157:H7; 7.L.monocytogenes; 8. P.aeruginos; 9. negative control
图4荧光定量PCR特异性试验
Fig.4Specifictestofthereal-timePCR
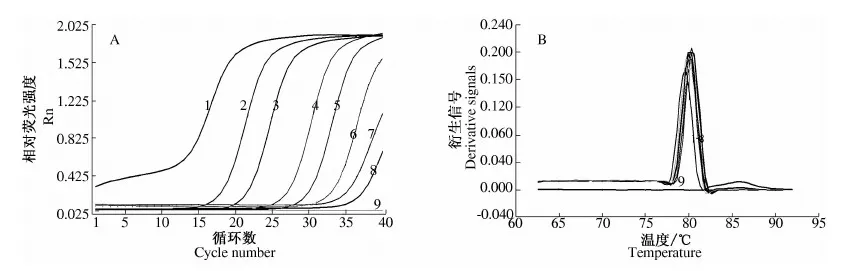
1.均质液中提取的模板DNA;2~8.均质液10倍梯度稀释后提取的模板DNA;9.阴性对照
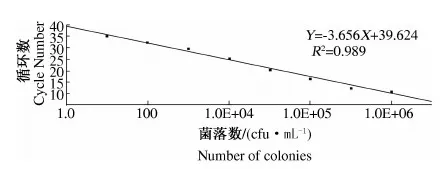
图6 标准曲线
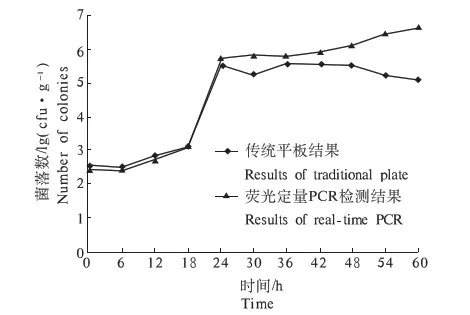
图7 荧光定量PCR与平板计数检测方法建立的20 ℃条件下金黄色葡萄球菌生长曲线
以BP平板和分离鉴定为主的传统检测金黄色葡萄球菌的方法有很多弊端,传统方法费时费力,需要长达6 d的准备时间[15],WILSON等[16]研究指出传统方法不适用于进行大批量的金黄色葡萄球菌的种群鉴定.大量生鲜肉的贮藏试验表明[17,18],低温条件下,生鲜肉腐败时,微生物的生长处于对数末期或稳定前期;高温条件下,生鲜肉腐败时,微生物一般处于对数期.因此,在生鲜肉的正常货架期内,微生物的生长均未达到稳定期.由此可知,在生鲜肉的货架期内,可以用荧光定量PCR方法对微生物进行定量检测,为了避免检测的肉样中菌量较少提取不出模版DNA的问题出现,可适当增加富集培养步骤,保证检测的准确性.荧光定量PCR的方法与传统方法相比,无须分离鉴定,可有效缩短检测时间,提高检测效率.因此,本研究建立的荧光定量PCR的方法,能够对货架期内生鲜肉中金黄色葡萄球菌进行高效定量检测.同时,该方法为生鲜肉中其他致病、致腐微生物的检测提供了理论依据.
3 结论
本研究优化并建立了检测金黄色葡萄球菌的荧光定量PCR的反应体系,为:2×SYBR Premix Ex TaqTM 10 μL,上、下游引物(1 μmol)各2.0 μL,模板为2.0 μL,水4 μL共20 μL;反应条件为:95 ℃预变性30 s;95 ℃变性5 s,63 ℃退火34 s,共40个循环.应用此方法建立生鲜猪肉中金黄色葡萄球菌在20 ℃条件下的生长曲线与传统平板方法的结果对比发现,在生鲜猪肉的货架期内,荧光定量PCR检测技术能够对金黄色葡萄球菌高效进行定量检测.
参考文献:
[1]LE LOIR Y,BARON F,GAUTIER M,et al. Staphylococcus aureus and food poisoning [J]. Genetics and Molecular Research,2003,2(1): 63-76.
[2]WIENEKE A,ROBERTS D,GILBERT R J,et al. Staphylococcal food poisoning in the United Kingdom [J]. Epidemiol Infect,1993,110(3):519-531.
[3]GIBSON U E,HEID C A,WILLIAMS P M,et al. A novel method for real time quantitative RT-PCR [J].Genome Methods,1996,16(10):995-1001.
[4]TORSTEN T,SKURRAY R A,BROWN M H,et al. Identification of suitable internal controls to study expression of a Staphylococcus aureus multidrug resistance system by quantitative real-time PCR [J]. Journal of Microbiological Methods,2007,70(2): 355-362.
[5]BRAKSTAD O G,JOHAN A. Maeland. Generation and characterization of moloclonal antibodies againstStaphylococcusaureuo[J]. A eta Pathol Microbiol Immunoi Scand,1989,97(6):166-174.
[6]BRAKSTAD O G,ASBAK K,MAELAND J A,et al. Detection of Staphylococcus aureus by polymerase chain reaction amplification of theNuc-Gene [J]. J. Clin Microbiol,1992,30(7):1654-1661.
[7]BRAKSTAD O G. Thermostable nuclease and thenucgene in the diagnosis ofStaphylococcusaureusinfections [J]. University of Trondheim Press,1995,24(9):16-17.
[8]苏明权,杨 柳,马越云,等. 实时荧光定量PCR检测金黄色葡萄球菌方法的试验研究[J]. 国际检验医学杂志,2010,31(8):794-796.
[9]张巧艳,陈亭亭,陈笑芸,等. 基于SYBR Green I荧光定量PCR建立生乳及乳制品沙门氏菌快速检测技术[J]. 浙江农业学报,2012,24(5):914-921.
[10]VINCENZINA F,GRAZIA M Q,MARIA M,et al. Rapid and reliable identification ofStaphylococcusaureusharbouring the enterotoxin gene cluster (egc) and quantitative detection in raw milk by real time PCR[J]. International Journal of Food Microbiology,2011 ,144(3):528-537.
[11]HORSOM J R,CAO C J,KHAN A S,et al. Real-time fluorogenic PCR assays for the detection of entA,the gene encodingStaphylococcalenterotoxin A [J]. Biotechnol Lett,2006,28(11):823-829.
[12]高 虹,张 霞,高旗利. 奶粉中阪崎肠杆菌PCR和荧光PCR检测方法的研究[J]. 食品科学,2006,27(9):203-207.
[13]BLIXT Y,BORCH E. Comparison of shelf life of vacuum-packed pork and beef[J]. Meat Science,2002,60(4):371-378.
[14]RUSSELL J. COLLIN S,BRRAIN V,et al. Internucleosomal DNA cleavage should not be the sole criterion for identifying apoptosis [J]. INT.J. RADIAT. BIOL,1992,61(4):451-453.
[15]BUYSER M L,AUDINET N,DELBART M O,et al. Comparison of selective culture media to enumerate coagulase-positiveStaphylococciin cheeses made from raw milk [J]. Food Microbiol,1998,15(3): 339-346.
[16]WILSON I G.,GILMOUR A,COOPER J E,et al. A non-isotopic DNA hybridisation assay for the identification ofStaphylococcusaureusisolated from foods. [J]. Food Microbiol,1994,22(1): 43-54.
[17]HUANG L H. Growth kinetics ofEscherichiacoliO157:H7 in mechanically-tenderized beef [J]. International Journal of Food Microbiology,2010,140(1):40-48.
[18]Li M Y,Niu H M,Zhao G M,et al. Analysis of mathematical models ofPseudomonasspp. growth in pallet-package pork stored at different temperatures [J].Meat Science,2013,93(4): 855-864.

