甘西鼠尾草中丹参二醇B抑制血管新生活性研究
庄文婷, 朱路平, 向 诚, 何 静, 李 鹏, 李宝才*
(1.昆明理工大学 生命科学与技术学院, 云南 昆明 650500; 2.澳门大学 中华医药研究院 中药质量研究国家重点实验室, 澳门 000856)
甘西鼠尾草中丹参二醇B抑制血管新生活性研究
庄文婷1, 朱路平1, 向 诚1, 何 静1, 李 鹏2*, 李宝才1*
(1.昆明理工大学 生命科学与技术学院, 云南 昆明 650500; 2.澳门大学 中华医药研究院 中药质量研究国家重点实验室, 澳门 000856)
目 的 研究 丹 参二醇 B的抑制 血 管新生活 性 。 方法 采用硅胶 柱 色谱和 Sephadex LH-20 柱 色 谱等分离 手 段 从甘西鼠尾草丙酮提取物中分离得到丹参二醇 B, 并通过人脐静脉内皮细胞的生长、 迁移及其促血管生长因子的测定实验来评价丹参二醇B的体外抑制血管新生作用,以鸡胚尿囊膜为体内模型对丹参二醇B抑制血管新生活性进行研究。结果 丹参二醇B对人脐静脉内皮细胞的生长、迁移及其促血管生长因子的分泌、鸡胚尿囊膜血管生成都呈现出剂量依赖型的抑制作用。结论 丹参二醇B具有抑制血管新生活性,可作为潜在的血管新生抑制剂得以开发和应用。
甘西鼠尾草; 丹参二醇B; 内皮细胞; 鸡胚尿囊膜
血管新生是指从已有血管发芽生成新的血管,它是体内一个重要的生理和病理过程,正常情况下,其促进和抑制处于一个动态平衡状态,只发生在胚胎形成、伤口愈合以及妇女生理周期等几个过程[1]。然而, 一 旦 这 种 平 衡 被 打 破, 就 会 伴 随 很多疾病的出现以及免疫系统的紊乱。尤其是当体内存在的血管新生促进因子超过了血管新生抑制因子,平衡就会偏向于新血管的生成,从而可能导致癌症、风湿性关节炎、糖尿病性失明、系统性红斑狼疮等严重 疾 病 的 发 生[2]。 因 此, 从 天 然 植 物 或草药中去寻找具有血管新生抑制功能的活性低分子化合物成为新药研究的一大热点。
丹参二醇 B(tanshindiol B) 为唇形科鼠尾草属弧隔鼠 尾 草 亚 属 植 物 甘 西 鼠 尾 草 Salvia przewalskii Maxim中分离得到的二萜醌类化合物, 其具有抗肿瘤 (A549、 SK-OV-3、 SK-MEL-2、XF498 和 HCT-15)[3], 抗人型结核分支杆菌和缺血后心肌收缩恢复作用[4], 其是否具有抗血管新生活性, 尚未见报道,为此对其进行了初步的药效学研究。
1 材料和方法
1.1 试验材料
1.1.1 试验药材 甘西鼠尾草药材于 2010 年 8 月采自云南省丽江市,由云南省中医中药研究院郭世民研究员鉴定为唇形科植物甘西鼠尾草。样本现存于昆明理工大学生命科学与技术学院天然产物制药实验室。
1.1.2 细 胞 株 及 鸡 胚 人 脐 静 脉 内 皮 细 胞 株(HUVEC) 购 自 于 ScienCell Research Laboratories,试验用鸡胚购于昆明云岭广大种禽饲料有限公司。
1.1.3 试验仪器 BRUKER AM-400MHz超导核磁共振仪; AutoSpec Premier P776 双 聚 焦 三 扇 型 磁 质谱仪; Agilent1200 高效液相色谱仪; Sephadex LH-20(20 ~ 100 μm,Pharmacia Fine Chemical Co., Ltd.); MCI gel CHP20P(75 ~ 150 μm,Mitsubishi Chemical Co.,Ltd.); Rp-18(40 ~ 50 μm, Merk Co.,Ltd); 柱 层 析 硅 胶 (200 ~ 300 目)、薄层层析硅胶 (GF254) 均为青岛海洋化工厂产品; 酶标仪 (Corona Co.Ltd,Ibaraki,Janpan); 移液枪 (SelectPette) 、 CO2培 养 箱 (Thermo)、 倒 置显微镜 (江南)、 96 孔板、 6 孔板。
1.1.4 试验试药 84 消毒液、 新洁尔灭消毒液、75%乙醇消毒液、 生理盐水、地塞米松注射液(云南白药集团)、 PBS 缓冲液、 甲醇 (分析纯)、丙酮 (分析纯)、 ECM1001 培养基 ( 购自 ScienCell Research Laboratories)、 heat-inactivated FCS(购 自GIBCO公司)、P/S( 购 自 GBICO公 司)、amphotericin-B(购自 GIBCO公司)、 heparin( 购 自 上 海浩然生物有 限公 司)、 gelatin( 购 自 Sigma公 司)、噻唑蓝 (MTT)( 购自 Sigma公司)、 DMSO(购自Sigma公司)、 VEGF ELISA 试 剂 盒 ( 购 自 Invitrogen,Camarillo,CA)。
1.2 试验方法
1.2.1 样品制备 干燥甘西鼠尾草 (全草) 药材7.3 kg, 粉碎 后 过 60 目 筛, 用 100%丙 酮 (每 次20 L) 室温下 超 声 提 取 3 次, 每 次 2 h, 提 取 液 减压浓缩得粗浸膏 300 g。 所得浸膏经硅胶柱 色谱石油醚-乙酸乙酯梯度 (1 ∶0、9 ∶1、 3 ∶1、1 ∶1、3 ∶7) 洗 脱,TLC检 测 合 并 得 5 个 部 分 Fr.1 ~Fr.5。 Fr.3(52 g) 经 MCI柱 层 析 MeOH-H2O (65%、 75%、 85%) 梯度洗脱,75%MeOH-H2O洗脱部分经硅胶柱层析, 石油醚-乙酸乙酯梯度(10 ∶1、5 ∶1、2 ∶1) 洗脱, 其中石油醚-乙酸乙酯 (10 ∶1) 洗脱液中有红色针状结晶析出, 吸除母液, 将所 得红 色 结 晶 经 Sephadex LH-20 柱 色 谱纯化得到单体化合物 32 mg。
1.2.2 细胞培养 人脐带静脉细胞 (HUVEC) 培养基采用添加了 10% 胎牛血清 (FCS),1% 内皮细胞生长因子 (ECGS),1% 肝素钠,1%P/S 的ECM1001 培养 基, 将人脐静 脉 内 皮细胞放置 于37 ℃,5%CO2的培养箱中进行常规培养, 隔天更换培养基, 细胞密度长至 70%后每天更换培养基直至细胞密度长至 90%, 进行传代操作, 确保细胞处于良好生长状态。
1.2.3 噻唑蓝 (MTT) 实验 取对数期生长的HUVEC细胞, 制成一定浓度的细胞悬液, 以每孔3 000 个细胞的密度, 将细胞接种于 96 孔板中, 将96 孔板置于 37 ℃,5%CO2的培养箱中进行常规培养24 h,24 h 后观察 细 胞生长状态, 细胞生长正常的情况下, 将 96 孔板上的细胞分组, 每组 8 个复 孔, 将 含 有 不 同 质 量 浓 度 (0.5、 1.0、 2.5、5.0、10.0 μg/mL) 丹 参二醇 B( 丹参二醇 B用DMSO配制, 加入细胞培养基中的 DMSO终浓度小于 0.1%) 的培养基 180 μL加入各实验组细胞中,以地塞米松 (5.0 μg/mL) 作为阳性对照, 空白对照组中每孔加入等量常规培养基。 给药后在37℃, 5%CO2的培养箱中继续进行常规培养72 h, 然后每 孔 加 入 10 μL MTT(5 mg/m L),37 ℃,5% CO2的培养箱中孵育 4 h 后, 将 96 孔 板 中 的 上 清液小心移除, 每孔加入 150 μLDMSO, 振荡 10min后, 在酶标仪 490 nm下读取吸光度。
1.2.4 细胞迁移实验 取对数期生长的人脐静脉内皮细胞,制成一定密度的细胞悬液,以每孔5.5 ×105个细胞的密度将 HUVEC细胞接种于 6 孔板中, 将 6 孔板置于 37 ℃,5%CO2的培养箱中进行常规 培 养24 h,24 h 后观察细胞 生 长情况, 待细胞在6孔板底部生长形成一层无间隙的单细胞层时, 将上清液完全移除, 用 PBS 清洗细胞表面两次, 用200 μL的枪头在细胞层上竖直划一道痕,显微镜下拍照, 加入含有质量浓度为 5.0 μg/mL丹参二醇 B的 培 养 基 2.5 m L, 空 白 对 照 组 中 每 孔加入等量常规培养基。将 6孔板置于 37 ℃,5% CO2的培养箱中进行常规培养24 h, 完全移除上清液, 显微 镜 下 拍 照。 用 Image Pro Plus(IPP,version5.1,Media Cybernetics) 图 像 分 析 软 件 对 给 药前后的照片进行图像分析,进行后续数据处理。
1.2.5 酶联免疫吸附剂测定 (ELISA) 实验 通过 ELISA实验, 检测 HUVEC细胞培养基中血管内皮生长因子 (VEGF) 的密度, 取对数期生长的HUVEC细胞, 制成一定密度的细胞悬液, 以每孔2.0 ×105个细胞的密度将 HUVEC细胞接种于 6 孔板中, 将 6 孔板置于 37 ℃,5%CO2的培养箱中进行常规培养24 h, 细胞生长正常的情况下, 移除培养 基, 加 入 含 有 质 量 浓 度 分 别 为 2.5、 5.0、10.0 μg/mL丹参二醇 B的 培养基 2.5 mL, 以地塞米松 (1 mg/m L) 作 为 阳性对照, 空 白对照组 中 每孔加入等量常规培养基, 然后将6孔板置于37 ℃, 5%CO2的培养箱中进 行常规 培养 72 h, 收 集细胞培养基, 放 入离心机中 离 心 1 min(1 000 r/min),收集上清液, 用人 VEGF酶联免疫试剂盒对细胞培养基中的 VEGF进行定量分析。
1.2.6 鸡胚尿囊膜实验 采用鸡胚尿囊膜做为体内模型来测试丹参二醇B对血管新生的影响。取新鲜种鸡蛋在温度为 37.8 ℃,5%CO2, 湿度适宜的条件下 孵 育 7 d, 在 气室 端 开 窗 (1 cm×1 cm),用直径为6 mm的无菌滤纸片作为给药载体,实验组在滤纸片上滴加用无水乙醇将丹参二醇B配制成 5.0、 10.0 mg/L两种质量浓度的药液各 20 μL,在超净台中将无水乙醇挥干,放置于尿囊膜上,然后在无菌滤纸片上滴加20 μL生理盐水。空白组在滤纸片上加 20 μL无水乙醇, 在超净台中将无水乙醇挥干,放置于尿囊膜上,然后在无菌滤纸片上滴加20 μL生理盐水。 阳性对照药组 (地塞米松组)在滤纸片上加20 μL无水乙醇, 在超净台中将无水乙醇挥干,放置于尿囊膜上,然后在滤纸片上滴加20 μL地塞米松。 每组用 8 只鸡胚, 完成给药操作后,用无菌透明胶带封窗,在上述条件下继续孵育72 h, 向给药部位滴加固定液 (甲醇-丙酮 =1 ∶1)对血管做固定处理 15 min, 取下尿囊膜组织, 对尿囊膜组织表面血管用数码相机微距拍照, 用 Image Pro Plus(IPP,version 5.1,Media Cybernetics) 图像分析软件对图片中血管面积进行计算[5]。
1.2.7 数据处理 CAM血管面积计数通过 IPP软件计算得到,根据血管颜色与尿囊膜组织颜色的区别, 利用 IPP软件滤镜处理技术, 增强颜色对比,通过采集图像上的不同色彩点数来计算得到血管面积; 得到的血管面积数据用 SPSS 数据处理软件处理, 得到t检验数据。
2 结果与分析
2.1 化 合 物结构鉴定 根据化合 物 的 理 化 性质、1H-NMR、13C-NMR以 及 质 谱 数 据, 对 照 文 献[6], 鉴定化合物为丹参二醇 B, 其化学结构如图1所示。
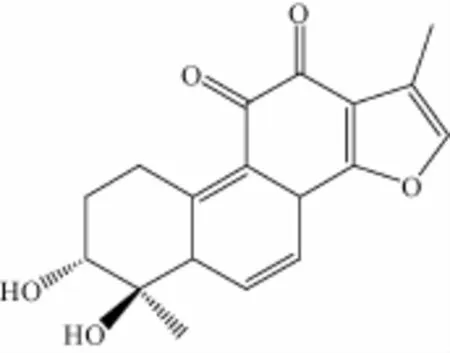
图1 丹参二醇B的结构Fig.1 Chem ical structu re of tanshindiol B
丹参 二 醇 B 红 色 粉 末 ( 吡 啶),C18H16O5, ESI-MS m/z:313 [ M+H]+;1H-NMR(400 MHz, C5D5N) δ:2.14(2H,m,H-1),3.35(2H,m,H-2),3.98(1H,dd,J=4.4,2.9 Hz,H-3),8.03 (1H,d,J=8 Hz,H-6),7.66(1H,d,J=8 Hz, H-7),7.44(1H,s,H-16),1.50(3H,s,Me-17), 2.27(3H,s,Me-18);13C-NMR(100 MHz, C5D5N) δ:28.5(C-1),28.1(C-2),73.8(C-3), 74.3(C-4),142.3(C-5),133.9(C-6),121.1 (C-7),128.7(C-8),126.5(C-9),150.1(C-10),183.4(C-11),175.9(C-12),120.9(C-13), 161.3(C-14),120.6(C-15),142.2(C-16),8.86 (C-17),25.5(C-18)。
2.2 噻唑蓝 (MTT) 实验结果 MTT实验结果显示, 丹参二醇B在一定质量浓度下具有抑制HUVEC细胞增殖的活性,如图2所示,丹参二醇B质量浓度为 0.5、 1.0、 2.5、 5.0、 10.0 μg/mL时,HUVEC细胞 的 增 殖 抑 制 率 分 别 为 -2.01%、 6.01%、17.10%、 63.77%、 83.4%, 阳性组细胞增殖抑制率为 58.09%, 实验结果显示当丹参二醇 B质量浓度为 5.0 μg/mL时, 其抑制细胞增殖效果与阳性药效果相近, 说明丹参二醇 B有抑制 HUVEC增殖的作用。
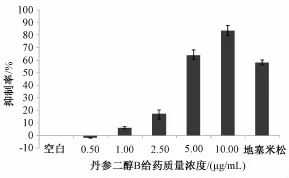
图2 不同质量浓度的丹参二醇 B对 HUVEC增殖抑制率影响Fig.2 Affect of tanshindiol B on the proliferation inhibition ratio of HUVEC
2.3 细胞迁移实验 实验采用细胞划痕的方法测试丹参二醇 B对HUVEC细胞迁移能力的影响, 丹参二醇 B质量浓度为 5.0 μg/mL, 作用 HUVEC细胞24 h后, 细胞迁移率为 (10.7 ±2.5)%, 空白组中细胞迁移率为 30.2% ±1.32%, 实验结果显示,丹参二醇B有明显抑制细胞迁移的作用。
2.4 酶 联 免 疫 吸 附 剂 测 定 ( enzyme-linked immunosorbent assay ELISA) 实 验 HUVEC细 胞 培 养 基中 VEGF的浓度采用 ELISA的方法测定。 丹参二醇B 3 个质量浓 度 实验组的吸 光 度 值 分 别 (0.416 ± 0.09)、 (0.230 ±0.06)、 (0.112 ±0.07), 空白组吸光度值为 (0.496 ±0.05), 阳性对照组吸光度值为 (0.225 ±0.4), 根 据 实 验 所 得 标 准 曲 线(Y=519.1 X2-98.86 X+39.86,R2=0.996; X代表吸光度,Y代表 VEGF质量浓度), 可以计算出,丹参二醇 B给药质量浓度分别为 2.5、 5.0、 10.0 μg/mL时, 细胞培养基中 VEGF的质量浓度分别为 886.0、 446.1、 353.3 pg/mL, 空 白 组 中 VEGF质量浓度 为 1 185.6 pg/m L, 阳 性 对 照 组 中 VEGF质量浓度为 439.6 pg/mL, 实验结果显示, 随着丹参二醇B质量浓度的增加, 培养基中VEGF的质量浓度明显下降, 当丹参二醇 B质 量浓度达到 5.0 μg/mL时, 培养基中 VEGF的质量浓度与阳性对照组培养基中 VEGF的质量浓度相当, 却远低于空白对照组,说明丹参二醇B在一定质量浓度下具有抑制 HUVEC细胞培养基中 VEGF的水平。 见表1。
表1 不同质量浓度的丹参二醇 B对 HUVEC分泌 VEGF的影响 (n=3,)Tab.1 Affect of tanshindiol B on the expression of VEGF on HUVEC(n=3,x±)
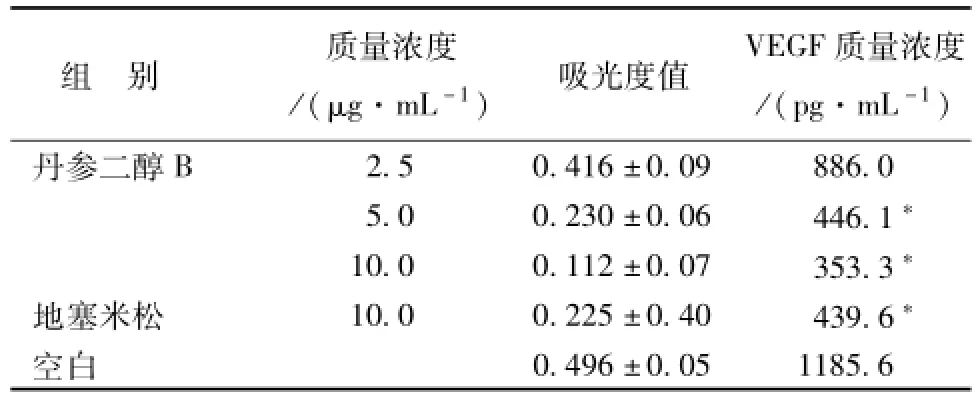
表1 不同质量浓度的丹参二醇 B对 HUVEC分泌 VEGF的影响 (n=3,)Tab.1 Affect of tanshindiol B on the expression of VEGF on HUVEC(n=3,x±)
注: 与空白对照组比较,*P<0.005
组 别 质量浓度/(μg.mL-1) 吸光度值 VEGF质量浓度/(pg.mL-1)丹参二醇B 2.5 0.416 ±0.09 886.0 5.0 0.230 ±0.06 446.1*10.0 0.112 ±0.07 353.3*地塞米松 10.0 0.225 ±0.40 439.6*空白0.496 ±0.05 1185.6
2.5 鸡胚尿囊膜实验结果 采用鸡胚尿囊膜实验对丹参二醇B对体内血管新生的影响进行实验研究, 实验结果如图4、 表2所示, 丹参二醇 B剂量为 100 ng/蛋时, 尿囊膜 血管生长稀疏, 血管有明显断裂,与空白组相比,其血管新生抑制率为67.9%, 丹参二醇 B剂量为 200 ng/蛋时, 尿囊膜血管几乎不生长,给药区域周边血管稀疏,与空白组相比, 其血管新生抑制率为 72.0%, 此时, 丹参二醇B对尿囊膜血管新生的抑制作用与阳性对照药效果相当,由此得出结论:丹参二醇B在一定剂量下可以显著抑制鸡胚尿囊膜血管新生。
3 讨论
体内血管异常新生能够导致癌症、风湿性关节炎、糖尿病性失明、系统性红斑狼疮等严重疾病的发生,尤其与癌症的发生有着密切的联系,因为毛细血管在为肿瘤细胞提供必要的营养物质以及运输肿瘤细胞 代 谢 产 物 方 面 扮 演 着 重 要 的 角 色[7-8], 因此,血管新生抑制剂成为治疗癌症的一种新策略[9-10]。 例如, 美国 Genentech 公司历时 10 年研发的抗癌药物 Avanstin 就是一个血管新生抑制剂。 然而, 目前已上市的和正在进行 I-IV期临床的血管新生抑制剂主要 是 抗 体 药 物[11], 抗 体 虽 然 具 有 定位准确的优点,但是必须采用静脉注射的方式给药,相比之下生产成本低、价格便宜、可口服的低分子药物理所当然地应受到医疗一线的欢迎。近年来,许多学者也致力于从植物中寻找能够调控血管新生的药物。
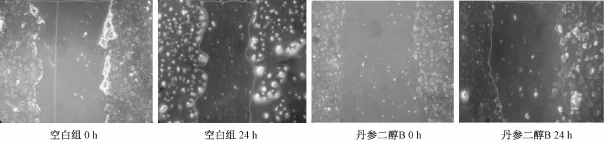
图3 丹参二醇 B对 HUVEC细胞迁移能力的影响Fig.3 A ffect of tanshindiol B on them igration ability of HUVEC
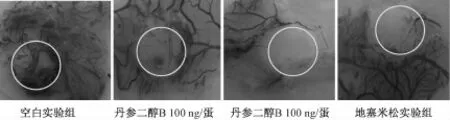
图4 丹参二醇 B的 CAM标本Fig.4 Picture specimens of CAM with tanshindiol B
表2 丹参二醇 B对鸡胚尿囊膜血管生长的抑制作用 (n= 8,)Tab.2 Inhibition of vascular grow th on CAM by tanshindiol B(n=8,)
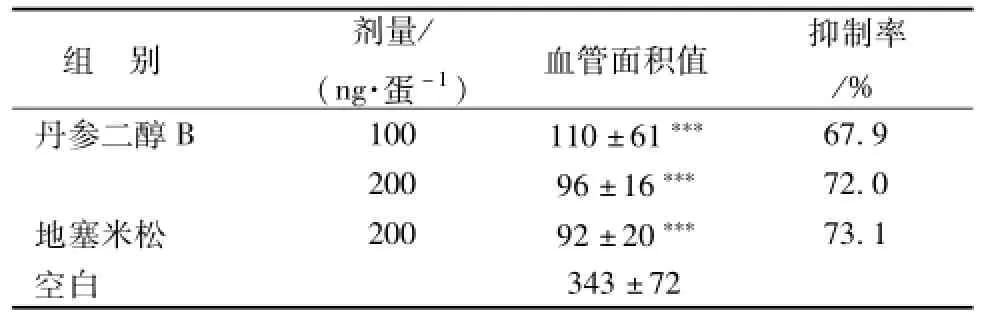
表2 丹参二醇 B对鸡胚尿囊膜血管生长的抑制作用 (n= 8,)Tab.2 Inhibition of vascular grow th on CAM by tanshindiol B(n=8,)
注: 与空白对照组比较,***P<0.001
组 别 剂量/ (ng.蛋-1) 血管面积值 抑制率/%丹参二醇 B 100 110 ±61***67.9 200 96 ±16*** 72.0地塞米松 200 92 ±20*** 73.1空白343 ±72
本研究中丹参二醇B从甘西鼠尾草中首次分离得到, 并分别利用人脐静脉内皮细胞 (HUVEC)和鸡胚尿囊膜 (CAM) 两个体外和体内模型, 对其抑制血管新生活性进行了研究,结果发现丹参二醇 B对 HUVEC的增殖、迁移以及分泌促血管生长因子 (VEGF) 的能力都有较好的抑制作用, 同时在CAM模型上也表现出一定的抑制血管新生活性,这些研究结果对其成为潜在的血管新生抑制剂,并进一步开发利用提供了一定的理论依据。但是其构效关系和作用机理还有待于做进一步深入研究,以为其成为临床强效血管新生抑制剂提供前期基础。
[1] 王培利,雷 燕,陈可冀, 等.血管新生—治疗心血管病的新策略[J].中国中西医结合杂志,2006,26(2):173-176.
[ 2 ] 金惠铭, 李先涛.血管新生的调控[J].中国微循环,2001, 5(2):85-88.
[ 3 ] Shi Y R,Chong O L,Sang Uch.In vitro cytotoxicity of tanshinones from Salvia miltiorrhiza[ J] .Planta Med,1997,63(4): 339-342.
[4] 刘艾林,李铭源,王一涛,等.丹参药理活性物质基础研究现状[J].中国药学杂志,2007,42(9):641-644.
[ 5 ] Hayek A,Beattie G M,Lopez A D,et al.The use of digital image processing to quantitate angiogenesis induced by basic fibroblast growth factor and transplanted pancreatic islets[J] .Microvasc Res,1991,41(2):203-209.
[ 6 ] Luo H W,Wu B J,Yong Z G,et al.Pigments from Salvia miltiorrhiza[ J] .Phytochemistry,1985,24(4):815-817.
[7] 吴江雪,徐本玲,黄文林.血管生成抑制因子研究进展[J].癌症,2005,24(3):376-384.
[ 8 ] Kamphaus G D,Colorado P C,Panka D J,et al.Canstatin,a novelmatrix-derived inhibitor of angiogenesis and tumor growth[J] .JBiol Chem,2000,275(1):1209-1215.
[ 9 ] 颜延东, 赵启仁.肿瘤新生血管生成抑制剂-肿瘤抑素的研究进展[J].中华医学研究杂志,2006,6(9):1003-1005.
[10 ] Folkman J.New perspectives in clinicaloncology from angiogenesis research[ J].Eur JCancer,1996,32(14):2534-2539.
[11 ] Kiselyov A,Balakin K V,Tkachenko SE.VEGF/VEGFR signalling as a target for inhibiting angiogenesis[ J] .Expert Opin Investig Drugs,2007,16(1):83-107.
Tanshindiol B from Salvia przewalskii inhibits angiogenic activity
ZHUANGWen-ting1, ZHU Lu-ping1, XIANG Cheng1, HE Jing1, LIPeng2*, LIBao-cai1*
(1.Faculty of Life Science and Technology,Kunming University of Scienceand Technology,Kunming 650500,China; 2.State Key Laboratory of Quality Research in Chinese Medicine,Institute of Chinese Medical Sciences,University of Macau,Macau 000856,China)
AIM To study the effect of tanshindiol B from Salvia przewalskii Maxim.on angiogenic activity. METHOD Tanshindiol Bwas isolated from acetonic extractof S.przewalskii and purified by the silica gel column and Sephadex LH-20 column chromatography.MTTmethod was employed to explore the effect of tanshindiol B on themigration and the expression of human umbilical vein endothelial cells(HUVEC)and tomeasure the vascularendothelial growth factor(VEGF)level.The chicken chorioallantoicmembrane(CAM)modelwas used for in vivo inhibition of angiogenic activity.RESULTS Tanshindiol B could inhibit the proliferation and migration of HUVEC,angiogenesis on CAM,and the secrete of VEGF in a dose-dependentmanner.CONCLUSION Tanshindiol B possesses the anti-angiogenic activity,so it can be a promising candidate for angiogenesis inhibitors.
Salvia przewalskii Maxim; tanshindiol B; human umbilical vein endothelial cells(HUVEC);chicken chorioallantoic membrane(CAM)
R966
:A
:1001-1528(2014)06-1146-05
10.3969/j.issn.1001-1528.2014.06.008
2013-04-15
国家自然科学基金资助项目 (30960042); 云南省应用基础研究计划 (2009ZC047M)
庄文婷 (1988—), 女, 硕士生, 研究方向: 中药化学成分活性研究。 Tel:(0871)65920738,E-mail:zhuangwenting617@ 163.com
*通 信作 者: 李 鹏 (1978—), 男, 助理 教授, 博士, 研 究 方 向: 中 药 活 性 评 价 及 质 量 控 制。 Tel:15363569526,E-mail:pli1978@ hotmail.com李宝才 (1957—), 男, 教授, 博士, 研究方向: 天然产物医药开发。 Tel:15912531421,E-mail:baocaili@hotmail.com

