山药多糖提取工艺优化及其抗菌活性研究
于 莲, 张俊婷, 马淑霞, 张 涛, 孟德欣
(1.佳木斯大学药学院,黑龙江省高校重点实验室, 黑龙江 佳木斯 154007; 2.佳木斯大学基础医学院,黑龙江 佳木斯 154007)
山药多糖提取工艺优化及其抗菌活性研究
于 莲1, 张俊婷1, 马淑霞2, 张 涛2, 孟德欣2
(1.佳木斯大学药学院,黑龙江省高校重点实验室, 黑龙江 佳木斯 154007; 2.佳木斯大学基础医学院,黑龙江 佳木斯 154007)
目的 优化山药多糖的提取工艺,并对其进行抗菌活性研究。方法 以提取时间、超声波功率、提取温度为自变量,山药多糖得率为因变量,利用响应面法优化山药多糖的提取工艺。并采用纸片法对山药多糖进行抗菌活性研究。 结果 山药多糖的最佳提取工艺为提取时间 108.14min, 超声波功率 414.66W, 提取温度 80.54 ℃, 山药多糖理论提取率为 3.21%, 验证值为 3.154%。 抗菌实验表明, 山药多糖对金黄色葡萄球菌、 大肠杆菌、 枯草芽孢杆菌、 白色念珠菌属于中敏感,对肠炎沙门氏菌属于低敏感。结论 采用星点设计-响应面法优化山药多糖的提取工艺方法简便,预测性好,合理可行。
山药多糖;提取;响应面法;抗菌活性
山 药 Dioscorea opposita Thunb.又 名 薯 蓣 、 延章、玉延等,为薯蓣科薯蓣属多年生宿根蔓草植物的干燥块茎[1]。 现代医学 研 究 认为 山 药 的药 理 活性主要成 分是山 药多糖 (Yam polysaccharide)。提取山药多糖的方法主要有水溶液提取法、纤维素酶法、 微博 辅 助 法、 超 声 辅 助 提 取 法[2]。 超 声 辅 助提取具有增加多糖提取率,节约能源等优点,因此本实验采用星点设计-响应面法[3-4]对超声波提取山药多糖的工艺进行优化,建立多糖提取条件与提取率之间的模型,以期得到最优的工艺,提高多糖得率。
目前国内外对山药多糖的研究有很多,有报道山药多糖具有免疫调节、抗肿瘤、抗衰老、抗突变、 抗氧化等 作 用[5]。 但 关 于 山 药 多 糖 的 抗 菌 作用研究尚少,因此,本实验采用纸片法对山药多糖抗菌活性进行研究,为进一步研究山药多糖奠定基础。
1 材料
FW177 粉碎机 (天津市 泰斯特仪器有限公司); UV-757 紫外分光光度仪 (上海市棱光精密科学仪器有限公司); KQ3200DV型数控超声波清洗器 (昆山市超声波仪器有限公司); F-A2004 电子分析天平 (上海恒平科学仪器有限公司); LXBIIB低速大 容 量 多 管 离 心 机 ( 上 海 安 亭 科 学 仪 器厂); LS—C50L立式压力蒸汽灭菌器 (江阴滨江医疗设备有限公司); DNR—300 电热恒温培养箱(金坛市瑞华仪器有限公司); ZHJH-C1214B垂直流超净工作台 (上海智诚分析仪器制造有限公司)。
山药饮片 (安国市祁奥中药饮片有限公司,由佳木斯大学药学院刘娟教授 鉴定为怀 山 药 Dioscorea opposita Thunb; 枯 草 芽 孢 杆 菌 ( 北 京 北 纳创联生物技术研究院, 批号 CMCC63501); 金黄色葡萄球菌、白色念珠菌、大肠杆菌、肠炎沙门菌(佳木斯大学基础医学院提供)。
葡萄糖标准品 (中国食品药品检定研究院,纯度 99.5%, 批号 110833-201205); 营养琼 脂、牛肉膏、 蛋白胨均为生物试剂; 95%乙醇、 无水乙醇、丙酮、乙醚、苯酚、硫酸,均为分析纯试剂。
2 方法与结果
2.1 提取路线 山药粉末→95%乙醇回流脱脂→滤渣按1 ∶20 料液比加入蒸馏水→超声波提取两次→离心→上清液合并浓缩→95%乙醇沉淀,4℃过夜→离心→干燥后即得山药多糖[6-8]。
2.2 多糖含量测定 以葡萄糖为标准品, 蒸馏水配 制 成 0.016、 0.024、 0.032、 0.040、 0.048 mg/mL的标准溶液, 以标准品质量浓度为横坐标,吸光度值为 纵坐标, 采 用苯酚-硫酸法[9]绘制标准曲线。 制 得 的 标 准 曲 线 方 程 为:A=17.050C-0.044 0,r=0.999 3(n=5), 对 照 品 溶 液 在0.016 ~0.048 mg/L之 间线性 关系良 好。 精密称取山药粗多 糖 10 mg于 100 mL量 瓶 中, 苯酚-硫 酸 法于490 nm处测定其吸光度, 代入葡萄糖标准曲线得山药多糖样品浓度,根据公式计算得山药多糖样品含量。

C—样品葡萄糖质量浓度 (mg/mL),D—样品溶液稀释倍数,f—换算因子 (0.9),W—供试品质量。山药多糖样品多糖含有量为 35.2%。
2.3 单因素实验 以山药多糖提取率为指标, 采用单因素实验研究提取温度、超声波功率、提取时间三个因素对山药多糖提取率的影响。
2.3.1 提取时间对多糖提取率的影响 确定超声功率400W, 提取温度为 80 ℃, 提取时间分别为40、 60、 80、 100、 120、 140 min 进行实验, 以 粗多糖提取率为指标,不同提取时间对山药粗多糖提取率的影响见图1。 由图1可知, 山药粗多糖提取率随提取时间的增加而增加,当提取时间超过到100 min 时, 提取率呈下降趋势。
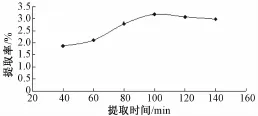
图1 提取时间对山药粗多糖提取率的影响Fig.1 Effects of extraction time on extraction yield of polysccharide from yam
2.3.2 超声波功率对多糖提取率的影响 确定提取 温 度 为 80 ℃, 分 别 以 100、 200、 300、 400、500 W 为超声功 率 进 行实验, 提 取时间为 100 min,以粗多糖提取率为指标,不同提取功率对山药粗多糖提取率的影响见图2。 由图 2可知, 当超声波功率达到 400 W 时, 山 药 粗 多 糖 提 取 率 呈 最 大 值,因此, 确定最佳超声波功率为 400 W。
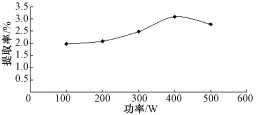
图2 超声波功率对山药粗多糖提取率的影响Fig.2 Effects of ultrasonic power on extraction yield of polysaccharide from yam
2.3.3 提取温度对多糖提取率的影响 确定提取功率为400W, 提取温度分别为 40、 50、 60、 70、80、 90 ℃, 提取时间为 100min 进行实验, 以粗多糖提取率为指标,不同提取温度对山药粗多糖提取率的影响见图3。 由图3可知, 提取温度对山药粗多糖提取率的影响较大,随着提取温度的升高,山药粗多糖提取率也随着增加, 确定提取温度80℃为佳。
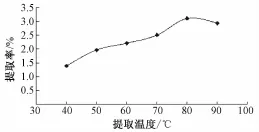
图3 提取温度对山药粗多糖提取率的影响Fig.3 Effects of extraction temperature on extraction yield of polysaccharide from yam
2.4 星点实验对山药多糖提取条件优化
2.4.1 模型的建立与分析 在单因素实验的基础上采用响应面法对山药多糖的提取工艺进行优化,得到山药多糖的最佳提取工艺及最大提取率。以提取温度、超声波功率、提取时间为因变量,多糖提取率为指标, 应用 Design-Expert 8.0.5 软件, 采用Central composite design(CCD) 进行实 验 设 计 。 因素水平表见表1。响应面分析方案及实验结果见表2。 响应面方差分析结果见表3。
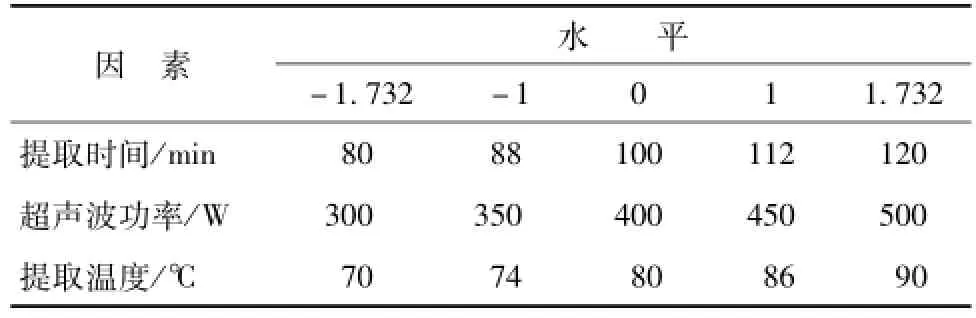
表1 星点实验因素水平Tab.1 Factors and levels
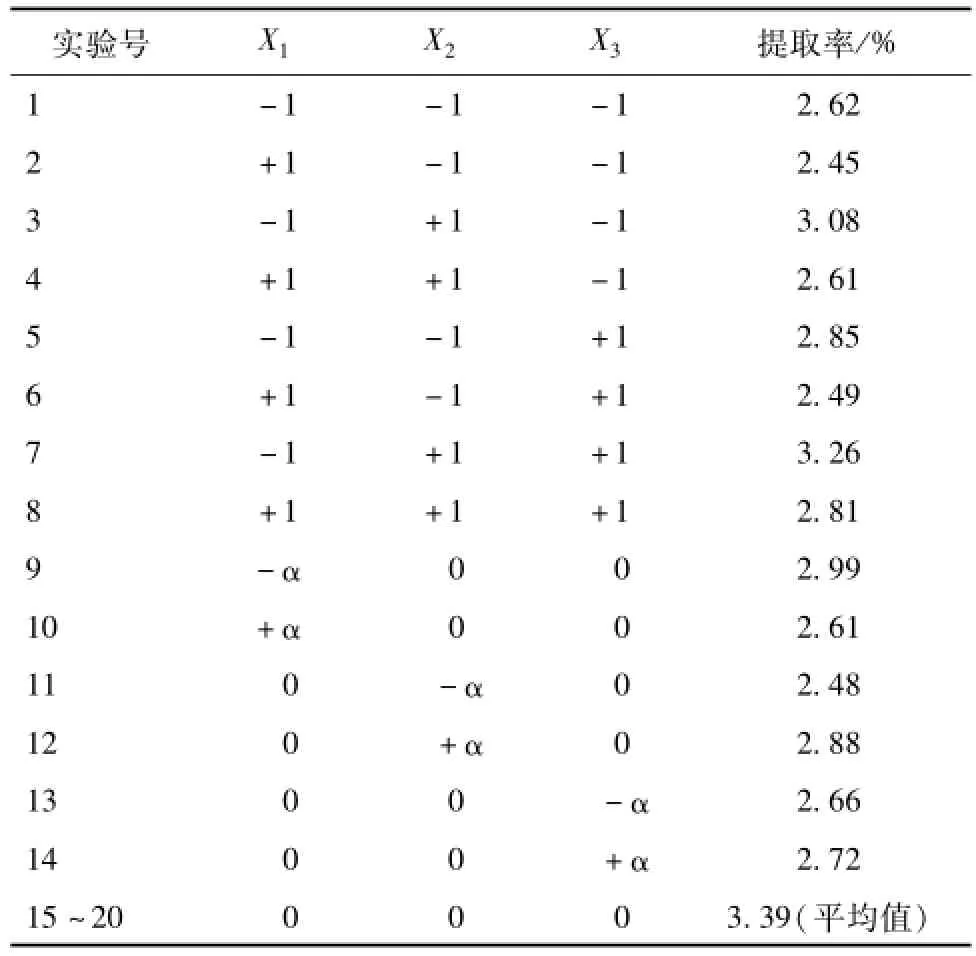
表2 响应面分析实验方案及实验结果Tab.2 Experimeatal design and resu lts
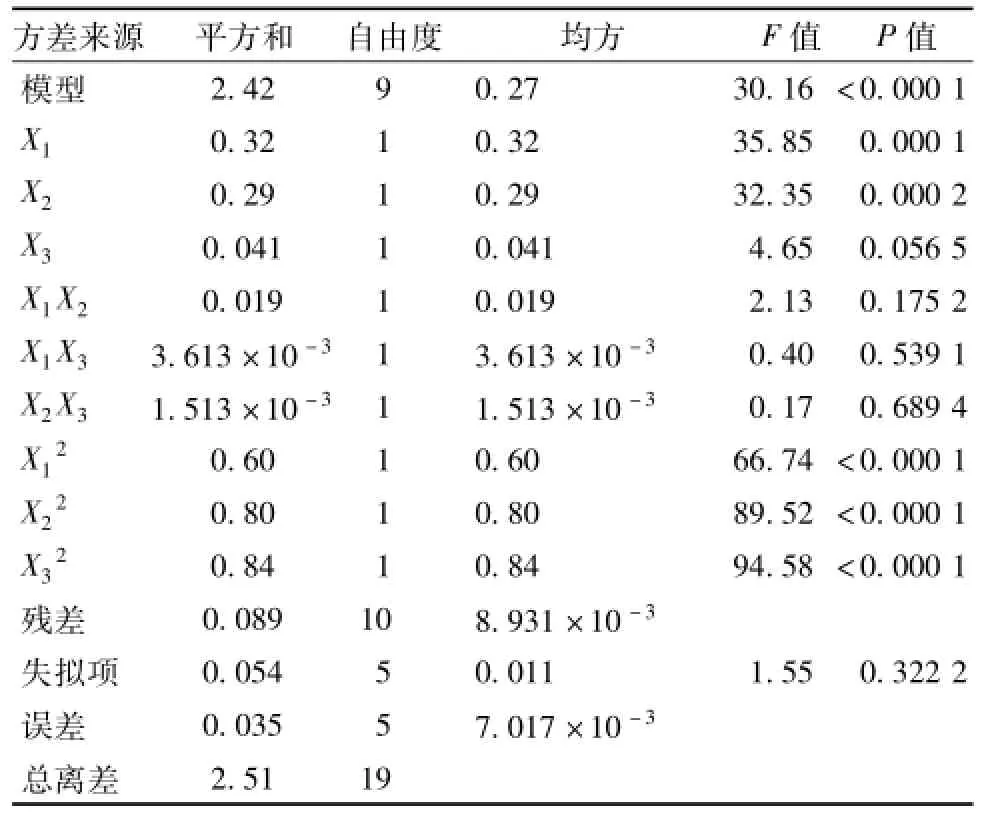
表3 响应面方差分析Tab.3 Analysis of variance for the response sur face
由表3 可知, 实验模型 F值为 30.16,P值小于0.000 1, 表示该模型显著。 由模型拟合的回归方程为:Y=3.39-0.15X1+0.13X2+0.055X3-0.049X1X2-0.021X1X3+0.014X2X3-0.21X21-0.18X22-0.25X23,R2=0.964 5。 P<0.05 的 项 代 表显著项,说明具体实验因子对响应值的影响不是简单的线性关系。由此得到的最佳提取工艺为:提取时间 108.14min, 超声波 功 率 414.66 W, 提取 温 度80.54 ℃, 山药多糖提取率最大预测值为 3.21%。不同因素对山药多糖提取率影响的响应曲面图见图4 ~6。
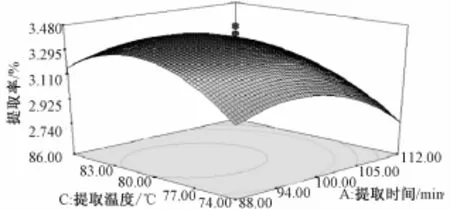
图4 提取时间和提取温度对山药粗多糖提取率影响的响应曲面图Fig.4 Effects of extraction time and extraction temperature on extraction yield of polysaccharide from yam
2.4.2 最优条件验证 按照软件分析得到的最佳提取工艺: 提取时间 108 min, 超声波功 率 400W, 提取温度80 ℃, 进行提取实验五次, 结果见表 4。 最佳提取工艺验证结果为 3.154%, 实测值与预测值的偏差为 1.74%, 结果比较理想。

图5 提取时间和超声波功率对山药粗多糖提取率影响的响应曲面图Fig.5 Effects of extraction timeand ultrasonic power on extraction yield of polysaccharide from yam
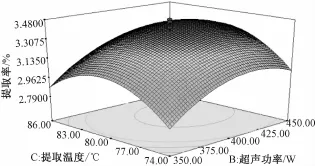
图6 提取温度和超声波功率对山药粗多糖提取率影响的响应曲面图Fig.6 Effects of extraction temperature and ultrasonic power on extraction yield of polysaccharide from yam
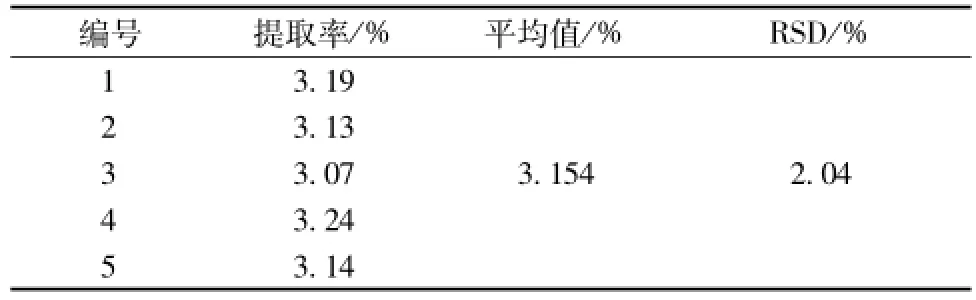
表4 验证实验结果Tab.4 Results of experimental verification
2.5 提取次数对山药多糖提取率的影响 按照星点实验确定的最佳提取工艺, 提取时间 108 min, 超 声波功率 400W, 提取温度 80 ℃, 以粗多糖得率为指标考察提取次数 (1次、2次、 3次、 4次) 对粗多糖得率的影响, 结果见图7。 由图7可知, 当提取次数为2次时,山药粗多糖提取率为最高,随着提取次数增加山药粗多糖提取率无明显变化,因此实验确定提取次数为2次。
2.6 抗菌实验
2.6.1 菌悬液的制备 将 5 种供试菌接种在营养肉汤中,37 ℃ 培 养 24 h(白 色 念 珠 菌 需 26 ℃ 培 养48 h), 调整菌悬液浓度为 106个/mL~107个/mL,备用。
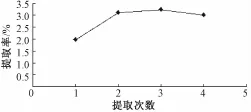
图7 提取次数对山药粗多糖提取率的影响Fig.7 Effects of extraction times on extraction yield of polysaccharide from yam
2.6.2 抗菌活性测定 将实验制得的山药多糖经TCA法除 蛋 白[10-11]、 H2O2法 除 色 素[12]、 透 析 袋 除小分子后配制成 40 mg/mL的 溶液, 备 用。 在 超 净工作台上,分别将培养好的5种菌悬液倒入灭菌后的营养琼脂中,混匀后倒入灭菌的培养皿中,待琼脂凝固后,用灭菌的小镊子分别夹取蘸有多糖溶液的滤纸片,置于培养皿中,以灭菌蒸馏水为空白,依据各菌种培养条件,置于恒温培养箱中培养,每个 浓 度 重 复 5 次[13-14]。 测 定 抑 菌 圈 直 径, 结 果 见表5。

表5 山药多糖抑菌圈直径 (mm)Tab.5 Antilacterial activity of pulysaccharile from yam
抑菌圈实验判定标准: 抑菌圈直径大于 20 mm, 极敏感; 15 ~20 mm, 高 敏 感 ;10 ~15 mm,中敏 感; 7 ~9 mm, 低 敏 感; 小 于 7 mm, 不 敏感[15]。由表 5 可知, 山药多糖对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、白色念珠菌属于中敏感,对肠炎沙门氏菌属于低敏感。
3 讨论
超声波可在液体中产生空化作用,而空化作用产生的冲击波和射流可破坏植物细胞核细胞膜结构,从而增加细胞内容物通过细胞膜的穿透力和传输能力[16]。 超声波法提取多糖较传统热水法节约时间,并降低了提取温度,可减少高温对多糖的影响。
星点设计是国内外近年来常用的优化提取工艺的方法,具有精密度高,预测性好等优点。但由于实验次数过多,少数实验提取率与理论提取率稍有不同,因此需要重复实验以达到预期值。本实验在单因素基础上, 采用星点设计-响应面法优化了超声波法提取山药多糖的工艺,山药多糖提取率预测值为 3.21%, 验证实验结果为 3.154%, 实 测值与预测值的偏差为1.74%, 表明此方法预测性好。
抗菌实验结果表明,山药多糖对金黄色葡萄球菌、大肠杆菌、白色念珠菌、枯草芽孢杆菌均有一定的抑菌效果,对肠炎沙门氏菌的抑菌效果不明显。此研究为开发天然抑菌药物资源提供了理论依据,但还需对其他致病菌的抑菌效果做进一步研究,同时,笔者还将对山药多糖的组成及其结构进行更深一步的研究。
[ 1 ] 张 林.山药多糖的提取、 纯化技术研究进 展[J].齐鲁药事,2011,30(10):606-607.
[ 2 ] 官 波, 郑文诚.山 药多糖提取工艺的优化 [J].食品与机械,2010,26(1):98-101.
[ 3 ] Wen Lingrong,Lin Lianzhu,You Lijun,et al.Ultrasound-assited extraction and structural identification of polysaccharides from Isodon lophanthoides var.geratdianus(Bentham)H. Hara[ J] .Carbohydrate Polymers,2011,85(3):541-547.
[ 4 ] Qiao Deliang,Hu Bing,Gan Dan,et al.Extraction optimized by using response surfacemethodology,purification and preliminary characterization of polysaccharides from Hyriopsis cumingii[J] .Carbohydrate Polymers,2009,76(3):422-429.
[ 5 ] 姜 军, 顾 林.山药多糖的分离纯化及其组成研究[J].食品科学,2007,28(9):158-161.
[6] 高娟娟,梁安慧,阳 敏,等.超声波对杏鲍菇多糖提取率影响试验[J].食用菌,2005,27(6):49-50.
[7] 王 珲,陈 平,江 亮.超声波辅助技术在香菇柄多糖提取 中 的 应 用 研 究 [ J].武 汉 工 业 学 院 学 报,2008,27 (1):15-17.
[ 8 ] Xie Jianhua,Shen Mingyue,Xie mingyong,et al.Ultrasonicassisted extraction,antimicrobial and antioxidant activities of Cyclocarya paliurus(Batal.)Iljinskaja polysaccharides[ J]. Carbohydrate Polymers,2012,89(1):177-184.
[ 9 ] 夏永刚, 梁 军, 匡海 学, 等.苯酚-硫 酸法 测定麻 黄多糖含量研究[J].中医药信息,2011,28(1):33-35.
[10] 刘志刚, 颜仁梁, 罗佳波.白花蛇舌草多糖除蛋白工艺研究[J].中华中医药学刊,2008,26(10):2283-2284.
[11] 万 琴, 萧 伟, 王振中, 等.女贞子多糖除蛋白工艺的研究 [ J] .中草 药,2010,41(3):407-450.
[12] 汪鹏荣, 陈文静, 韦 凤, 等.红曲多糖的过氧化氢法脱色工艺研究[J].浙江师范大学学报,2012,35(2): 203-208.
[13] 张海艳, 郑 玲.马齿笕多糖的提取及体外抗菌活性[ J].江苏农业科学,2011,39(5):413-415.
[14] 苏育才.芒萁多糖提取及抗菌活性初步研究[J].亚热带植物科学,2005,34(2):43-45.
[15] 姚以才, 耿中华, 李 超.芦根多糖的超声波辅助提取及其抗菌活性[J].食品科学,2011,32(14):147-151.
[16] 秦俊哲, 陈 明, 陈 合, 等.食药用真菌多糖的研究现状与 展望 [ J] .中国 食用菌,2004,23(2):6-9.
Optim ization of polysaccharide extraction from yam and its antibiotic activity
YU Lian1, ZHANG Jun-ting1, MA Shu-xia2, ZHANG Tao2, MENG De-xin2
(1.Key University Labaratory of Heilongjiang Province,School of Pharmaceutical Sciences,Jiamusi University,Jiamusi 154007,China; 2.School of Basic Medical Science,Jiamusi University,Jiamusi154007,China)
polysaccharide from yam; extraction; response surface; antibiotic activity
R284.2
:A
:1001-1528(2014)06-1194-05
10.3969/j.issn.1001-1528.2014.06.018
2013-10-18
国家自然基金项目 (81274101)
于 莲 (1961—), 女, 教授, 从事靶向制剂和中药微生态制剂研究。 Tel:(0454)8610166,Email:jdyulian@163.com

