上海市三株H9N2鸭禽流感病毒全基因遗传进化分析
葛菲菲,刘 健,杨德全,鞠厚斌,葛 杰,周锦萍
(上海市动物疫病预防控制中心,上海 201103)
上海市三株H9N2鸭禽流感病毒全基因遗传进化分析
葛菲菲,刘 健,杨德全,鞠厚斌,葛 杰,周锦萍
(上海市动物疫病预防控制中心,上海 201103)
为了解上海市鸭群中H9N2亚型禽流感病毒(Avian influenza virus,AIV)的遗传变异特征,以及与疫苗株A/Chicken/Shan dong/6/1996和A/Chicken/Shanghai/F/1998之间的遗传距离,对2007年和2009年分离自上海市鸭气管和泄殖腔样品采用荧光RT-PCR检测,将H9亚型禽流感病毒核酸阳性样品处理后,经鸡胚尿囊腔接种分离病毒,HI进一步确定血凝素( haemagglutin,HA)亚型,随后进行了全基因测序,并结合GenBank中的相关序列进行遗传进化分析。结果表明:3株分离毒株为H9N2亚型鸭禽流感病毒,HA蛋白裂解位点的氨基酸组成为PARSSRGLF,符合低致病性禽流感病毒特征,均属于经典的H9N2 Ck/Bei群系;NA基因均属于Y280系;NP、PA基因和A/Goose/Guangdong/1/1996(H5亚型)归为一群;PB2和M基因属于Qa/HK/G1/97系;NS基因仍为Ck/Bei系;2007年的分离株和2009年的分离株在PB1基因上分属不同亚群。3株病毒的HA1基因与疫苗株A/Chicken/Shandong/6/1996和A/Chicken/Shanghai/F/1998 之间的遗传距离均大于7%。由此可见,3株鸭H9N2亚型毒株可能是由不同禽流感病毒基因亚群间发生自然重排的产物,现有疫苗对分离株的保护性需要进一步评估。
H9N2亚型禽流感病毒;遗传进化分析;遗传距离
禽流感(avian influenza,AI)是一种由A型禽流感病毒(Avian influenza virus,AIV)引起的禽类烈性传染病,其病原属于正黏病毒科、流感病毒属。H9N2亚型AIV为低致病性禽流感病毒,不仅在全世界范围的禽类中广泛流行,而且可以感染人。在鸭群中H9亚型AIV很少引起发病,但水禽尤其鸭是流感病毒的贮存库,对AIV的发生及传播起到了非常重要的作用。H9N2亚型AIV可经污染的飞沫、尘埃、饲料等传播,传播速度快、范围广。各种日龄混养的禽场一旦受污染,不容易将其根除,疫情隐患长期存在。各品种鸭及鹅均可感染H9N2亚型AIV,但在鸭中以雏番鸭发病率、病死率最高[1]。各种日龄水禽均可感染发病,但临床上以10~15日龄多发,其呼吸道症状较重,使用一般慢性呼吸道病的药物治疗对呼吸道症状无效。病程长为14~30 d,无死亡高峰期,多呈平缓性死亡,死亡率为2%~20%。在以鸭为主的水禽或野禽发生H9N2亚型禽流感后,多数不出现临床症状,成为带毒宿主,长期带毒和排毒,在H9N2亚型AIV传播中起到很重要的作用[2]。最新研究证明,H9N2亚型AIV在家禽中短期传播后,可突变成致病性高的病毒。发生H9N2亚型禽流感疫情的种(蛋)鸭、种鹅主要表现为产蛋异常,极易继发或并发感染细菌性疾病、寄生虫病或其他病毒性疾病等,并且致使这些疫病病死率明显升高。无论圈养还是散养,单一饲养还是混养,肉鸭(鹅)、蛋鸭、种鸭(鹅)几乎均有发病、死亡情况,只是发病率、病死率高低不同而已。因此,对分离自鸭的H9N2亚型AIV进行基因进化分析,评估目前使用的H9N2禽流感疫苗株对其保护效率,不仅在病毒学、兽医学上有重要的学术意义,同时也具有十分重要的公共卫生学意义。
1 材料与方法
1.1 病毒和鸡胚A/Duck/Shanghai/C60/2007、A/Duck/Shanghai/C163/2009和A/Duck/Shang hai/C164/2009分别由本实验室于2007年和2009年从上海市的健康鸭群中分离、鉴定;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;H9荧光RT- PCR试剂盒由深圳匹基生物工程股份有限公司提供;新城疫阳性血清和禽流感血凝素分型血清(H5、H9)由哈尔滨兽医研究所提供;病毒核酸提取试剂盒为QIAamp Viral RNA Mini Kit;AMV反转录酶等试剂均购自宝生物(大连)工程公司;特异引物由宝生物(大连)工程公司合成。
1.2 病毒的初步鉴定首先对鸭气管和泄殖腔棉拭样品用H9荧光RT-PCR试剂盒进行检测,将阳性样品处理后接种鸡胚尿囊腔,分离毒尿囊液应用β-微量法进行HA试验,以检测其血凝性及HA效价。根据测得的HA效价,将分离毒尿囊液配制成4单位的溶液,用新城疫病毒阳性血清、AIV H5和H9阳性血清进行HI试验,详细步骤按照GB/T 18936-2003 高致病性禽流感诊断技术。
1.3 基因片段的cDNA克隆、鉴定和测序根据GenBank上已发表的序列,对8个基因片段进行了引物的设计及合成,用病毒RNA提取试剂盒提取病毒基因组RNA,具体步骤按照说明书进行。RT-PCR产物电泳经凝胶回收后,按pMD18-T载体说明书进行连接、转化,用EcoR I和Hind III进行双酶切鉴定;鉴定为阳性克隆后送上海桑尼生物科技有限公司测序。
1.4 基因cDNA核苷酸序列及推导的氨基酸序列分析比较借助DNAStar4.0分析软件,通过Jotun Hein方法分析比较所得序列的同源性以及一些关键位点的变化情况。
1.5 绘制系统发育树借助MEGA3.1分析软件,确定这3个毒株8个基因的遗传分类情况。
2 结果
2.1 病毒的初步鉴定结果A/Duck/Shanghai/C60/2007、A/Duck/Shang hai/C163/2009和A/Duck/Shanghai/C164/2009感染的鸡胚尿囊液血凝性能够被H9型AIV阳性血清所抑制,而不能被H5型AIV阳性血清和新城疫阳性血清所抑制,表明这3株病毒均为H9亚型。
2.2 一些关键位点的分析通过对NA基因的测序表明A/Duck/Shanghai/C60/2007、A/Duck/Shanghai/C163/2009和A/Duck/Shanghai/C164/2009均为H9N2亚型。这3株鸭H9N2亚型AIV的全基因序列在GenBank的登录号为KC768039~KC768062。3株H9N2亚型AIV HA和NA基因片段与参考株最高同源性比较详见表1。通过对裂解位点的分析表明,这3株鸭H9N2 AIV均为低致病性禽流感。其226位均为Leu,表明有向哺乳动物感染的趋势。HA基因关键位点的分析详见表2。

表1 3株H9N2亚型鸭禽流感病毒HA和NA基因片段与参考株最高同源性比较Table 1 Genetic homology of HA and NA gene from the three H9N2 subtyte Avian influenza virus isolates in Shanghai from the ducks with related sequences available in GenBank

表2 3株H9N2亚型禽流感病毒HA基因几个关键位点的比较Table 2 Comparison of several key sites of HA gene from three H9N2 subtpe Avian infl uenza virus isolates
2.3 绘制系统发育树借助MEGA3.1分析软件,建立这3株H9N2亚型AIV的HA和NA基因进化树(图1)。这3株H9N2亚型AIV的HA均属于Ck/Bei (A/Chicken/Beijing/1/1994)系,与疫苗株A/Chicken/Shandong/6/1996和A/Chicken于同一个系,但是与这2株疫苗株之间的遗传距离均大于7.0%。通常认为,当流感病毒HA1亚单位遗传距离超过7.0%时,就需要更新相应的疫苗毒株[3]。这3株H9N2亚型AIV的NA基因与这2株疫苗株也均属280/1997)系。

图1 上海市3株鸭H9N2亚型禽流感病毒的HA和NA基因进化树Fig.1 Phylogenetic trees of the HA and NA genes of three H9N2 AIV isolates from the ducks in Shanghai
2.4 三株分离株的内部基因片段的遗传衍化关系对这3株分离株的内部基因片段进行了基因进化分析(图略),这3株鸭H9N2流感病毒的基因分型情况如表3所示。2007年分离的1株H9N2毒株其PB1基因与Ck/Bei同属一个基因群,而2009年分离的2株H9N2毒株其PB1基因与Gs/GD(A/Goose/Guangdong/1/1996)同属一个基因群,其余基因片段均在同一个基因群中。
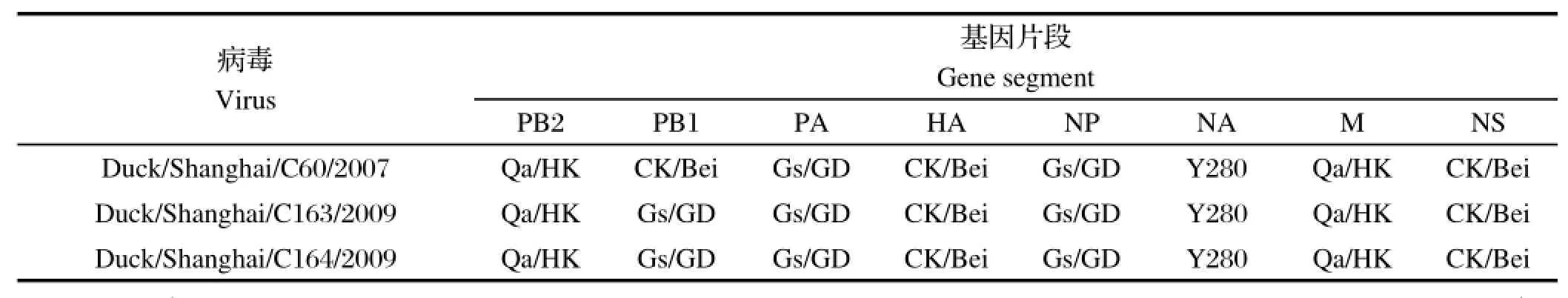
表3 3株H9N2亚型禽流感病毒分离株的基因分型Table 3 The genotypes of three H9N2 subtype Avian infl uenza virus islates
3 讨论
由于哺乳动物(包括人类)与家禽接触的机会较多,特别是农村以及家禽养殖场,这使流感病毒在人、家禽、猪体之间循环,加之2003年香港发生H9N2亚型AIV感染人的疫情,对人类直接构成威胁,使得人们对H9N2亚型禽流感的公共卫生学意义愈来愈重视。研究发现,H9N2亚型AIV在鸭体内复制和排毒的时间可达30 d[4]。水禽一直被认为是A型流感病毒的基因库[5-7]。跨种间传播常常由水禽传播到陆生禽类或哺乳动物,例如猪、马甚至人类。这些跨种间传播在自然界中建立了非常复杂的生态学系统。鸭、鹅等水禽不仅可通过间接方式将H9N2亚型AIV传播给人,而且还能够作为AIV变异、重组的混合器。由于在水禽体内几乎都可分离到H9N2亚型AIV,这些病毒可能在水禽体内与其他亚型发生重组,改变其抗原和宿主特异性,很可能产生对人高感染力的流感病毒,给人类健康带来危害。流感病毒基因流向通常被认为是从水禽向别的动物种类,这个观点阻碍了我们对整个流感生态系统的理解。2000年至2001年从中国南方的家鸭中分离到的H9N2流感病毒,对它们抗原性和基因分析表明:20世纪90年代在鸡和鹌鹑中建立的H9N2流感病毒基因型已经又返回到家鸭中,和鸭中已存在的流感病毒杂交产生了二重体或三重体[8],研究表明在陆地禽和水禽之间发生着双向传播,这些重组体进一步向其他宿主跨种间传播也会随之发生。
本研究中2007年分离的鸭H9N2毒株PB1基因与Ck/Bei同属一个基因群,而2009年分离的2株鸭毒株PB1基因与Gs/GD同属一个基因群,表明H9N2病毒与其他亚型毒株已发生了重组。根据对受体结合位点的分析,本研究中的3株鸭H9N2流感病毒重组体有向人类感染的嗜性[9,10],通过对裂解位点的分析表明,这3株鸭H9N2病毒均为低致病性禽流感。低致病性禽流感更容易广泛传播,易于获得感染人或有助于人之间传播的基因片段[11],这样的情形会增加新型流感大流行的风险。通过计算与疫苗株之间的遗传距离,提示现有疫苗对分离毒株的保护效果值得进一步研究。本文对鸭H9N2流感病毒分子遗传规律等方面研究,也为鸭源H9N2亚型禽流感疫情的防制提供了理论和试验依据。
[1] 林秋敏. 麻鸭H9N2亚型禽流感病毒生物学特性研究[D].福州: 福建农林大学,2011.
[2] Halvorson D A,Frame D D,Friendshuh A J,et al.Outbreaks of low pathogenicity avian influenza in USA[C]//Slemons R D. Proceedings of the 4th International Symposium on Avian Influenza,held May 29-31,1997. US Animal Health Association,Georgia Center for Continuing education,the university of Georgia,Athens: 36-46.
[3] Wang Q,Tao Y J. Influenza: molecular virology[M]. Norwich: Caister Academic Press,2010.
[4] Scholtissek C,Muller K. Temperature sensitive mutants of fowl plague virus (influenza A) generated by undiluted passages at 33 degrees[J]. J Gen Virol,1983,64(Pt12): 2621-2629.
[5] Alexander D J. Ecology of avian influenza in domestic birds[M]//Eurotext J L. Emergence and control of zoonotic ortho- and paramyxovirus diseases. John Libbey Eurotext,Paris,France. 2001.
[6] Rohm C,Zhou N,Suss J,et al. Characterization of a novel influenza hemagglutinin,H15: criteria for determination of influenza A subtypes[J]. Virology,1996,217(2): 508-516.
[7] Webster R G,Bean W J,Gorman O T,et al. Evolution and ecology of influenza A viruses[J]. Microbiol Rev,1992,56(1): 152-179.
[8] Li K S,Xu K M,Peiris J S,et al. Characterization of H9 subtype influenza viruses from the ducks of southern China: a candidate for the next influenza pandemic in humans?[J]. Virology,2003,77(12): 6988-6994.
[9] Ha Y,Stevens D J,Skehel J J,et al. X-ray structures of H5 avian and H9 swine influenza virus hemagglutinins bound to avian and human receptor analogs[J]. Proc Natl Acad Sci U S A,2001,98 (20): 11181-11186.
[10] Matrosovich M N,Krauss S,Webster R G. H9N2 influenza A viruses from poultry in Asia have human virus-like receptor specificity[J]. Virology,2001,281(2): 156-162.
[11] Scholtissek C,Bürger H,Kistner O,et al. The nucleoprotein as a possible major factor in determining host specificity of influenza H3N2 viruses[J]. Virology,1985,147(2): 287-294.
PHYLOGENETIC ANALYSIS OF THREE H9N2 SUBTYPE AVIAN INFLUENZA VIRUS ISOLATES FROM DUCKS IN SHANGHAI
GE Fei-fei,LIU Jian,YANG De-quan,JU Hou-bin,GE Jie,ZHOU Jin-ping
(Shanghai Animal Disease Control Center ,Shanghai 201103,China)
To explore genetic variation of fi eld isolates of H9N2 subtype Avian infl uenza virus (AIV) and their genetic relationship with the vaccine strains (A/Chicken/Shandong/6/1996 and A/Chicken/Shanghai/F/1998),oropharyngeal and cloacal samples were collected from ducks in Shanghai in 2007 and 2009. These samples were tested for H9 subtype AIV in Real-time RT-PCR and then positive samples were inoculated into 10-day-old SPF chicken eggs for virus isolation. Three AIV isolates were obtained,one from the sample collected in 2007 and two from the samples collected in 2009. These three isolates were further identifi ed in HI test. As a result,three isolates were all AIV H9N2 subtype. Subsequently,cDNAs of eight gene segments of these isolates were amplifi ed in RT-PCR and sequenced for phylogenetical analysis as compared with the relevant sequences from GenBank. All three isolates were grouped into low pathogenic AIV as the cleavage site of their haemagglutinin (HA) was PARSSRGLF. Sequencing results showed that the three isolates belonged to the Ck/Bei sublineage based on HA and NS genes or to the same clade with A/Duck/Y280/1997 based on their NA genes. Additional phylogenetic analysis of their NP and PA genes revealed that they were in the same evolutionary branch with A/Goose/Guangdong/1/1996(H5 subtype) while PB2 and M genes belonged to Qa/HK/G1/97 lineage. However,the genetic origin of PB1 gene from the isolate of 2007 was different from two isolates of 2009. The genetic distances between these three isolates and the vaccine viruses (A/Chicken/Shandong/6/1996 and A/Chicken/Shanghai/F/1998) were more than 7%. The results from the present study suggested that these three duck H9N2 subtype isolates might have emerged through natural gene reassortment among AIVs with different sublineages.
H9N2 subtype Avian infl uenza virus; phylogenetic analysis; genetic distances
S852.659.5
A
1674-6422(2014)05-0015-06
2014-03-07
上海市科技兴农重点攻关项目(2007(3-4));上海市科委生物医药重大专项(09DZ1906602)
葛菲菲,女,博士,主要从事分子生物学检测与病毒基因变异研究
周锦萍,E-mail:shzjpvet @163.com

