猪圆环病毒2 型Cap蛋白表达及免疫原性鉴定
朱 鹏,张小飞,徐延伟,尹秀凤
(1.安徽农业大学动物科技学院,合肥 230036;2.南京天邦生物科技有限公司 生物技术研究所,南京 211102)
猪圆环病毒2 型Cap蛋白表达及免疫原性鉴定
朱 鹏1,2,张小飞2,徐延伟2,尹秀凤2
(1.安徽农业大学动物科技学院,合肥 230036;2.南京天邦生物科技有限公司 生物技术研究所,南京 211102)
以猪圆环病毒2型 (Porcine circovirus type 2,PCV2) WH 株基因组 DNA 为模板,扩增 ORF2 截短基因,经BamH I /Not I 双酶切处理后与经相同酶切处理的 pET32a (+) 原核表达载体连接,获得重组质粒 pET32a-Cap2。将重组质粒转化至 BL21(DE3),经IPTG诱导,对表达产物进行 SDS-PAGE 和 Western blot分析。纯化的重组蛋白免疫小鼠,并对获得的血清进行间接 ELISA检测和中和活性测定。SDS-PAGE分析表明,ORF2 截短基因在大肠杆菌中得到表达,蛋白分子质量大小为40 kDa,重组 PCV2 Cap 蛋白主要以上清的形式存在。Western blot证实重组蛋白能够识别抗 PCV2 阳性血清。经间接ELISA 检测,鼠抗PCV2 Cap 血清抗体效价能达到1:25 600,间接免疫荧光检测分析表明,鼠抗PCV2 Cap血清能特异性识别PCV2感染细胞中的Cap蛋白。病毒血清中和实验证实,抗PCV2 Cap血清抗体具有中和病毒的活性,中和效价为1:36。猪圆环病毒2型 Cap 蛋白的表达,为进一步研究该蛋白的功能及Cap 蛋白亚单位疫苗和检测试剂盒的制备奠定了基础。
猪圆环病毒2型 ;Cap 蛋白;免疫原性;中和活性
猪圆环病毒(Porcine circovirus,PCV)为圆环病毒科圆环病毒属成员,由 Tischer 于1974年首先在 PK-15细胞中发现,并于1982年命名为猪圆环病毒。PCV 有2种血清型,即 PCV1和 PCV2[1]。PCV1无或对猪的致病性低,广泛存在猪体内和猪肾传代细胞系中;PCV2 有致病性,是引发猪断奶后多系统衰弱综合征(postweaning multisystemic wasting syndrome,PMWS)的主要病原[2],主要侵害机体的免疫系统,造成机体的免疫抑制[3]。PCV2 与其他细菌病和病毒病混合感染后,大大加剧猪的死亡,给养猪业带来相当大的经济损失,已成为阻碍养猪业发展的重要病原之一[4,5]。目前,尚无控制和消灭 PCV2 感染的有效措施,也无切实可行的商品疫苗和药物来防止 PMWS 的发生。我国养猪业受到PCV2 感染的危害日益严峻,研制 PCV2 血清抗体检测试剂盒不仅是临床诊断的迫切需求,同时也能为疫苗的研制提供必要的技术手段。
PCV2 含有2个主要的开放阅读框( open reading frame,ORF),其中 ORF2 基因编码病毒的衣壳蛋白(Cap)是主要结构蛋白,包含主要的抗原中和表位,具有良好的免疫原性,且 PCV1 和 PCV2 之间不发生血清学交叉反应,是检测病毒抗体水平的良好抗原[6],也是发展新型疫苗的良好靶基因[7]。利用杆状病毒表达系统在体外表达的重组 Cap 蛋白(30 kDa)能够自我组装为病毒核衣壳样粒子,并表现出了良好的免疫原性[8],但因蛋白的表达量较低,限制了进一步的应用。赵玲等[9]构建了pET32a-ORF2 原核表达质粒,但表达的蛋白主要以包涵体的形式存在。本研究对 PCV2 ORF2 截短基因进行了原核表达,通过对蛋白表达条件的优化,获得了可溶性的重组蛋白,并且对蛋白的免疫原性进行分析,为进一步研究 Cap 蛋白的功能,研发更为安全、高效、廉价的 PCV2 Cap 蛋白亚单位疫苗和特异、方便、快速检测试剂盒奠定了基础。
1 材料与方法
1.1 质粒、菌种及试剂PCV2 WH 株、PCV2 阳性血清、pET-32a(+) 载体系统、受体菌DH5a及BL21(DE3)感受态细胞均由南京天邦生物科技有限公司生物技术研究所制备并保存;BamH I、NotI、T4 DNA 连接酶、DNA 提取试剂盒、DNA Marker(DL2000)均购自 TaKaRa公司;质粒提取试剂盒、DNA 胶回收试剂盒均购自 Axygen 生物技术有限公司;蛋白纯化试剂盒购自上海生工生物工程技术有限公司;弗氏佐剂及弗氏不完全佐剂、HRP 标记的羊抗猪 IgG 二抗购自 Sigma 公司;DAB 显色试剂盒为天根生化科技(北京)有限公司产品;FITC标记的葡萄球菌A蛋白购自武汉博士德生物工程有限公司。
1.2 引物的设计与合成应用 Primer premier5.0 软件,参考 GenBank 中收录的多株 PCV2 ORF2 基因序列,去掉 Cap 蛋白N端信号肽(41个氨基酸 ),设计一对引物,预期扩增片段大小为579 bp,并分别在引物上下游引入BamH I 、NotI 酶切位点。引物由上海生工生物工程技术有限公司合成,上游引物:5'-CTGGGATCCAATGGCATCTTCAACACCCGC-3',下游引物5'-AGAGCGGCCGCTTAGGGGTTAAGTGGGGGGTCTTT-3',下划线部分为酶切位点。
1.3 ORF2 基因的扩增取-70℃ 保存的 PCV2 WH株,接种于已长满单层的 PK-15 细胞培养48~72 h,收获全部培养物,用DNA提取试剂盒提取总DNA。建立25 μL 扩增体系: rTaq0.3 μL、上下游引物各 1 μL、dNTP 1 μL、模板 DNA 2 μL、10×buffer(Mg2+)2.5 μL 、ddH2O 17.2 μL。按如下程序扩增:94℃预变性4 min;94℃变性40 s,55℃退火40 s,72℃延伸40 s,共30个循环;最后72℃延伸10 min。PCR产物电泳检测后,剩余PCR产物用胶回收试剂盒回收。
1.4 重组表达质粒pET32a-Cap2的构建及鉴定分别用BamH I、NotI 双酶切上述胶回收产物和载体pET32a (+) ,酶切产物经胶回收后,用T4 DNA连接酶于16℃连接过夜,将连接产物转化DH5α 感受态细胞。挑取单个菌落培养,提取质粒,分别做PCR及酶切鉴定,选取阳性质粒,送至上海生工生物工程技术有限公司进一步测序确证,将阳性重组表达质粒命名为pET32a-Cap2。
1.5 重组蛋白的诱导表达及 SDS-PAGE 凝胶电泳分析分别将空载体 pET32a(+) 和重组阳性质粒转化至 BL21(DE3)感受态细胞中,涂板37℃过夜。挑取单菌落接种于 LB 液体培养基中(氨苄霉素终浓度100 μg/mL),37℃过夜后,按1:100 的比例接种于氨苄抗性的 LB 液体培养基中,37℃ 振荡培养2~4 h,至OD600值为0.4~0.6 时加入终浓度为1mmol/L的 IPTG 进行诱导,37℃继续培养。在诱导 1、2、3、4、5、6 h时收集1 mL菌液,4℃、13 000×gr/min 离心1 min,收集菌体,重悬于适量5×SDS 上样缓冲液中,沸水浴10 min,取10 μL 13 000×g进行SDS-PAGE 电泳分析。
1.6 重组蛋白的可溶性分析将诱导表达的菌体,4℃、13 000×g离心 10 min,收集菌体,加入适量的 PBS 重悬,在冰浴上进行超声波破碎,2 s/次,间隔2 s,超声10 min,4℃、13 000×g离心 10 min,分别取上清和沉淀进行 SDS-PAGE 凝胶电泳分析。
1.7 重组蛋白的纯化按照上海生工生物工程技术有限公司蛋白纯化试剂盒纯化重组蛋白,超声破碎后的上清按说明书进行纯化。收集目的蛋白洗脱液,用SDA-PAGE检测蛋白纯度,目的蛋白浓缩后用蛋白定量试剂盒定量。
1.8 融合蛋白的 Western blot 鉴定将纯化后的样品经处理后进行SDS-PAGE,电泳结束后电转移到硝酸纤维素膜上,用5%的脱脂乳37℃封闭2 h,PBST洗涤5次;用1:100 稀释的抗PCV2阳性血清作为一抗37℃孵育1 h,PBST洗涤5次;放入1:8000稀释的辣根过氧化物酶(HRP)标记的山羊抗猪的二抗中,37℃作用40 min,PBST 洗涤5次后,DAB进行显色。
1.9 重组Cap蛋白免疫原性的鉴定将纯化后目的蛋白与等量的弗氏完全佐剂充分乳化后,对5只6~8 w BALB/c雌性小鼠,以50 μg /只的剂量进行颈部、背部多点皮下注射。初次免疫后14 d,将目的蛋白与等体积的弗氏不完全佐剂充分乳化后进行1次加强免疫,同时用健康的小鼠做对照。免疫后每周采血分离血清,检测其抗体效价。
1.10 免疫血清中和活性的测定选取抗体效价较高的血清,采用固定病毒稀释抗体的方法进行病毒中和实验,以能够抑制50%细胞出现荧光的血清最高稀释度作为中和抗体滴度,用来检测小鼠抗PCV2 Cap 血清抗体的中和病毒活性。同时设抗PCV2阳性血清和健康小鼠血清做对照。将小鼠血清置56℃水浴灭活30 min,取灭活的血清用含2%小牛血清的DMEM细胞维持液做1:2系列稀释,加入等体积的病毒液(100TCID50/mL)混合,37℃感作2 h,同时设病毒对照组和健康细胞对照组。取混合液200 μL分别加到96孔细胞培养板上已长成单层的PK-15细胞中,每个稀释度接种5孔细胞。将细胞板置37℃、5%CO2培养箱中孵育72 h,采用间接免疫荧光检测(indirect immunofluorescence assay,IFA)法检测各孔抗原,根据Reed-Muench法,计算血清中和效价。
2 结果
2.1 ORF2 基因的扩增取5 μL PCR 产物经琼脂糖凝胶电泳,获得与预期大小相符的 579 bp条带(见图1)。

图1 猪圆环病毒ORF2基因的 PCR 扩增Fig.1 PCR amplifi cation of PCV2 ORF2 gene
2.2 表达质粒pET32a-Cap2 的构建和鉴定分别用特异性引物和通用引物对pET32a-Cap2重组质粒进行鉴定,经特异性引物鉴定,其大小为579 bp;经通用引物鉴定,其大小为1300 bp 左右(图2);双酶切结果显示重组表达质粒 pET32a-Cap2构建正确(图3)。测序结果显示,插入的目的片段正确,没有出现碱基突变。
2.3 重组Cap蛋白的诱导表达、可溶性分析及纯化经SDS-PAGE析表明,重组质粒经IPTG诱导后可获得分子质量大约为40 kDa 的蛋白,而空pET32a (+) 转化的菌体在40 kDa附近没有出现目的蛋白条带,与预计结果相符。随着IPTG诱导时间的增加,蛋白表达量增多,6 h后目的蛋白不再增加(图4)。将收集的菌液进行超声波破碎,离心后取其上清和沉淀分别进行SDS-PAGE分析,结果表明在37℃诱导条件下,沉淀中目的蛋白的量较大,而上清中目的蛋白较少。进一步调整诱导条件,发现在蛋白诱导过程中,降低温度可以使表达产物大部分以上清的形式存在。在低于30℃的条件下诱导7 h,表达产物主要以上清的形式存在,而沉淀中的目的蛋白却很少。随着诱导时间的延续,表达产物开始以上清和包涵体两种形式存在,表明通过改变诱导条件,重组蛋白可以以上清的形式表达。用Ni-NTA琼脂糖对超声后的上清进行纯化,SDS-PAGE分析可获得单一纯化蛋白(图5)。利用蛋白质定量试剂盒对纯化后的重组蛋白进行检测,纯化蛋白的纯度在90%以上,其浓度为0.2 mg/mL。

图2 重组质粒pET32a-Cap2的PCR鉴定Fig.2 PCR identification of recombinant plasmid pET32a-Cap2
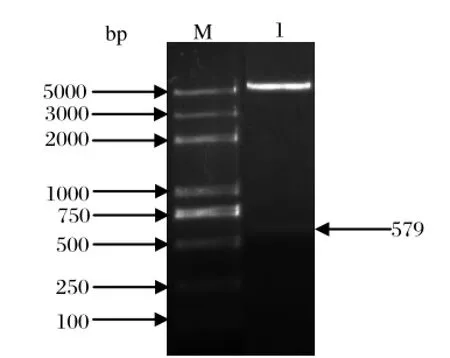
图3 重组质粒 pET32a-Cap2 双酶切鉴定Fig.3 Identification of recombinant plasmid pET32a-Cap2 by double digestion
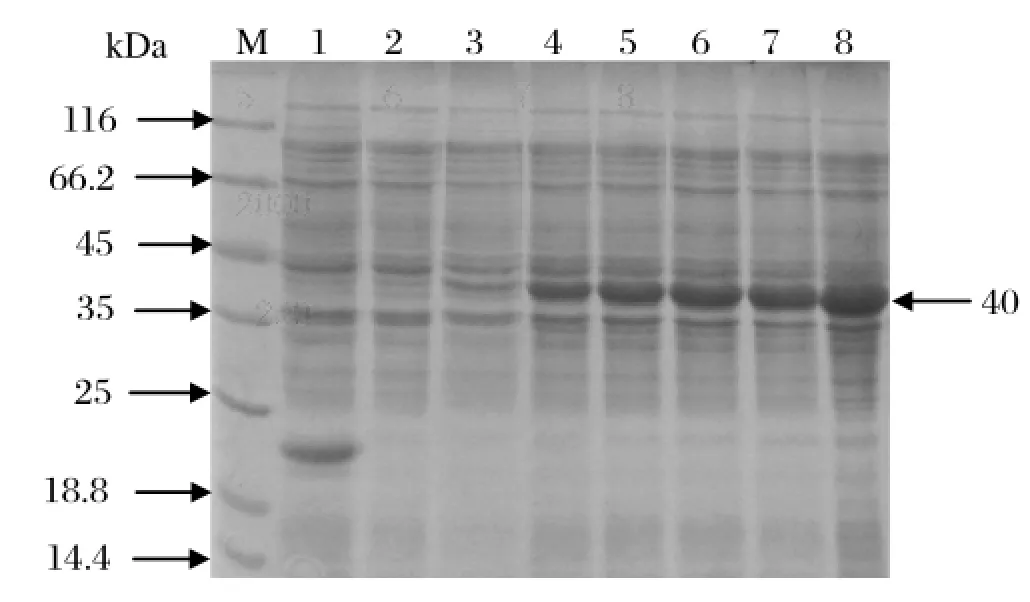
图4 重组Cap蛋白的SDS-PAGE分析Fig.4 Analysis of recombinant Cap protein by SDS-PAGE

图5 重组Cap 蛋白的可溶性分析Fig.5 Solubility analysis of the recombinant Cap protein by SDS-PAGE
2.4 融合蛋白的 Western blot 结果Western blot 鉴定结果显示,在目标条带位置上出现一条明显的棕色印记,而空载体转化菌在相应位置则无颜色反应条带,表明该蛋白得到了正确表达并具有良好的反应原性(图6)。

图6 重组Cap蛋白的 Western blot分析结果Fig.6 Analysis of the recombinant Cap protein by Western blot
2.5 重组Cap蛋白免疫原性的鉴定采集经重组Cap蛋白免疫的小鼠血清,用间接 ELISA 测定抗体效价,结果显示鼠抗重组Cap蛋白的血清抗体效价最高可达1:25 600。结果表明,重组Cap蛋白具有良好的免疫原性。
2.6 病毒感染细胞中PCV2 Cap的检测以鼠抗PCV2 Cap蛋白免疫血清为一抗,采用IFA法对PCV2感染细胞中的Cap蛋白进行检测,结果表明,抗体能与PCV2感染的PK-15细胞发生阳性反应,而对照组则无阳性反应(图7),表明制备的抗体能够特异性的识别自然的PCV2 Cap蛋白。
2.7 免疫血清中和活性的测定血清中和实验表明,鼠抗PCV2 Cap蛋白的血清中和效价为1:36,具有一定的中和活性(表8)。
3 讨论
自1991年加拿大首次报道由PCV2引起的断奶仔猪多系统衰竭综合征(PMWS)以来,PMWS相继在全世界范围内被发现,给养猪业带来巨大的经济损失。国内外诸多机构都在积极的开展PCV2防治的研究,越来越多的商品化的疫苗正在出现。目前,市场上商品化的PCV2疫苗主要有:基因工程亚单位疫苗和灭活疫苗[10]。我国于2010年研制出了PCV2灭活疫苗。由于PCV2在PK15细胞上的增殖滴度不高,病毒培养成本高、周期长且病毒培养物不易纯化,给研究和生产带来了一定的困难,因此利用基因工程方法获得安全、高效、廉价的新型亚单位疫苗是我国 PCV2疫苗研究的方向[11]。

图7 PCV2病毒感染细胞中 Cap的间接免疫荧光检测Fig.7 IFA analysis of PCV2 Cap in PK-15 cell inoculated with PCV2

表8 鼠抗血清中和活性的测定Table 8 The determination of serum neutralizaing activity
由于ORF2基因的前123 bp中富含稀有密码子,这段序列是与核定位有关的信号肽序列,在原核表达中难度很大且表达效果很差,原因可能在于其N端特殊的氨基酸组成:序列高度保守,N端核内化信号肽含有大量的精氨酸,具有很强的疏水性,并且主要由稀有密码子编码。ORF2的核内化信号肽中高含量的精氨酸,会消耗大肠杆菌中大量编码精氨酸的tRNA,而此tRNA在大肠杆菌中本身含量就不多,即tRNA的量限制了蛋白合成速度,这些稀有密码子的连续出现甚至会抑制蛋白质的合成,导致蛋白合成的早期终止[12]。Liu等[6]用大肠杆菌表达了PCV2 Cap 蛋白全基因,但表达量较低,甚至检测不到目的蛋白。
原核表达系统具有许多优点,如操作简单,表达外源基因的周期较短等。本试验中对ORF2的前123 bp进行人为剪切后,剩余的579 bp获得了表达,且表达的蛋白保留了PCV2 Cap蛋白原有的4个免疫反应区域。通过对IPTG浓度、诱导表达温度和摇床转速进行优化,发现降低IPTG浓度和诱导温度及摇床转速,重组蛋白会以上清的形式表达,避免了包涵体形式的蛋白繁琐的复性过程,纯化时非常方便且抗原性更好。经Western blot检测表明,表达的Cap融合蛋白能被猪PCV2阳性血清所识别,具有良好的免疫原性。利用纯化后的蛋白免疫小白鼠,获得了抗Cap蛋白的鼠抗血清。IFA表明该血清具有良好的特异性,中和试验表明,鼠抗PCV2 Cap蛋白抗体具有一定的中和活性。PCV2型 Cap蛋白的表达,为病毒的检测以及PCV2亚单位疫苗的制备打下了基础,同时也为进一步深入研究 Cap 蛋白的功能奠定了基础。
[1] Sanchez R E Jr,Nauwynck H J,McNeilly,et al. Porcine circovirus 2 infection in swine foetuses inoculated at different stages of gestation[J]. Vet Microbiol,2003,83(2): 169-176.
[2] Allan G M,McNeilly F,Meehan B M,et al. Isolation and characterization of circoviruses from pigs with wasting syndromes in Spain,Denmark and Northern Ireland[J]. Vet Microbiol,1991,66(2): 115-123.
[3] Chianini F,Majo N,Segale's J,et al. Immunohistochemical characterisation of PCV2 associate lesions in lymphoid and non-lymphoid tissues of pigs with natural postweaning multisystemic wasting syndrome PMWS[J]. Vet Immunol Immunopathol,2003,94(1-2): 63-75.
[4] Allan G M,Ellis J A. Porcine circoviruses: a review [J].J Vet Diag Invest ,2000,12(1): 3-14.
[5] 朗洪武,张广川,吴发权,等. 断奶猪多系统衰竭综合征血清抗体检测[J]. 中国兽医科技,2000,30(3): 3-5.
[6] Liu Q,Tikoo S K,Babiuk L A. Nuclear location of the ORF2 protein encoded by porcine circovirus type 2 [J]. Virology,2001,285(1): 91-99.
[7] Shang S B,Jin y L,Jiang X T,et al. Fine mapping of antigenic epitope on capsid proteins of porcine circovirus and antigenic phenotype of porcine circovirus type 2 [J]. Vet Immunol Immunopathol,2009,46(3): 327-334.
[8] Nawangitgul P,Morozov I,Bolin S R,et al. Open reading frame 2 of porcine circovirus type 2 encodes a majorcapsid protein[J]. J Gen Virol,2000,81(Pt9): 2281-2287.
[9] 赵玲,朱玲,郭万柱,等. 猪圆环病毒2型Cap 蛋白的表达及在 ELISA中的初步应用[J]. 畜牧兽医学报,2011,42 (6): 808-814.
[10] Grau-Roma L,Fraile L,Segales J. Recent advances in the epidemiology,diagnosis and control of disease caused by porcine circovirus type 2[J]. Vet J,2010,187(1): 23-32.
[11] 范红结,王霞,陈孝明,等. 猪圆环病毒Cap蛋白的分泌表达及其免疫原性研究[J]. 畜牧与兽医,2012,44(11): 27-32.
[12] Lekcharoensuk P,Morozov I,Paul P S,et al. Epitope mapping of the major capsid protein of type 2 Porcine circovirus (PCV2) by using chemeric PCV1 and PCV2 [J]. Virology,2004,78(15): 8135-8145.
EXPRESSION AND IMMUNOGENICITY OF RECOMBINANT CAP PROTEIN OF PORCINE CIRCOVIRUS TYPE 2
ZHU Peng1,2,ZHANG Xiao-fei2,XU Yan-wei2,YIN Xiu-feng2
(1. College of Veterinary Medicine,Anhui Agricultural University,Hefei 230036,China; 2. Biotechnology Research Institute,Nanjing Techbank Bio-industry Co. Ltd.,Nanjing 211102,China)
The truncated ORF2 of Porcine circovirus type 2(PCV2) WH strain was amplifi ed and cloned into expression vector pET32a (+). The expression vector pET32a-Cap2 was then transformed into BL2 (DE3) for expression with induction of IPTG. The expressed pET32a-Cap products were analyzed in SDS-PAGE and Western blot. The recombinant Cap protein was a soluble protein with molecular weight of 40 kDa. The purifi ed Cap protein was used to immunize mice to prepare antiserum. The resulting murine antiserum had ELISA titer at over 1:25 600 and reacted with PCV2 in infected PK-15 cells in indirect immunofl uorescence assay (IFA). The murine antiserum also showed neutralizing titer at 1:36. The availability of the recombinant PCV2 Cap protein provides the basis for development of vaccine and diagnostic reagents.
Porcine circovirus type 2; Cap protein; immunogenicity; neutralization
S852.659.2
A
1674-6422(2014)05-0028-07
2014-03-07
朱鹏,男,硕士,主要从事动物疾病研究
张小飞,E-mail:xiaofei0804@sina.com

