贝伐单抗联合培美曲塞加顺铂治疗晚期非小细胞肺癌的临床观察
孙 京,胡 毅,汪进良,董伟伟,吴柏寿
解放军总医院 肿瘤内科,北京 100853
贝伐单抗联合培美曲塞加顺铂治疗晚期非小细胞肺癌的临床观察
孙 京,胡 毅,汪进良,董伟伟,吴柏寿
解放军总医院 肿瘤内科,北京 100853
目的比较贝伐单抗联合培美曲塞加顺铂(Avastin + PP)化疗方案与单用培美曲塞加顺铂(PP)化疗方案治疗晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的临床疗效及不良反应。方法收集2009年9月- 2013年6月在我院应用贝伐单抗联合培美曲塞加顺铂治疗的晚期非小细胞肺癌患者32例为联合治疗组,取同时期、同TNM分期、同病理类型,采用培美曲塞加顺铂化疗方案的患者35例为对照组,所有患者均符合化疗要求。对照组:培美曲塞500 mg/m2,静脉滴注,d1;顺铂75 mg/m2静脉滴注,d1或d1 ~ d3;每21 d为1个周期。联合治疗组:培美曲塞和顺铂用法及用量同对照组,贝伐单抗7.5 mg/kg静脉滴注,d1,每21 d为1个周期。结果联合治疗组和对照组疾病控制率分别为90.6%和60.0%(P<0.05);客观有效率分别为56.9%和25.7%(P<0.05);中位无进展生存期分别为7.3个月和4.2个月(P<0.05);中位总生存期分别为20.7个月和9.0个月(P<0.05),不良反应有骨髓抑制、恶心呕吐、肝肾功能损伤等,但两组差异无统计学意义。结论贝伐单抗联合培美曲塞加顺铂化疗方案治疗晚期非小细胞肺癌在远期疗效和近期疗效方面均优于单用培美曲塞加顺铂化疗方案,且没有增加严重不良反应。
非小细胞肺癌;贝伐单抗;治疗效果;安全性
肺癌是临床上最常见的恶性肿瘤,近些年来在我国的发病率和死亡率都呈逐年上升的趋势。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占绝大多数,而且半数以上的患者就诊时已经到晚期,失去手术机会,化疗成为这部分患者的主要治疗手段。国际公认的治疗晚期肺癌的标准方案是以铂为基础的双药化疗方案,在此基础上联合任何第3种细胞毒性化疗药物,不仅不能提高临床疗效,反而容易增加不良反应[1-2]。可见传统化疗药物的疗效已经达到一个平台期。随着分子生物学和细胞生物学的发展,对肺癌治疗的研究也逐渐聚焦到靶向药物。贝伐单抗,商品名阿瓦斯丁,是目前研究最为广泛的靶向治疗药物之一。2006年,FDA批准将贝伐单抗联合紫杉醇与卡铂作为进展期非鳞NSCLC的一线治疗方案[3]。目前化疗联合靶向药物已成为当前研究的热点,本文回顾性分析贝伐单抗联合培美曲塞加顺铂治疗晚期非鳞非小细胞肺癌患者的疗效与不良反应。
资料和方法
1 资料 2009年9月- 2013年6月在我院应用贝伐单抗联合培美曲塞加顺铂治疗的晚期非小细胞肺癌患者32例,均为经病理和(或)细胞学明确诊断的非鳞非小细胞肺癌患者,既往治疗中未曾应用过贝伐单抗。取同时期、同TNM分期、同病理类型采用培美曲塞加顺铂化疗方案的患者35例为对照组。患者年龄≥20岁;至少具有1个双侧可测量的病灶,胸片、普通CT或MRI扫描病灶≥20 mm,螺旋CT或PET-CT扫描病灶≥10 mm;预计生存期≥3个月;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状况(PS)0 ~ 2分;符合化疗的指征和基本要求,血象、心电图基本正常,心、肝、肾功能无明显异常。实验组接受贝伐单抗治疗2次以上;无严重高血压(<150/100 mmHg)及出血性疾病,机体没有未愈合的伤口,不存在凝血和出血体质。所有入选患者均签署知情同意书,并且实验方案通过解放军总医院伦理委员会批准。
2 治疗方法 对照组:培美曲塞500 mg/m2,静脉滴注,d1;顺铂75mg/m2静脉滴注,d1或d1 ~ d3给药;每21 d为1个周期。所有患者用药前1周口服多维元素片(含叶酸400 μg/片)1片,1/d至少5 d,直至最后1次应用培美曲塞后21 d;第1周期化疗开始前给予维生素B121 000 μg肌注1次,每3周期治疗开始前重复;用培美曲塞前一天晚、当天早晚和第2天早口服地塞米松3.75 mg,预防过敏反应发生。联合治疗组:培美曲塞和顺铂使用方法同对照组,贝伐单抗7.5 mg/kg,静脉滴注,d1,每21 d重复。贝伐单抗滴注第1次持续90 min。如持续耐受良好,第2次可为60 min,如果持续耐受良好,以后输注可控制在30 min。
3 疗效评价及不良反应 参照实体瘤近期客观疗效评价标准(response evaluation criteria in solid tumors,RECIST)进行评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。客观有效率(objective response rate,ORR)=(CR+PR)/总例数× 100%;疾病控制率(disease control rate,DCR)=(CR+ PR+SD)/总例数×100%。无进展生存期(progressionfree survival time,PFS)指患者随机入组至任何有记录的病变进展之日的时间。总生存期(overall survival time,OS)指治疗开始至任何原因引起死亡的时间。肿瘤基线检查在治疗开始前2周内进行,治疗结束后采用相同的影像学手段进行评价。不良反应按照WHO抗癌药物毒性反应评价标准进行评价[4]。
4 统计学分析 采用SPSS13.0软件进行统计分析,两组间有效率比较采用Fisher的确切概率法。定量资料比较采用成组t检验。无进展生存期和总生存期分别采用Kaplan-Meier法估算,并用Logrank检验,P<0.05为差异有统计学意义。
结 果
1 一般情况 两组共67例患者,其中腺癌65例,占总数的97%,联合治疗组和对照组中各有1例大细胞肺癌。两组在年龄、性别、ECOG评分、病程分期等方面的差异均无统计学意义(P>0.05)。见表1。

表1 非小细胞肺癌患者资料Tab. 1 Baseline parameters of NSCLC patients (n, %)
2 近期疗效 67例患者均获随访,其中联合治疗组CR 0例,PR 15例(46.9%),SD 14例(43.7%),PD 3例(9.4%)。对照组CR 0例,PR 9例(25.7%),SD 12例(34.3%),PD14例(40%)。联合治疗组和对照组ORR分别为46.9%和25.7%(P<0.05),DCR分别为90.6%和60%(P<0.05)。
3 远期疗效 本研究随访截止日期为2013年6月,失访0例。联合治疗组和对照组中位无进展生存期(mPFS)分别为7.3个月(95% CI:0 ~ 14.94个月)和4.2个月(95% CI:3.0 ~ 5.4个月)(P<0.05),联合治疗组高于实验组,差异有统计学意义(表2,图1)。中位生存期(mOS)分别为20.7个月(95% CI:12.8 ~ 28.5个月)和9.0个月(95% CI:7.8 ~10.2个月)(P<0.05),联合治疗组高于实验组,差异有统计学意义。见表2,图2。
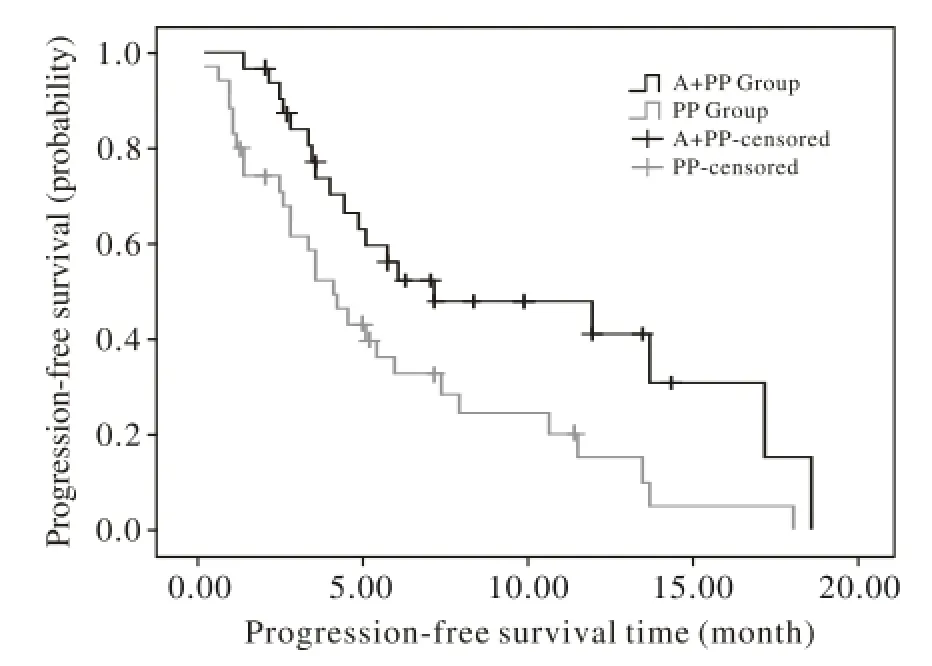
图 1 两组无进展生存曲线Fig. 1 Progression-free survival curves of two groups

图 2 两组总生存曲线Fig. 2 Overall survival curves of two groups
4 不良反应 治疗过程中的不良反应均可控,且多为Ⅰ度和Ⅱ度,无患者因为不可耐受化疗反应而终止治疗。恶心、呕吐Ⅲ~Ⅳ度有5例(7.5%),血小板降低Ⅲ~Ⅳ度有1例(1.5%),白细胞降低Ⅲ~Ⅳ度有11例(16.4%)。联合治疗组中6例出现高血压,其中1例为Ⅲ度,经降压治疗后均恢复;2例鼻出血,2例胃肠道出血,均为Ⅰ~Ⅱ度,经止血治疗后好转;1例出现蛋白尿,未经特殊处理自行好转;未出现胃肠穿孔、静脉血栓、脑白质综合征。可见使用贝伐单抗治疗后均耐受良好,未出现首剂输注反应和危及生命的严重不良反应。两组不良反应差异无统计学意义。见表3。
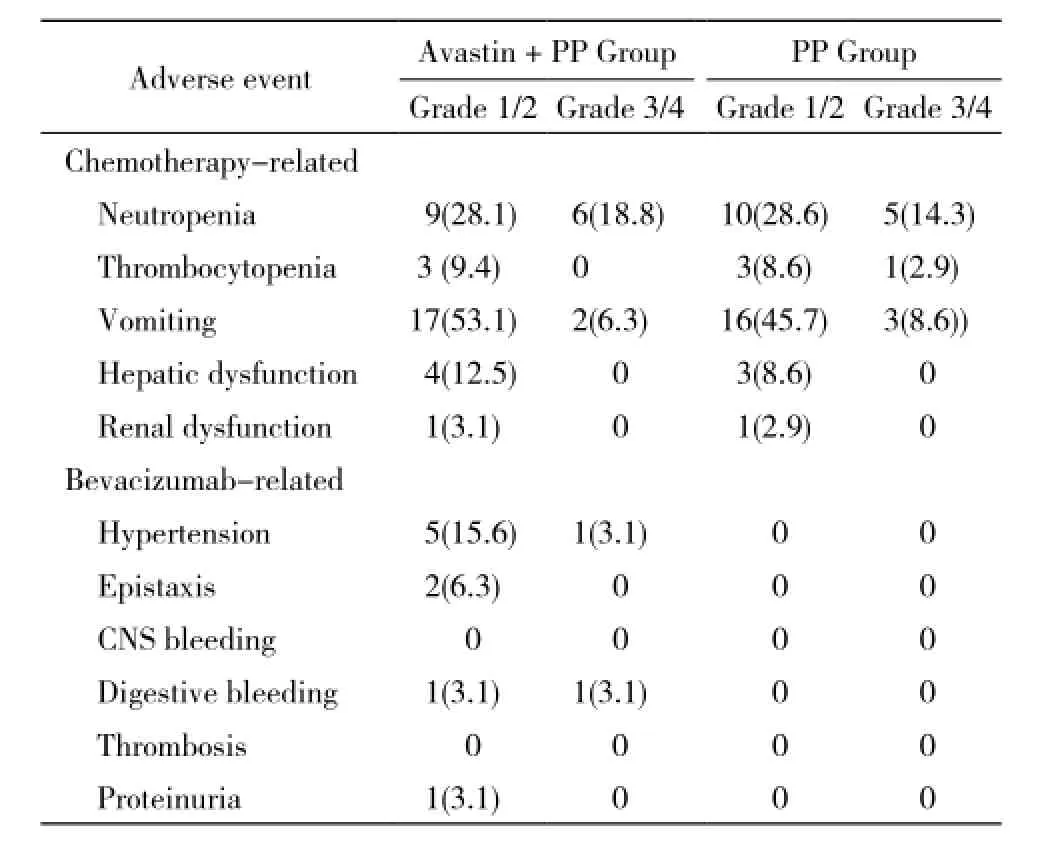
表3 两组治疗中不良反应比较Tab. 3 Adverse reactions in two groups (n, %)
讨 论
血管内皮生长因子(vascular endothelial growth factor,VEGF)是介导肿瘤新血管生成的最重要的因子,在包括肺癌在内的大多数恶性肿瘤中过度表达[5]。贝伐单抗是一种重组人源化IgG1型单克隆抗体,能与VEGF特异性结合,阻断VEGF的生物效应,抑制肿瘤内血管新生,延缓肿瘤生长和转移[6-8]。当前的一些研究表明非鳞非小细胞肺癌患者接受贝伐单抗联合化疗能明显获益[9-15]。
ECOG 4599启动了Ⅲ/Ⅳ期非鳞非小细胞肺癌Ⅲ期临床研究,比较卡铂+紫杉醇与卡铂+紫杉醇+贝伐单抗的疗效,结果显示两组有效率分别为15%和35%;中位PFS分别为4.5个月和6.2个月(P<0.001);中位OS分别为10.3个月和12.3个月(P=0.003),该研究显示贝伐单抗的加入使得晚期NSCLC患者mPFS和mOS显著获益、缓解率显著提高[15]。AVAiL研究对吉西他滨+顺铂、吉西他滨+顺铂+7.5 mg/kg贝伐单抗和吉西他滨+顺铂+15 mg/kg贝伐单抗方案进行了比较,结果显示3组的客观有效率分别为20%、30%和34%;3组的中位PFS分别为6.2个月、6.8个月、6.6个月,P值均有统计学差异。该研究显示两种剂量的贝伐单抗联合吉西他滨+顺铂方案均能使晚期NSCLC患者PFS显著获益,缓解率显著提高[15]。一个国际多中心、单组、Ⅳ期临床研究(SAiL)分析了40多个国家的2 212例未经治疗的晚期非鳞NSCLC患者,所有患者均采用非小细胞肺癌标准化疗方案联合贝伐单抗治疗,其研究结果在大规模真实临床环境下证实了贝伐单抗在晚期NSCLC一线治疗中的获益[12]。Reynolds等[16]进行了1项Ⅱ期试验,将纳米白蛋白结合紫衫醇+卡铂+贝伐单抗作为进展期非鳞NSCLC患者的一线治疗,结果显示客观有效率为30%,中位PFS为7.1个月,该结果提示这种联合方案对NSCLC患者疗效较好。在多个大型Ⅲ期临床研究中也证实贝伐单抗的安全性,研究表明主要不良反应表现在化疗药物的胃肠道反应和骨髓抑制,严重的不良反应很少见[12,17]。

表2 两组患者疗效比较Tab. 2 Clinical outcomes in two groups (n, %)
本研究显示贝伐单抗联和培美曲塞加顺铂化疗方案治疗晚期非鳞非小细胞肺癌,无论近期疗效还是远期疗效都优于单用培美曲塞加顺铂化疗方案。联合治疗组和单纯化疗组疾病控制率分别为90.6%和60%(P<0.05);中位PFS分别为7.3个月和4.2个月(P<0.05);中位OS分别为20.7个月和9.0个月(P<0.05),可见联合治疗方案明显优于单纯化疗方案。本研究中贝伐单抗相关的不良反应主要有高血压、蛋白尿、轻微出血,经对症治疗后均好转,未影响临床用药,未观察到胃肠穿孔、脑白质综合征、静脉血栓栓塞事件。对于化疗相关不良反应有骨髓抑制、恶心呕吐、肝肾功能损伤等,两组都以Ⅰ~Ⅱ度为主,且两组差异无统计学意义。本研究与以往文献报道一致,贝伐单抗可以在不增加不良反应的同时使晚期NSCLC患者明显获益。
综上所述,本研究显示贝伐单抗联合培美曲塞加顺铂方案治疗晚期非小细胞肺癌与单用培美曲塞加顺铂方案相比,获得更好的疗效,且没有增加严重不良反应,其安全性较高。可见传统化疗药物与靶向药物不良反应和药物作用机制不重叠,为肿瘤治疗开辟了一条新途径。
1 Stinchcombe TE, Socinski MA. Current treatments for advanced stage non-small cell lung Cancer[J]. Proc Am Thorac Soc, 2009, 6(2):233-241.
2 Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung Cancer [J] . N Engl J Med, 2002, 346(2): 92-98.
3 FDA approves Avastin in combination with chemotherapy for firstline treatment of most common type of lung cancer[J]. Cancer Biol Ther, 2006, 5(11):1425-1428.
4 Cancer Therapy Evaluation Program, National Cancer Institute. Common Terminology Criteria for Adverse Events v3.0(CTCAE)[S/OL]. http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf
5 Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis[J]. J Clin Oncol, 2005,23(5):1011-1027.
6 Jain RK, Duda DG, Clark JW, et al. Lessons from phase III clinical trials on anti-VEGF therapy for Cancer[J]. Nat Clin Pract Oncol,2006, 3(1): 24-40.
7 Kerbel R, Folkman J. Clinical translation of angiogenesis inhibitors[J]. Nat Rev Cancer, 2002, 2(10):727-739.
8 Ferrara N, Hillan KJ, Gerber HP, et al. Discovery and development of bevacizumab, an anti-VEGF antibody for treating Cancer[J]. Nat Rev Drug Discov, 2004, 3(5): 391-400.
9 Nishio M, Horai T, Kunitoh H, et al. Randomized, open-label,multicenter phase II study of bevacizumab in combination with carboplatin and paclitaxel in chemotherapy-naive Japanese patients with advanced or recurrent nonsquamous non-small cell lung cancer(NSCLC): JO19907[J]. J Clin Oncol, 2009, 27(15S): 8036.
10 Habib S, Delourme J, Dhalluin X, et al. Bevacizumab and weekly paclitaxel for non-squamous non small cell lung Cancer patients: a retrospective study[J]. Lung Cancer, 2013, 80(2): 197-202.
11 Crinò L, Dansin E, Garrido P, et al. Safety and efficacy of first-line bevacizumab-based therapy in advanced non-squamous non-smallcell lung cancer (SAiL, MO19390): a phase 4 study[J]. Lancet Oncol, 2010, 11(8):733-740.
12 Fischbach NA, Spigel D, Brahmer J, et al. Preliminary safety and effectiveness of bevacizumab(BV) based treatment in subpopulations of patients(pts) with non-small cell lung cancer(NSCLC) from the ARIES study: A bevacizumab(BV) treatment observational cohort study(OCS)[J]. J Clin Oncol, 2009, 27(15s): 8040.
13 Niho S, Kunitoh H, Nokihara H, et al. Randomized phase II study of first-line carboplatin-paclitaxel with or without bevacizumab in Japanese patients with advanced non-squamous non-small-cell lung Cancer[J]. Lung Cancer, 2012, 76(3): 362-367.
14 Sandler A, Yi J, Dahlberg S, et al. Treatment outcomes by tumor histology in Eastern Cooperative Group Study E4599 of bevacizumab with paclitaxel/carboplatin for advanced non-small cell lung Cancer[J]. J Thorac Oncol, 2010, 5(9): 1416-1423.
15 Reck M, Von Pawel J, Zatloukal P, et al. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil[J]. J Clin Oncol, 2009, 27(8):1227-1234.
16 Reynolds C, Barrera D, Jotte R, et al. Phase II trial of nanoparticle albumin-bound paclitaxel, carboplatin, and bevacizumab in firstline patients with advanced nonsquamous non-small cell lung Cancer[J]. J Thorac Oncol, 2009, 4(12): 1537-1543.
17 Besse B, Lasserre SF, Compton P, et al. Bevacizumab safety in patients with central nervous system metastases[J]. Clin Cancer Res, 2010, 16(1): 269-278.
Clinical effect of combined bevacizumab, pemetrexed and cisplatin on advanced non-small cell lung cancer
SUN Jing, HU Yi, WANG Jin-liang, DONG Wei-wei, WU Bai-shou
Department of Oncology, Chinese PLA General Hospital, Beijing 100853, China
Corresponding author: HU Yi. Email: huyi0401@aliyun.com
ObjectiveTo compare the clinical effect of combined pemetrexed and cisplatin, and bevacizumab alone on advanced nonsmall cell lung cancer (NSCLC).MethodsThirty-two advanced NSCLC patients who were treated with combined bevacizumab, pemetrexed and cisplatin (Avastin +PP) in our hospital from September 2009 to June 2013 served as an experimental group and 35 advanced NSCLC patients who were treated with combined pemetrexed and cisplatin(PP) served as a control group in this study. Patients in control group were treated with intravenous pemetrexed (500 mg/m2) on day 1 and cisplatin (75 mg/m2) on day 1 or on days 1-3, 21 days as a cycle. Those in experimental group were treated with intravenous bevaoizumab (7.5 mg/kg) on day 1, pemetrexed (500 mg/m2) on day 1 and cisplatin (75 mg/m2) on day 1 or on days 1-3, 21 days as a cycle.ResultsThe disease control rate (DCR)and overall response rate (ORR) in the two groups were 90.6% and 60.0%, 56.9% and 25.7%, respectively (P<0.05). The median progression-free survival (mPFS) time and median overall survival time (mOS) in the two groups were 7.3 months and 4.2 months, 20.7 months and 9.0 months, respectively (P<0.05). No significant difference was found in adverse reaction between the two groups (P>0.05) although bone marrow suppression, nausea, vomiting, hepatic and renal function damage occured.ConclusionThe long-term and short-term effects of combined bevacizumab, pemetrexed and cisplatin are better than combined pemetrexed and cisplatin on advanced NSCLC with no severe adverse reaction.
non-small-cell lung carcinoma; bevacizumab; treatment effectiveness; safety
R 734.2
A
2095-5227(2014)06-0525-04
10.3969/j.issn.2095-5227.2014.06.002
2014-03-13 17:52
http://www.cnki.net/kcms/detail/11.3275.R.20140417.1456.007.html
2014-01-11
吴阶平基金项目(320,6750,10157)
孙京,女,在读硕士,医师。研究方向:肺癌的综合治疗。Email: xiong123mao321@163.com
胡毅,男,主任医师,主任。Email: huyi0401@aliyun.com

