p65小干扰RNA对人脐静脉内皮细胞再灌注后趋化因子CXCL16表达的影响
曾 敏,魏 欣,李 伟,符秀虹,蒙绪卿,陈积雄,王 萍
炎症反应是缺血再灌注细胞损伤的重要环节,其中许多黏附因子和趋化因子都有参与。近年来,越来越多的研究显示趋化因子CXCL16参与了心血管疾病的炎症反应。内皮细胞处于血管最内层,对于冠状动脉的缺血缺氧、内环境的微小变化最敏感、最迅捷。因此,本研究选择人脐静脉内皮细胞作为研究对象,通过对其进行体外模拟缺血再灌注培养,并采用小干扰RNA(small interference RNA,siRNA)转染的方法探讨缺血再灌注中趋化因子CXCL16的表达及可能的调节机制。
1 材料与方法
1.1 材料和试剂 人脐静脉内皮细胞 (HUVEC)(购自ATCC),采用添加了内皮细胞生长物、5%胎牛血清和青/链霉素的内皮细胞培养基常规培养 (购自美国科学细胞研究实验室),siRNA〔美国Santa cruz公司 (sc-29410)〕,Lipofectamine RNAiMAX、Trizol试剂 (美国Invitrogen公司),iScriptTMcDNA合成试剂盒 (BIORAD公司),CXCL16 ELISA试剂盒 (美国R&D Systems公司),SYBR Premix Ex Taq(TaKaRa公司)。
1.2 方法
1.2.1 细胞培养 将HUVEC复苏后转移至新培养瓶,加入内皮细胞培养基中,置于37℃、5%二氧化碳(CO2)条件下孵箱内培养,5~7 d传代1次,采用0.25%胰蛋白酶消化细胞。
1.2.2 实验分组 分为4组:(1)对照组:正常内皮细胞培养基培养+siRNA阴性对照转染;(2)缺血再灌注组:模拟缺血培养液培养30 min后换正常培养液再培养4 h+siRNA阴性对照转染;(3)p65 siRNA转染组:正常内皮细胞培养基培养+p65 siRNA转染;(4)缺血再灌注+p65 siRNA转染组:模拟缺血再灌注+p65 siRNA转染 (对HUVEC转染p65 siRNA 48 h后再模拟缺血再灌注培养)。
1.3 模拟缺血再灌注培养 将HUVEC培养在包含118 mmol/L氯化钠、24 mmol/L碳酸氢钠、1.0 mmol/L磷酸钠、2.5 mmol/L氯化钙、1.2 mmol/L氯化镁、20 mmol/L乳酸钠、16 mmol/L氯化钾、10 mmol/L 2-脱氧葡萄糖 (pH调至6.2)的“缺血液”中30 min,然后换为再灌注液即正常培养基进行“再灌注”4 h而实现。
1.4 p65 siRNA转染 预设计好并经验证的核因子κB p65特异性siRNA和不与人类任何编码基因序列一致的对照siRNA均购自Santa cruz公司。将HUVEC接种于6孔板中,每孔2.0×105个细胞,使其在转染细胞密度30% ~50%融合。于300μl的无血清、无抗生素Opti-MEM中稀释3.6μl p65 siRNA,混匀。于300μl的无血清、无抗生素Opti-MEM中稀释6μl转染试剂Lipofectamine RNAiMAX(终浓度为20 nmol/L),混匀。再将两者混匀,常温下孵育15 min,转染48 h后检测。收获细胞前再根据实验需要进行模拟“缺血再灌注”培养。
1.5 核因子κB p65和CXCL16 mRNA实时定量逆转录聚合酶链式反应 (RT-PCR)检测 用Trizol试剂盒抽提细胞总RNA。实时定量RT-PCR使用iScriptTMcDNA合成试剂盒。18 S rRNA作为内对照。实时定量采用SYBR Premix Ex Taq和iQ5实时定量RT-PCR检测系统(BioRad)。核因子 κB p65上游引物:5′-CCTGGAGCAGGCTATCAGTC-3′, 下 游 引 物:5′-ATCTTGAGCTCGGCAGTGTT-3′;CXCL16 上游引物:5′-AAGCTTCCATTCTTGGCTCA-3′, 下 游 引 物:5′-AAGCTTCCATTCTTGGCTCA-3′;18 S rRNA 上游引物:5′-CGGCTACCACATCCAAGGAA-3′,下游引物:5′-GCTGGAATTACCGCGGCT-3′(引物均由北京三博远志公司合成)。逆转录反应:mRNA样品1μg,iScript逆转录酶1μl,5×iScript反应混合物4μl,加无RNase的双蒸水至20μl,轻轻振荡混匀,25℃温育5 min,42℃温热30 min,85℃加热5 min。实时定量RT-PCR反应:cDNA逆转录产物 2μl,上下游引物各 0.4μl,SYBR预混剂 10μl(宝生物 DRR041A),DEPC水(Sigma公司)7.2μl。反应条件:第一步95℃ 30 s,第二步95℃ 5 s后62℃ 30 s,此步运行40个循环,第三步55℃ 15 s,此步运行81个循环。每个样本3孔,取3批实验平均值。
1.6 CXCL16的测定 收集各种实验条件下培养HUVEC的上清液,以1 000 r/min离心5 min(离心半径8 cm)后再取上清液于-80℃低温冻存。应用CXCL16检测试剂盒,采用双抗体夹心酶标免疫分析法测定标本中CXCL16表达水平,与其他相关蛋白无交叉反应。经过彻底洗涤后用底物3,3′,5,5′-四甲基联苯胺 (TMB)显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的CXCL16呈正相关。用酶标仪在450 nm波长下测定吸光度 (OD值),计算样品浓度。每个样本3孔,独立实验3次取平均值。
1.7 WST-1法检测细胞存活率 HUVEC按 (7~8)×103/ml浓度接种到96孔板,200μl/孔。每种实验条件设3孔,按上述实验方法进行siRNA转染和模拟缺血再灌注培养后,均更换正常培养基,继续培养48 h后小心吸弃100μl上清液,加入10μlWST-1液,37℃孵育2 h,震荡1 min,用全自动酶标仪,波长为450 nm,测定各孔OD值,记录结果。整个实验重复3次。细胞存活率= 〔(处理细胞OD值-本底OD值)/(对照细胞OD值-本底OD值)〕×100%。
1.8 统计学方法 采用SPSS 13.0统计软件进行数据处理。计量资料以 (±s)表示,多组间比较采用单因素方差分析,组间两两比较用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组核因子κB p65及CXCL16 mRNA相对表达量比较 对照组、缺血再灌注组、p65 siRNA转染组及缺血再灌注+p65 siRNA转染组核因子κB p65及CXCL16 mRNA相对表达量比较,差异均有统计学意义 (P<0.05);其中对照组、p65 siRNA转染组及缺血再灌注+p65 siRNA转染组核因子κB p65及CXCL16 mRNA相对表达量较缺血再灌注组均降低,差异有统计学意义 (P<0.05,见表1)。
2.2 各组上清液CXCL16表达水平比较 对照组、缺血再灌注组、p65 siRNA转染组及缺血再灌注+p65 siRNA转染组CXCL16表达水平比较,差异有统计学意义 (P<0.05);其中对照组、p65 siRNA转染组及缺血再灌注+p65 siRNA转染组CXCL16表达水平较缺血再灌注组均降低,差异有统计学意义 (P<0.05,见表2)。
表1 各组核因子κB p65和CXCL16 mRNA相对表达量比较(± s,n=16)Table 1 Comparison of relative expression quantity ofκB p65 and CXCL16 mRNA among various groups
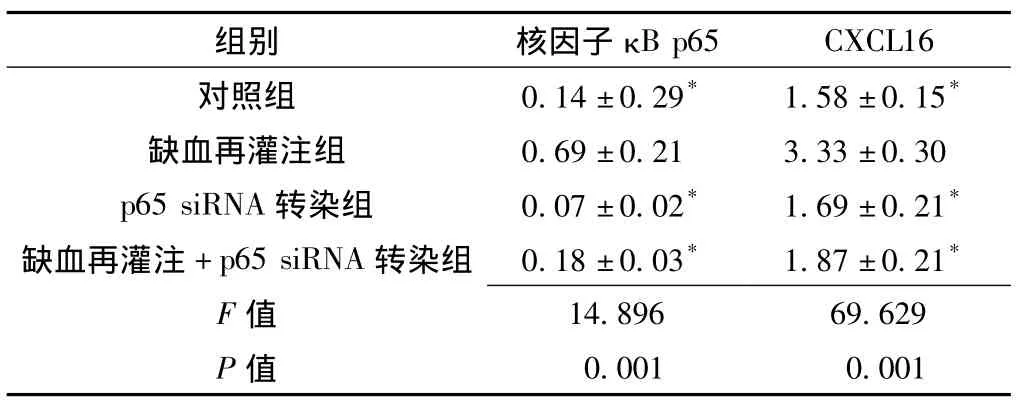
表1 各组核因子κB p65和CXCL16 mRNA相对表达量比较(± s,n=16)Table 1 Comparison of relative expression quantity ofκB p65 and CXCL16 mRNA among various groups
注:与缺血再灌注组比较,*P<0.05
组别 核因子κB p65 CXCL16对照组 0.14 ±0.29* 1.58 ±0.15*缺血再灌注组 0.69 ±0.21 3.33 ±0.30 p65 siRNA 转染组 0.07 ±0.02* 1.69 ±0.21*缺血再灌注+p65 siRNA转染组 0.18±0.03* 1.87±0.21*F 值0.001 0.001 14.896 69.629 P值
表2 各组上清液CXCL16表达水平比较 ± s,ng/ml,n=16)Table 2 Comparison of supernatant CXCL16 expression levels among various groups

表2 各组上清液CXCL16表达水平比较 ± s,ng/ml,n=16)Table 2 Comparison of supernatant CXCL16 expression levels among various groups
注:与缺血再灌注组比较,*P<0.05
组别CXCL16对照组 736±39*缺血再灌注组 1 510±68 p65 siRNA转染组 632±45*缺血再灌注+p65 siRNA转染组 547±32*F 值0.001 509.772 P值
2.3 各组细胞存活率比较 各组实验处理48 h后,WST-1法测定OD值计算细胞存活率。p65 siRNA转染组及缺血再灌注+p65 siRNA转染组细胞存活率较缺血再灌注组均增高,差异有统计学意义 (P<0.05,见表3)。
3 讨论
趋化因子是一组具有趋化作用的细胞因子,CXCL16是近年来新发现的一种清道夫受体,表达在血管内皮细胞、巨噬细胞和血管平滑肌细胞上。是继CX3CL1之后发现的第二个能以膜结合形式和分泌型的可溶性分子存在的趋化因子。除了清道夫受体外,CXCL16还具有趋化激活T细胞、参与树突细胞与T细胞的相互作用、促进细胞增殖和细胞-细胞间黏附等功能,近年来发现其在肿瘤[1-2]、动脉粥样硬化[3]和缺血再灌注损伤[4]中可能起着重要的作用。
表3 各组细胞存活率比较 (±s,%,n=16)Table 3 Comparison of cell survival rates among various cell groups

表3 各组细胞存活率比较 (±s,%,n=16)Table 3 Comparison of cell survival rates among various cell groups
注:与缺血再灌注组比较,*P<0.05
组别 细胞存活率缺血再灌注组 55±6 p65 siRNA转染组 89±10*缺血再灌注+p65 siRNA转染组 70±9*F 值0.001 22.369 P值
在小鼠肝损伤模型中,肝脏炎症损伤组织中CXCL16表达水平增高,膜结合和分泌型CXCL16分别介导了对淋巴细胞的趋化和内皮细胞的黏附[5]。而且,在该模型使用抗CXCL16抗体可显著改善炎症反应、降低丙氨酸氨基转移酶、减轻肝损伤,提示CXCL16在组织炎症损伤中起重要作用。CXCR6是目前所知的CXCL16的惟一受体。CXCR6基因敲除小鼠较野生株有更强的抗缺血再灌注损伤作用,心肌梗死面积小,心功能相对好,反映了CXCL16/CXCR6信号级联在缺血再灌注中的心脏保护作用[4]。本研究通过体外对HUVEC进行模拟缺血再灌注培养,发现模拟缺血再灌注培养能诱导CXCL16 mRNA表达水平上升。值得注意的是,本研究发现体外模拟缺血再灌注可刺激p65,p65是参与组成核因子κB的重要亚基,核因子κB是众所周知的调控炎症反应的核心转录因子。本研究进一步采用siRNA方法来探索是否核因子κB p65参与了缺血再灌注刺激下对CXCL16表达水平的调节。RNA干扰 (RNAi)是指内源性或外源性双链RNA介导的细胞内某特定基因的mRNA发生特异性降解,从而导致靶基因的表达沉默,产生相应的功能表型抑制的现象。因为RNAi技术能高效、特异地使相应基因失活,目前已作为一种简单有效的替代基因敲除的有力工具[6]。本研究中通过siRNA沉默p65基因,特异性阻断其分子生物学作用,导致缺血再灌注情况下CXCL16的表达受到抑制,提示核因子κB对CXCL16的调控作用。WST-1法显示,模拟缺血再灌注不利于细胞生存,而选择性沉默p65却能显著减少细胞死亡率,提示p65可能通过促炎反应等一系列机制促进细胞在缺血再灌注中的损伤。Izquierdo等[7]报道核因子κB可介导CXCL16 mRNA转录增加促进急性肾损伤中的炎症反应。本研究显示了模拟缺血再灌注情况下核因子κB介导CXCL16的表达增加,不利于细胞存活。CXCL16可能作为核因子κB的下游分子发挥作用,即核因子κB可以调节CXCL16促炎,反过来,CXCL16也可以通过核因子κB来发挥炎性效应。例如,CXCL16经由细胞外调节蛋白激酶 (ERK)/IκB激酶/IκB途径活化核因子κB,诱导肿瘤坏死因子α(TNF-α)表达促进炎症反应、加重细胞和组织损伤[8]。此外,CXCL16还可通过Akt/蛋白激酶B(PKB)间接调节核因子 κB活化[9]。
总之,使用siRNA下调人脐静脉内皮细胞p65的表达,可抑制模拟缺血再灌注诱导的内皮细胞CXCL16的表达,促进细胞存活。CXCL16参与缺血再灌注损伤的细胞信号转导途径十分复杂,其具体机制尚有待于进一步深入研究。
本课题人员贡献:曾敏负责文章书写及部分实验操作;魏欣负责文章修改及部分实验操作;李伟、符秀虹、蒙绪卿负责实验指导及部分实验操作;陈积雄、王萍负责实验操作。
本研究创新之处:本研究探讨核因子 κB、CXCL16促进炎症反应导致缺血再灌注损伤的分子机制,显示了对人脐静脉内皮细胞进行模拟缺血再灌注培养能诱导CXCL16 mRNA的表达水平;此外,在模拟缺血再灌注中,CXCL16作为核因子κB的下游分子而发挥作用。
1 Lee JT,Lee SD,Lee JZ,et al.Expression analysis and clinical significance of CXCL16/CXCR6 in patientswith bladder cancer[J].Oncol Lett,2013,5(1):229-235.
2 Deng L,Chen N,LiY,etal.CXCR6/CXCL16 functions as a regulator inmetastasis and progression of cancer [J].Biochim Biophys Acta,2010,1806(1):42-49.
3 Lv Y,Hou X,Ti Y,et al.Associations of CXCL16/CXCR6 with carotid atherosclerosis in patients withmetabolic syndrome[J].Clin Nutr,2013,32(5):849-854.
4 Zhao G,Wang S,Wang Z,etal.CXCR6 deficiency amelioratedmyocardial ischemia/reperfusion injury by inhibiting infiltration ofmonocytes and IFN-gamma-dependent autophagy [J].Int J Cardiol,2013,168(2):853-862.
5 Xu HB,Gong YP,Jiang ZG,et al.The role of CXCL16 in immunological liver injury induced by BCG and LPS in mice[J].Zhonghua Gan Zang Bing Za Zhi,2005,13(4):282-285.
6 Gottumukkala SN,Dwarakanath CD,Sudarsan S.Ribonucleic acid interference induced gene knockdown [J].J Indian Soc Periodontol,2013,17(4):417-422.
7 Izquierdo MC,Sanz AB,Sánchez-Niño MD,et al.Acute kidney injury transcriptomics unveils a relationship between inflammation and ageing [J].Nefrologia,2012,32(6):715-723.
8 Chen T,Guo ZP,Jiao XY,et al.Peoniflorin suppresses tumor necrosis factor-alpha induced chemokine production in human dermalmicrovascular endothelial cells by blocking nuclear factor-κB and ERK pathway [J].Arch Dermatol Res,2011,303(5):351-360.
9 Chandrasekar B,Bysani S,Mummidi S.CXCL16 signals via Gi,phosphatidylinositol3-kinase,Akt,I kappa B kinase,and nuclear factor-kappa B and induces cell-cell adhesion and aortic smoothmuscle cell proliferation [J].JBiol Chem,2004,279(5):3188-3196.

