重组大肠杆菌BL21(pUC19-Hyp)产羟脯氨酸的补料分批培养
袁春伟,何艳春,张胜利,张震宇
(江南大学 生物工程学院 工业生物技术教育部重点实验室,无锡 214122)
羟脯氨酸(hydroxyproline,Hyp)属于手性分子,共有4种立体异构体。本文中所涉及的L-羟脯氨酸为 反 式-4-羟 基-L-脯 氨 酸 (trans-4-hydroxy-L-proline),以下均简称L-羟脯氨酸。L-羟脯氨酸的分布很广,是胶原、明胶、植物细胞壁蛋白质和微生物次生代谢产物的重要组成成分[1]。近些年来L-羟脯氨酸在食品、医药、化妆品方面发挥了不可替代的作用[2],可以作为婴幼儿食品[3]和一些非哺乳动物的饲料添加剂,还起到调节脂肪乳化[4]、抗肿瘤、抗高血压[5]等作用,另外在化妆品方面也具有抗氧化、抗辐射的作用[6]。
L-羟脯氨酸是哺乳动物胶原的重要成分[7],目前国内生产L-羟脯氨酸的方法主要是利用水解法直接从胶原中提取。至于化学合成法,由于生产成本高昂,一般不被采用。水解法存在众多负面作用[8],例如:生产和纯化的步骤较多导致最终产率很低、在生产过程中必须加入一些有毒害作用的溶剂或试剂(亚硝酸等)、有废料产生等。微生物发酵法以脯氨酸(proline,Pro)为底物,运用流加葡萄糖的方法产L-羟脯氨酸,避免了这些负面影响,且对发酵底物的利用率高,过程无毒害,是一种替代传统水解法的理想方法。本文中笔者拟利用自主构建的组成型重组大肠杆菌BL21(pUC19-Hyp)为出发菌株,运用间歇流加、指数流加和恒速流加3种流加C源的方式进行补料分批培养,为其大规模培养提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
大肠杆菌BL21(pUC19-Hyp)由笔者所在实验室成员自主构建,其中脯氨酸羟化酶基因[9]由多拷贝质粒pUC19携带转入宿主菌。
1.1.2 培养基
LB培养基(g/L):胰蛋白胨10、酵母提取物5、琼脂20、NaCl 10;pH 7.0~7.2。
发酵培养基(g/L):葡萄糖10、甘油5、胰蛋白胨8、(NH4)2SO45、K2HPO41、NaCl 2。以下分开灭菌:MgSO40.2 g/L、FeSO43 mmol/L、CaCl20.015 g/L、脯氨酸400 mmol/L。
补料培养基Ⅰ:葡萄糖400 g/L。
补料培养基Ⅱ:质量分数30%左右的氨水。
培养基在接种前加入0.05 g/L的氨苄青霉素(AMP)。
1.1.3 主要设备
BioFlo415 7 L发酵罐(NBS公司);SBA-40 C型生物传感分析仪((山东省科学院生物研究所));L-8900型氨基酸分析仪(日产公司)。
1.2 培养方法
菌种活化:将冷藏于-80℃冰箱的菌种划线接种于LB固体培养基,37℃培养过夜,用活化后的菌种制备斜面种子,保存待用。
种子制备:从斜面培养基挑取单菌落,接种至装有30 mL LB培养基的250 mL三角摇瓶中,37℃、220 r/min摇床培养8 h。
7 L发酵罐中补料分批培养:将种子以6%的接种量接种于装液量为4 L的7 L发酵罐中,温度为35℃,用质量分数为30%的氨水控制pH为6.5以上,通气量为1~3 vvm(vvm表示每分钟通气量与罐体实际料液体积的比值),搅拌转速为400~900 r/min,在发酵过程中,将通气量和搅拌转速一同与溶氧关联,控制发酵罐中的溶氧水平在40%以上,当到达一定时间不能满足40%的溶氧时,便保持最高通气量和最大搅拌速率。每次取样测定A600及发酵液中剩余葡萄糖含量等参数,以残糖的耗尽为标志开始补料,在8 h时,残糖降低到不能满足菌体需求,此时运用不同的流加方式开始补料。
1.3 检测与分析
溶氧测定:本实验中溶氧电极校准方法为转速和通气量均设为初始值(400 r/min、1 vvm),断开溶氧电极与电脑的连接线,此时校准为0,然后所有料液添加完毕,溶氧稳定之后,接种前校准为100%。
葡萄糖浓度测定:发酵液12 000 r/min、4℃冷冻离心2 min后,取上清,用SBA-40 C型生物传感分析仪测定。
全氨基酸测定:L-8900型氨基酸分析仪。
细胞干质量测定方法 :分光光度计测定OD600值,然后依照文献[10]的方法,根据实验数据拟合细胞干质量(dry cell weight,DCW)和菌液 OD600值的回归方程:ρ(DCW)=0.54OD600。
L-羟脯氨酸的测定采用氯胺 T法,参照文献[11]。
2 结果与讨论
在发酵8 h时残糖基本耗尽,经测定葡萄糖质量浓度为0.05 g/L,但此时的溶氧并未出现上升的迹象,主要是因为脯氨酸在羟基化的过程中需要大量O2的参与(图1),这也是发酵过程中溶氧始终维持较低水平的一个重要原因,从而确定初次流加培养基的标志不是溶氧的突然上升,而是残糖的基本耗尽。

图1 羟脯氨酸的生物转化Fig.1 Biotransformation of trans-4-hydroxy-L-proline
2.1 间歇流加方式
间歇流加是将流加操作分为几个间断进行,在各个流加间断的起始即完成流加,其余时间均为分批发酵。间歇流加可以迅速补糖,对发酵的各个间断的葡萄糖消耗情况加以控制,间歇发酵又可分为基于指数关系的间歇流加、基于恒速关系的间歇流加和基于反馈方式的间歇流加等,本实验中采用基于恒速关系的间歇流加。实验分两组进行,间隔2 h补料1次,Ⅰ组每次流加20 g葡萄糖溶液,Ⅱ组每次流加40 g葡萄糖溶液,间隔4 h取1次样(除葡萄糖浓度在补料前后都测定外,其余参数在补料前取样测定)。结果如图2所示。
流加葡萄糖后Ⅰ组和Ⅱ组的葡萄糖瞬时质量浓度分别接近5和10 g/L,但是每次取样在补料前进行,所以测得的葡萄糖浓度是经过菌体一段时间消耗后的残糖浓度。由图2可知:Ⅰ组葡萄糖在每次补料前基本耗尽,Ⅱ组的葡萄糖呈现累积的趋势,说明菌体消耗葡萄糖的速率介于二者之间。在发酵8~16 h时,低浓度的葡萄糖有利于菌体生长;随着菌体的生长,葡萄糖含量逐渐成为Ⅰ组菌体生长的限制性因素,而Ⅱ组在16 h后可较快速生长。但是Ⅱ组在44 h后由于副产物、代谢产物的生成和残糖浓度过高等一系列因素导致生长趋于稳定,Ⅰ组菌体密度继续呈上升趋势。在44 h之前,Ⅱ组的L-羟脯氨酸产量略高于Ⅰ组,之后Ⅱ组略低于Ⅰ组,并且2组L-羟脯氨酸产量均有所降低,主要是副产物或菌体自溶产生的物质将L-羟脯氨酸分解所致,最终Ⅰ组在44 h获得最高 L-羟脯氨酸产量,为27.546 g/L。

图2 间歇流加时残糖浓度、吸光度及L-羟脯氨酸浓度变化Fig.2 Variation tendency of residual glucose concentration,absorbance and Hyp concentration during intermittent flow addition fermentation
间歇发酵过程中,葡萄糖浓度变化剧烈,虽然有些发酵实验中,间歇流加取得了较好的结果,但是本实验证明间歇流加并不利于L-羟脯氨酸的生产,因此就需要寻求另外的流加方式来进一步优化,从本实验中可以看出菌体的耗糖量在10~20 g/h之间。
2.2 指数流加方式
菌体的生长需要一个合适的流加速率,流加速率过高容易产生代谢副产物,流加速率过低影响生产强度的提高。指数流加是一种基于物料平衡理论对某些参数进行合理假设的前置流加控制策略,可使底物的流加与发酵罐中菌体的增长相适应。流加速率F的计算公式[12]:

式中:μ为比生长速率(h-1),t为流加时间(h),X0为细胞质量浓度(g/L),V0为培养物体积(L),(X0V0)也就是在每次流加前测量的发酵罐中细胞量(g),Y为细胞得率(g/g),SF为流加培养基质量浓度(g/L),S为底物质量浓度(g/L)。

表1 指数流加策略中相关参数的设定Table 1 Setting values of relevant parameters in index flow addition strategy
为满足菌体生长时的物料平衡,在菌体的快速生长期采用对数流加策略,快速生长期过后则保持前段时间的流加速率,采用恒速流加。由于流加速率F是一个与时间t有关的指数函数,采用流加软件控制流加速率,使流加速率F随时间t的改变而时时改变。根据间歇发酵的平均比生长速率,该实验分3组进行,比生长速率μ的设定分别为0.12(Ⅰ组)、0.08(Ⅱ组)和0.05(Ⅲ组)h-1。
利用式(1)计算出相应时刻的流加速率F(L/h),并以此速率流加发酵。结果如图3所示。
由图3可知:在8~12 h由于流加速度较慢,此时残糖基本耗尽,在12~20 h根据比生长速率的不同,残糖浓度逐渐出现差距。定时取样测定残糖浓度和及时调控流加速率F可以有效避免葡萄糖过量积累,Ⅰ组、Ⅱ组和Ⅲ组分别在12、16和28 h开始恒速流加,流加速率 F分别为0.561、0.439和0.393 g/L。恒速流加后残糖浓度与发酵时间基本呈一次函数上升,说明后期葡萄糖的单位时间消耗量基本恒定。从发酵液吸光度方面来看,在流加初期Ⅰ组流加速率较快,C源供应充分,细胞密度迅速上升,其余2组细胞密度随残糖的降低而降低,但是后期高浓度的残糖和代谢副产物共同影响菌体生长,细胞密度又随残糖浓度的增大而减小。至于L-羟脯氨酸的产量,由于残糖浓度过高带来的危害导致3组L-羟脯氨酸均过早降解,第Ⅲ组在40 h时L-羟脯氨酸的最大产量为24.809 g/L,尽管指数流加较间歇流加平稳得多,但最终产量却并不理想。
菌体不适合指数流加,对此笔者进一步分析,在菌体生长阶段采用指数流加必须具备一些条件,其一:菌体的生长遵循Monod方程[13]。


图3 指数流加时残糖浓度、吸光度及L-羟脯氨酸浓度变化Fig.3 Variation tendency of residual glucose concentration,OD600and Hyp content during index flow addition fermentation
式中:μmax为最大比生长速率,S为限制性基质浓度,KS为基质半饱和常数,即细胞比生长速率为μmax的一半时的基质浓度。该方程是用来描述无抑制的细胞生长模型,脯氨酸羟化酶为生长耦联型,在羟基化反应中与细胞竞争O2,明显抑制了细胞生长。在接种后5 h,发酵罐中的溶解氧降低到4%左右,从而使得溶解氧成为菌体生长时不可忽略的因素之一。一般发酵时,随着菌体密度的增大,葡萄糖消耗量也随之增大,但是本实验中脯氨酸羟化酶的量也在增大,相应需要更多O2参与脯氨酸的羟基化,从而使得菌体生长受到一定抑制,很难正常指数生长,进而确定该发酵过程不是无抑制的菌体生长,不适合指数流加方式。从残糖浓度看出,菌体对葡萄糖的利用基本恒定,下面采用恒速流加方式进行优化。
2.3 恒速流加方式
恒速流加相对于指数流加在操作上更为简单,只需在补料开始时设定流加速率,不必在过程中改变流加速率。恒速流加时遵循以下物料平衡方程[13]。
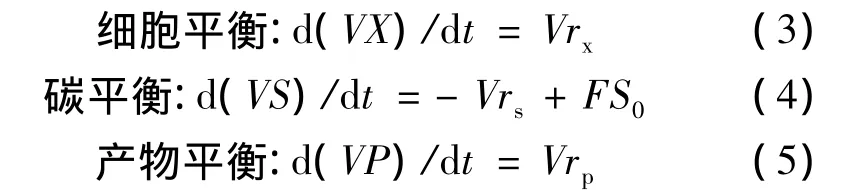
式中:V为培养物体积(L),X为培养基中细胞密度(g/L),rx为细胞生长速率(g/(L·h)),S 为培养基中C源质量浓度(g/L),rs为 C源的消耗速率(g/(L·h)),F 为流加速率(L/h),S0为补料培养基C源质量浓度(g/L),P为培养基中产物质量浓度(g/L),rp为产物形成速率(g/(L·h)),t为时间(h)。实验时对初始流加葡萄糖速率进行控制,测定发酵液中的残留葡萄糖浓度,然后再结合各项指标确定最适流加速率。实验分3组进行,设定的流加速率F分别为0.20(Ⅰ组)、0.30(Ⅱ组)和0.40(Ⅲ组)g/min。
关于溶氧问题,以恒速流加的第Ⅱ组为例进行分析,初始设定溶氧不低于40%,但是在发酵第6小时搅拌转速和通气量均为最大才能满足,在第7小时溶氧便迅速降到4%,且以后一直保持这种低溶氧状态,直到发酵结束,菌体开始自溶后,溶氧才略有上升的趋势。其他流加方式和流加速率的溶氧也与此种类似,流加速率较低的,溶氧略高点,如:恒速流加的第Ⅲ组由于C源不足,溶氧从7 h的4%上升到放罐时的30%。细胞只有在葡萄糖浓度合适的情况下才能既保证自身的生长,又有足够的能量和O2合成L-羟脯氨酸,如果葡萄糖不足,细胞只能维持自身的生长,从而没有多余的能量用来合成L-羟脯氨酸。
从残糖方面分析,如图4所示,前2组残糖都稳定在一定范围,其中Ⅰ组残糖浓度维持在0.05~0.10 g/L,Ⅱ组残糖浓度维持在0.10~0.20 g/L,但是当流加速率再次提高时,残糖含量不再继续稳定在一定范围内,而是产生积累现象,例如:Ⅲ组在16 h之后残糖浓度几乎成一次函数趋势上升,说明此时在物料平衡方面,C源的输入已经大于细胞的消耗,葡萄糖浓度随时间的增长成一次函数上升,说明细胞对葡萄糖的消耗为匀速消耗,即:

式中:F为流加速率,rs为C源的消耗速率,k为发酵液中残糖浓度的增长速率。由图4可知残糖浓度随时间的增长成一次函数上升,说明k近似为常数,又因为该流加方式为恒速流加,所以F也是一个恒定值,因此rs也近似为恒定值。
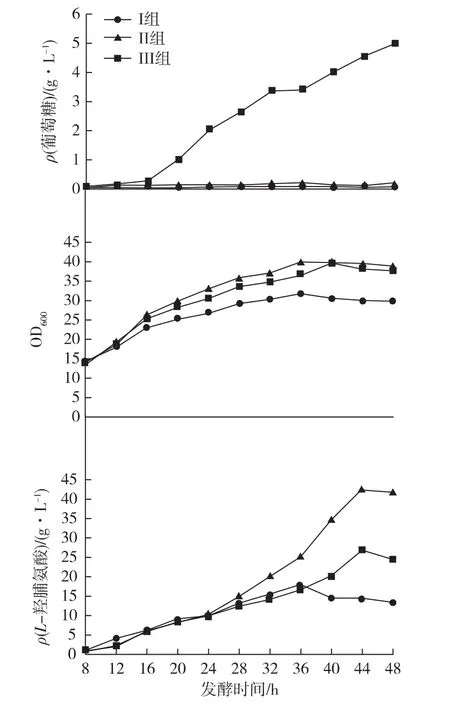
图4 恒速流加时残糖浓度、吸光度及L-羟脯氨酸浓度变化Fig.4 Variation tendency of residual glucose concentration,absorbance and Hyp concentration during constant speed flow fermentation
在菌体密度方面,如图4所示。Ⅰ组由于C源严重不足,限制菌体的生长,生长速率和最大细胞密度都不如其他2组;Ⅲ组由于残糖浓度过高,易产生代谢副产物,影响菌体生长,菌体密度低于Ⅱ组,大致趋势相似,在36 h达到稳定期。最后在L-羟脯氨酸方面进行分析。在24 h之前,3组数据几乎近似一样,没有明显差距,在稳定期(36 h后)差距较为明显,Ⅱ组在44 h时出现最大L-羟脯氨酸产量,42.5 g/L,Pro转化率为81%,可见,0.30 g/min的流加速率对于稳定期产L-羟脯氨酸比较有利,与同种流加方式的其他2种流加速率拉开了较大差距。结合菌体密度和L-羟脯氨酸浓度变化曲线可以看出,L-羟脯氨酸的产生是非生长依赖型的,Ⅱ组的L-羟脯氨酸在发酵中后期产率迅速上升,和其他2组迅速拉开差距,但是在细胞密度方面和Ⅲ组几乎相似,从而可以确定,由于溶氧的限制,合适的流加速率在细胞生长方面帮助较小,在L-羟脯氨酸的产率和稳定性方面有较大帮助。
在工业生产中较低的糖酸比(发酵中消耗的葡萄糖质量与产生的L-羟脯氨酸质量之比)能给企业节约生产成本,带来更大的经济效益,在装液量为4 L的7 L发酵罐中以上述3种流加速率进行恒速流加时的糖酸比如表2所示。

表2 恒速流加时的糖酸比Table 2 Sugar-acid ratio during constant speed flow fermentation
对本实验中的发酵液进行氨基酸分析,分析发酵过程中是否有其他氨基酸产生以及脯氨酸的残留量。测得最终发酵产物中主要氨基酸及浓度如表3所示。
从表3可以看出,除羟脯氨酸和脯氨酸以外的其他氨基酸的含量都很低,其中苯丙氨酸(Phe)的质量浓度为0.098 g/L,在除Pro外的杂氨基酸中含量最高。

表3 氨基酸分析结果Table 3 Analysis results of amino acids
3 结论
利用生物转化法生产L-羟脯氨酸过程中,以0.30 g/min恒速流加葡萄糖溶液使L-羟脯氨酸的产量达到了42.50 g/L。残糖质量浓度对菌体的生长特别是最终产物产量影响较大,将残糖质量浓度控制在0.10~0.20 g/L可使菌体保持较低的比生长速率,有效缓解了菌体因快速生长造成的溶氧不足和代谢抑制物过多带来的危害。L-羟脯氨酸的生物转化是一个耗氧过程,比生长速率的降低可减少氧气用于菌体自身的生长,从而满足HYP生物转化过程中的溶氧需求。
尽管菌体的比生长速率较低,但是溶氧却一直很难满足菌体生长的需要,实验中通入的是无菌空气没有使用纯氧,整个发酵过程溶氧都成为限制性因素,之后的优化可以在增加溶氧方面展开,如:在菌体中导入血红蛋白基因提高细胞的氧气利用率、增加罐压和通入纯氧等。
[1] Gorres K L,Raines R T.Prolyl 4-hydroxylase[J].Crit Rev Biochem Mol Biol,2010,45(2):106-124.
[2] 张自强,赵东旭,杨新林.羟脯氨酸的研究与开发[J].氨基酸和生物资源,2006,28(1):55-58.
[3] Wu G,Bazer F W,Davis T A,et al.Arginine metabolism and nutrition in growth,health and disease[J].Amino Acids,2009,37(1):153-168.
[4] 吴显荣.氨基酸营养[J].氨基酸和生物资源,1988(2):2-3.
[5] 上海医药工业研究院.生化药物·药品集:第七分册[M].上海:上海科学技术出版社,1984:56.
[6] Lam M,Sulindro M.Aging skin[J].Anti-Aging Research Brief,Academy of Anti-Aging Research MMIII,2001(1):1-8.
[7] Kuttan R, Radhakrishnan A N. Biochemistry of the hydroxyprolines[J].Adv Enzymol Relat Areas Mol Biol,1973,37:273-347.
[8] Ryotaro H,Kuniki K.Characterization of novel 2-oxoglutarate dependent dioxygenases converting L-proline to cis-4-hydroxy-L-proline[J].Biochem Biophys Res Commun,2009,379(4):882-886.
[9] 刘合栋,袁春伟,张震宇.高产反式-4-羟脯氨酸重组大肠杆菌的构建以及发酵条件优化[EB/OL].[2013-01-23].http://www.paper.edu.cn/releasepaper/content/201301 -989.
[10] Korz D J,Rinas U,Hellmuth K.Simple fed-batch technique for high cell density cultivation of Escherichia coli[J].J Biotechnol,1995,39(1):59-65.
[11] 彭亚锋,周耀斌,任蕾蕾,等.比色法测定酱油中羟脯氨酸含量的探讨[J].中国调味品,2010,35(2):100-101.
[12] 陈坚,李寅.面包酵母培养过程解析和流加模式研究[J].药物生物技术,1995,2(4):37-42.
[13] 陈坚,堵国成,卫功元,等.微生物重要代谢产物:发酵生产与过程解析[M].北京:化学工业出版社,2005:23-24.

