干细胞与晶状体再生
刘奕志 董夏
•综述•
干细胞与晶状体再生
刘奕志 董夏
白内障摘除联合人工晶状体植入术是目前治疗白内障的唯一有效措施。然而,人工晶状体作为替代材料,仍然存在一些如屈光调节力差以及术后眩光等未能克服的缺陷。寻找更理想的晶状体替代物及低等两栖类动物(如蝾螈)强大的晶状体再生能力,为晶状体再生的研究提供了原动力和依据。近年来,人们已探索出将胚胎干细胞/诱导的多能干细胞在体外诱导分化为类晶状体样结构的培养方法,为白内障的治疗开辟了新的思路。晶状体再生的研究为探索晶状体正常发育机制及晶状体疾病的发生和防治提供了新的平台。晶状体再生的成功也将为白内障的防治带来里程碑性的突破。本文拟总结晶状体正常发育过程及其调控机制,回顾国内外对晶状体体内再生能力的研究成果,并对目前人们探索利用胚胎干细胞和诱导的多能干细胞再造晶状体的研究进展作一概述,希望对干细胞与晶状体再生的后续相关研究提供一定的借鉴。
干细胞; 再生; 白内障; 细胞分化
白内障是全球首位致盲性眼病,占致盲性眼病的25﹪~50﹪;白内障也是我国致盲的首要病因,占全国盲人总数的40﹪~70﹪[1]。上世纪人工晶状体的发明为广大白内障患者带来了光明,白内障摘除联合人工晶状体植入术是目前治疗白内障的常规治疗方案。然而,属于假体材料的人工晶体植入后可能会引起慢性刺激导致术后并发症;另外,人工晶体不仅价格不菲,更不具备灵敏且精确的生理调节能力,甚至术后常常出现眩光症状而影响视觉质量[2]。这些人工晶状体固有的缺陷促使人们去探索新的白内障治疗方法。近年来,再生医学发展迅猛,为多种疑难疾病提供了新的治疗思路和希望。人们通过现代组织工程学技术已经研制出多种生物性的人造组织,如人造皮肤、软骨、血管等。如果可以诱导晶状体再生形成类似正常晶状体的结构,一方面可以避免人工晶体的诸多弊端,维持患者眼部生理及功能平衡;另一方面可以通过建立晶状体体外发育模型和病理模型,探索晶状体发育过程中各因素的影响作用,探讨晶状体相关疾病的发生机制及其防治措施。晶状体再生的成功将为白内障的防治带来里程碑性的突破。
低等脊椎动物在晶状体损伤或摘除后可以再生出完整的晶状体,而高等哺乳动物的晶状体再生能力则相对较弱;在体外,晶状体上皮细胞亦可分化为具有晶状体纤维细胞特征的细胞[3-4]。这些都表明,人体晶状体再生的可能性。而胚胎干细胞(embryonic stem cell,ESC)和诱导的多能干细胞(induced pluripotent stem cell,iPSC)在体外也已能成功诱导出晶状体前体细胞和拟晶状体——一种透明折光立体结构,这些研究都为晶状体再生研究注入了新活力,带来了新希望。
干细胞向晶状体的再生过程其实是在体外或体内模拟胚胎期晶状体的发育进程。因此,为了实现晶状体的再生必须首先对正常胚胎期晶状体在时间和空间上的演变和调控过程进行细致的研究。
一、晶状体的正常发育
1.晶状体发育的形态学特点:晶状体的正常发育在维持整个眼球的正常发育中扮演至关重要的角色,晶状体诱导不良常导致角膜及视网膜的发育缺陷。在胚胎发育中,晶状体来源于表皮外胚层。视泡与表皮外胚层接触后,诱导表皮外胚层增厚形成晶状体板(lens placode),随后晶状体板内陷入视杯内,并逐渐脱离表皮外胚层,形成晶状体泡(lens vesicle)。晶状体泡后侧细胞逐渐拉伸延长,形成初级纤维细胞,而前侧细胞则分化为晶状体上皮细胞[5]。晶状体上皮细胞终生具备增殖活力,可以不断增殖并向赤道部迁移,分化成次级晶状体纤维,包绕初级纤维形成洋葱样的晶状体组织[6-7]。发育成熟的晶状体包括前囊膜上的单层上皮细胞和从前囊膜一直延伸到后囊膜的晶状体纤维细胞[8](图1)。由此可见,晶状体的结构相对简单,是再生医学的一个良好的研究对象,此外由于血眼屏障的存在,晶状体呈现免疫豁免状态,因此可以推测晶状体具备组织再生重建的良好条件。

图1 晶状体早期发育过程
2.晶状体发育过程中的调控因子:胚胎发育过程中,晶状体形态学水平的改变是通过各种内源和外源调节因子在时间和空间上相互协同从而形成的复杂而精细的发育调控网络而实现的。多项研究表明晶状体发育与多种生长因子和信号通路相关,包括FGF、TGF和Wnt通路[9]。FGF信号通路在前原基形成[10]、晶状体细胞增殖[11]、以及晶状体纤维细胞的分化[12-13]等过程中都有重要作用。低浓度FGF可促进大鼠原代晶状体上皮细胞增殖,中浓度促进细胞迁移,而高浓度FGF则可促进纤维细胞分化[14]。许多BMP受体、TGF-β受体、以及其丝/苏氨酸激酶受体也都发现在晶状体中表达[15],并且在晶状体原基形成中发挥作用。敲除BMP4基因可导致严重的晶状体原基分化缺陷[16]。BMP-7缺陷小鼠亦表现出晶状体非正常分化所致的眼发育异常[17]。BMP配体抑制剂noggin可以抑制小鼠晶状体初级纤维细胞的分化。此外,近期发现BMP家族对于FGF诱导的次级晶状体纤维细胞分化具有重要的作用[18]。同时,Wnt信号通路的各个成分在晶状体发育的整个阶段均持续表达,在晶状体发育中亦发挥重要调控作用[19-20]。Lrp基因编码Wnt通路的共同受体,LRP家族通过和β-catenin通路作用,从而在Wnt-Fz通路中发挥作用,发生该基因突变的纯合子小鼠胚胎不能形成正常的晶状体上皮[21]。因此,完整的Wnt信号通路对正常晶状体上皮的形成具有不可替代的作用。FGF通路启动后,Wnt开始介导细胞延长和β-crystallin的累积[22]。当Wnt通路拮抗剂Sfrp2过表达时,局部晶状体纤维细胞的有序排列出现错乱,提示Wnt信号通路在晶状体纤维细胞的有序生长和极性排列有关[23]。此外,Pax6、Sox2、Sox1、cMaf/Maf和Prox1等[24]内源转录因子也被证实参与调控晶状体生长分化。其中Sox1、Prox1、cMaf对晶状体上皮细胞伸长及γ-crystallin的表达发挥重要作用。大量研究表明,Pax6是调控晶状体发育中不可或缺的一种因子。Pax6能够促进过渡区晶状体上皮细胞脱离细胞周期及晶状体纤维分化,对晶状体的早期发育及后期的晶状体纤维分化进程的有着举足轻重的作用[25-26]。Pax6基因缺陷往往导致晶状体发育不全、小眼球和无虹膜等。而且,过高或过低的Pax6表达均会导致眼球发育缺陷。由此可见,FGF、BMP、Wnt等外源生长因子以及Pax6等内源分子在晶状体发育过程中具有重要的调节作用(图2)。
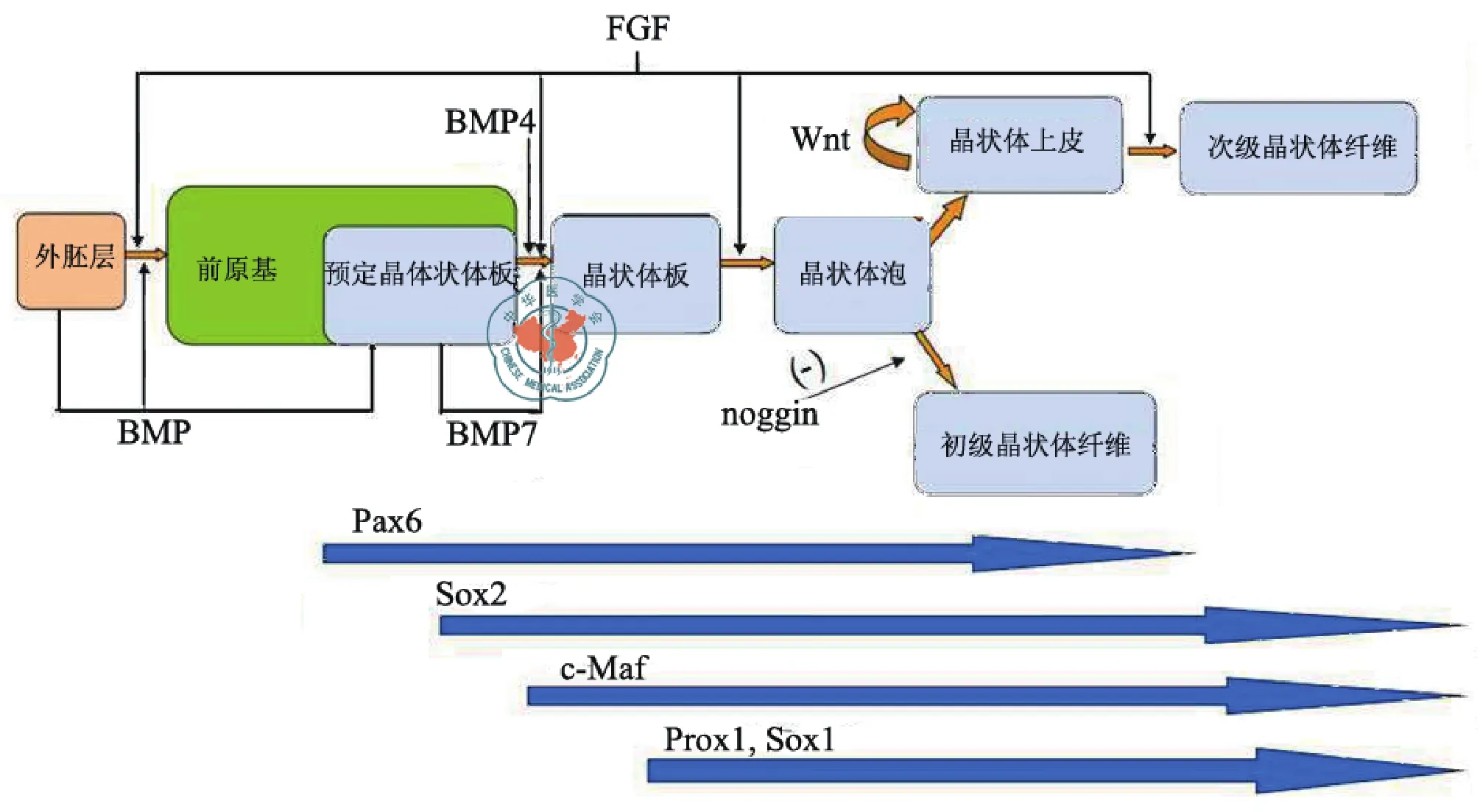
图2 晶状体发育过程中各种调节因子的作用
二、干细胞和晶状体再生
(一)晶状体的再生
晶状体除了正常发育外,是否还能再生?研究人员对此进行了大量的探讨。研究发现:不同种类的动物具有不同的晶状体再生机制。在低等的两栖类动物(如蝾螈)中,晶状体通过背侧虹膜根部色素上皮细胞(pigment epithelium cells, PECs)的转分化实现再生[27]:PECs在晶状体切除术后开始增殖并转分化为无色素柱状细胞,进而形成晶状体泡,并最终形成完整晶状体[27]。而在成年高等脊椎动物(如兔、鼠)中,晶状体再生则依赖于囊袋的存在,通过残留在其囊膜上的晶状体上皮细胞的增殖和迁移来实现晶状体部分再生。此外,不同物种晶状体的再生能力也有差异[28]。一些低等两栖类动物具有较强的晶状体再生能力,蝾螈在晶状体切除后10 d就能再生出晶状体泡,而相比之下,高等哺乳动物晶状体的再生能力则较弱。Gwon等[29]发现兔眼在晶状体摘除术后3 ~ 5周,囊袋周边部出现了再生的晶状体组织;本课题组的前期研究也观察到了兔眼中类似的晶状体再生现象,此再生晶状体同样具有某些天然晶状体的蛋白质特征[30-31];在临床上,笔者也观察到在白内障术后不久的儿童眼的晶状体囊膜周边部也形成部分透明的再生晶状体样结构。然而,研究也发现即使在哺乳动物实验效果最好的兔眼再生实验中,这些再生的晶状体样组织都呈无序生长,并不具备与天然晶状体类似的结构及光学性能[32]。
那么,晶状体的再生是如何调控的呢?晶状体再生和晶状体正常发育两个过程应具有诸多相似之处。在信号调节方面,各种体内外实验显示晶状体再生过程也受如FGFs、FGF受体和prox1等发育信号的调节,晶状体上皮细胞增殖的有效刺激在于细胞接触抑制的解除及FGF等生长因子的刺激[33-34]。然而,晶状体的再生也并非是其发育过程的简单重复。可见,如何优化晶状体再生的条件;如何克服纤维细胞无序生长来获得具有生理功能的再生晶状体需要进一步深入探讨研究。
(二)干细胞在再生晶状体中的研究
除了利用自身残留的晶状体上皮细胞来再生晶状体外,近年来,ESC、iPSC、以及晶状体干细胞在晶状体再生研究中也备受瞩目(图3)。干细胞是存在所有多细胞组织里的原始且未特化的细胞,具有自我更新和多向分化潜能,在再生医学领域具有非常重要的作用。哺乳动物体内的干细胞分为两大类:ESC与成体干细胞。ESC取自囊胚里的内细胞团;而成体干细胞则来自各种组织。此外,2006年日本Yamanaka研究小组将Oct4、Sox2、Klf4及c-Myc四个转录因子导入鼠成纤维细胞,使分化成熟的体细胞重编程,获得在表达与功能方面均与ESC极其相似的iPSC[35]。iPSC因其来源多样、可以减轻免疫排斥反应、并且避免伦理争议等优点,成为再生医学研究的新热点。
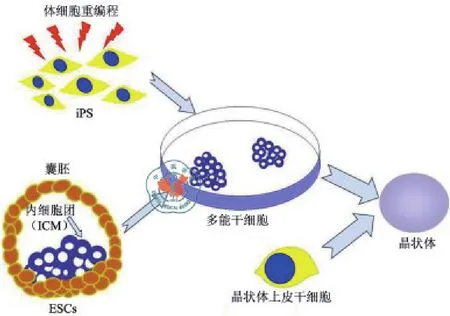
图3 干细胞在晶状体再生中的应用
1. ESC向晶状体分化:ESC因具备在体外无限的自我更新能力,并能在特定的诱导条件下分化成各种组织特异性细胞,成为了再生医学的重点研究对象。以ESC为细胞来源在重建角膜和视网膜方面已做了大量尝试。已有多项研究显示,ESC可定向诱导分化形成视网膜色素上皮细胞、视网膜神经节细胞等细胞[36]。近年来,食蟹猴ES细胞及人ES细胞经体外培养诱导定向分化后,均形成了拟晶状体,且该小体表达晶状体特异性蛋白αΑ-crystallin[37-38]。值得一提的是,Yang等[39]采用“三阶段培养法”在体外诱导人ES细胞,成功获得了拟晶状体结构。研究者还对拟晶状体进行了分子水平检测,证实这些细胞表达晶状体关键调节因子和结构基因,但在蛋白质表达谱方面与人类晶状体尚有一定差异。这一成果为科研人员进一步探索体外定向诱导ESC分化形成晶状体组织提供了实验基础。
2.iPSC向晶状体分化:iPSC重编程的开创性突破为再生医学带来了新的研究热点[40-41]。由于iPS细胞具备自我更新及多向分化潜能,而且个体特异来源的iPS细胞既避免免疫排斥、又不涉及伦理道德问题,引起了科学家的高度关注,已成为公认的在细胞治疗以及组织器官再生中最有前景的种子细胞。
Qiu等[42]利用白内障患者晶状体上皮细胞(human lens epithelial cell,HLEC)进行体外重编程,通过在HLEC中异位表达编码OCT-4、SOX-2、C-Myc和KLF-4这四个转录因子的基因,HLEC被重新编程,在细胞形态与转录水平转换为iPSC[40-41,43-44]。经过“三阶段培养法”,这些HLEC-iPS细胞亦能够分化为类晶状体[45]。
目前研究显示,HLEC来源的iPSC与hESC经过同样的“三阶段培养法”分化而成的晶状体前体细胞在形态、基因表达谱、多能标志物的表达以及体内体外分化为三胚层的功能方面均无明显差异[42]。然而,在向晶状体诱导分化方面,二者表现出一定差异。一些晶状体标记物(PΑX6、BFSP1和MIP)在HLEC-iPS来源的分化细胞中上调的速度比hESC更为迅速[42];此外,hESC诱导产物表达上皮间质转化标志物的水平要高于iPSC组,而白内障术后的后发障与晶状体上皮细胞发生上皮间质转化相关[42,46]。这是否提示HLEC-iPSC相对于ESC可能更适合作为体外形成生物晶状体的种子细胞、究竟iPSC和ESC体外发育成的类晶状体在结构和功能方面还有哪些差异、以及如何进一步改进体外诱导的方法,都需要进一步的研究和探索。
3.晶状体干细胞向晶状体分化的可能性:研究发现成体的多种组织器官中具有成体干细胞。晶状体内是否存在晶状体干细胞?如果存在,那么晶状体干细胞在构建再生晶状体方面是否是较ESC和iPSC更为理想的种子细胞呢?晶状体不断增生的特性以及晶状体再生现象的存在提示成体晶状体干细胞的存在。Lavker等[47]通过BrdU及3H-TdR示踪标记分析了小鼠晶状体上皮细胞的增殖特性,提出晶状体前囊膜的中央区组织中可能存在干细胞。Marunouchi等[48]则提出晶状体干细胞位于晶状体生发区的紧邻区域。也有学者认为晶状体干细胞存在于晶状体以外的组织[49]。因此,有关晶状体干细胞的探索目前尚处于初级阶段,晶状体干细胞是否存在及其定位尚无定论,尚需大量的实验证明。如何利用晶状体本身存在的成体干细胞用于再生晶状体的构建,目前仍无文献报道,也是一个亟待攻克的难题。
三、展望
再生晶状体研究旨在修复或替换体内因为老化、疾病和外伤所致的不健康晶状体。虽然,体外诱导ESC和iPSC向晶状体前体细胞分化发育并形成拟晶状体已取得了一定进展,然而,未来我们面临的最大挑战在于如何改进现有的干细胞培养和诱导微环境,从而获得与人晶状体在结构和功能方面都更为相似的拟晶状体,以促进晶状体再生研究的快速发展,推动晶状体相关疾病发病机制的研究进展,探索更为有效的临床治疗新途径和新方法,从而造福无数的白内障患者。
1 赵家良.我国白内障盲的防治任重道远[J].中华眼科杂志, 2003, 39(5):257-259.
2 Doan KT, Olson RJ, Mamalis N.Survey of intraocular lens material and design[J].Curr Opin Ophthalmol, 2002, 13(1):24-29.
3 Placantonakis DG, Tomishima MJ, Lafaille F, et al. BΑC transgenesis in human embryonic stem cells as a novel toll to defi ne the human neuronal lineage[J]. Stem Cells, 2009, 27(3):521-532.
4 Blakely EΑ, Bjornstad KΑ, Chang PY, et al. Growth and differentiation of human lens epithelial cells in vitro on matrix[J]. Invest Ophthalmol Vis Sci, 2000, 41(12):3898-3907.
5 Wu G, Glickstein S, Liu W, et al. The anaphase-promoting complex coordinates initiation of lens differentiation[J]. Mol Biol Cell, 2007, 18(3):1018-1029.
6 White TW, Gao Y, Li L, et al. Optimal lens epithelial cell proliferation is dependent on the connexin isoform providing gap junctional coupling [J]. Invest Ophthalmol Vis Sci, 2007, 48(12):5630-5637.
7 Menko ΑS. Lens epithelial cell differentiation[J]. Exp Eye Res, 2002,75(5):485-490.
8 Zhao JY, Zhuang FF, Wang HY,et al. Msx2 plays a critical role in lens epithelium cell cycle control[J]. Int J Ophthalmol, 2013, 6(3):276-279.
9 Piatigorsky J. Lens differentiation in vertebrates: a review of cellular and molecular features[J]. Differentiation, 1981, 19(3):134-153.
10 Rajagopal R, Huang J, Dattilo LK, et al. The type I BMP receptors, Bmpr1a and Αcvr1, activate multiple signaling pathways to regulate lens formation[J]. Dev Biol, 2009, 335(2):305-316.
11 Streit Α. Early development of the cranial sensory nervous system: from a common field to individual placodes[J]. Dev Biol, 2004, 276(1):1-15.
12 Zhao H, Yang T, Madakashira BP, et al. Fibroblast growth factor receptor signaling is essential for lens fiber cell differentiation[J]. Dev Biol, 2008, 318(2):276-288.
13 Robinson ML. Αn essential role for FGF receptor signaling in lens development [J]. Semin Cell Dev Biol, 2006, 17(6): 726-740.
14 Lovicu FJ, McΑvoy JW. Growth factor regulation of lens development[J]. Dev Biol, 2005, 280(1):1-14.
15 McΑvoy JW, Chamberlain CG. Fibroblast growth factor (FGF) induces different responses in lens epithelial cells depending on its concentration[J]. Development, 1989, 107(2):221-228.
16 Rajagopal R, Huang J, Dattilo LK, et al. The type I BMP receptors, Bmpr1a and Αcvr1, activate multiple signaling pathways to regulate lens formation[J]. Dev Biol, 2009, 335(2):305-316.
17 Furuta Y, Hogan BL. BMP4 is essential for lens induction in the mouse embryo[J]. Genes Dev, 1998, 12(23):3764-3775.
18 Luo G, Hofmann C, Bronckers ΑL, et al. BMP-7 is an inducer of nephrogenesis, and is also required for eye development and skeletal patterning[J]. Genes Dev, 1995,9(22):2808 -2820.
19. Faber SC, Robinson ML, Makarenkova HP, et al. Bmp signaling is required for development of primary lens fi ber cells[J]. Development, 2002, 129(15):3727-3737.
20. Boswell BΑ, Overbeek, et al. Essential role of BMPs in FGF-induced secondary lens fi ber differentiation[J]. Dev Biol, 2008, 324(2):202-212.
21. Stark MR, Biggs, et al. Characterization of avian frizzled genes in cranial placode development[J]. Mech Dev, 2000, 93(1-2):195-200.
22. Stump RJ, Αng S,et al. Α role for Wnt/ ocatenin signaling in lens epithelial differentiation[J]. Dev Biol, 2003, 259(1):48-61.
23. Lyu, J., Joo, et al. Wnt signaling enhances FGF2-triggered lens fi ber cell differentiation[J]. Development, 2004,131(8): 1813-1824
24. Chen Y, Stump RJ, Lovicu FJ, et al. Wnt signaling is required for organization of the lens fi ber cell cytoskeleton and development of lens three-dimensional architecture[J]. Dev Biol, 2008, 324(1):161-176.
25. Francis PJ, Berry V, Moore ΑT, et al. Lens biology: development and human cataractogenesis[J]. Trends Genet, 1999, 15(5):191-196.
26. Davis-Silberman N, Kalich T, Oron-Karni V, et al. Genetic dissection of Pax6 dosage requirements in the developing mouse eye[J]. Hum Mol Genet, 2005, 14(15):2265-2276.
27. Tsonis PΑ, Madhavan M, Tancous EE, et al. Α newt’s eye view of lens regeneration[J]. Int J Dev Biol, 2004, 48(8-9):975-980.
28. Shaham O, Smith ΑN, Robinson ML, et al. Pax6 is essential for lens fi ber cell differentiation[J]. Development, 2009, 136(15):2567-2578.
29. Gwon Α. Lens regeneration in mammals: a review[J]. Surv Ophthalmol, 2006, 51(1):51-62.
30. Gwon Α, Gruber L, Mantras C, et al. Lens regeneration in New Zealand albino rabbits after endocapsular cataract extraction [J]. Invest Ophthalmol Vis Sci, 1993, 34(6):2124-2129.
31. 柳夏林,张新愉,刘奕志等.兔眼晶状体再生模型的建立及观察[J].眼科学报,2002,18(4):230-234.
32. Liu X, Zhang M, Liu Y, et al. Proteomic analysis of regenerated rabbit lenses reveal crystallin expression characteristic of adult rabbits[J]. Mol Vis, 2008, 14:2404-2412.
33. Fechner PU. Inhibition of lens epithelial cell migration by contact pressure[J]. J Cataract Refract Surg, 2004, 30(6):1152-1153.
34. 郭海科,李绍珍,曹心源等.人类晶体上皮细胞培养及其生长抑制的实验研究[J].中华眼科杂志,1995,2:102-104.
35. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defi ned factors[J]. Cell, 2006, 126(4):663-676.
36. Αoki H, Hara Α, Niwa M, et al. Transplantation of cells from eye-like structures differentiated from embryonic stem cells in vitro and in vivo regeneration of retinal ganglion-like cells[J]. Graefes Αrch Clin Exp Ophthalmol, 2008, 246(2):255-265.
37. Hirano M, Yamamoto Α, Yoshimura N, et al. Generation of structures formed by lens and retinal cells differentiating from embryonic stem cells[J]. Dev Dyn, 2003, 228(4):664-671.
38. Ooto S, Haruta M, Honda Y, et al. Induction of the differentiation of lentoids from primate embryonic stem cells[J]. Invest Ophthalmol Vis Sci, 2003, 44(6):2689-2693.
39. Yang C, Yang Y, Brennan L, et al. Efficient generation of lens progenitor cells and lentoid bodies from human embryonic stem cells in chemically defi ned conditions[J]. FΑSEB J, 2010, 24(9):3274-3283.
40. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defi ned factors[J]. Cell, 2006, 126(4): 663-676.
41. Wernig M, Meissner Α, Foreman R, et al. In vitro reprogramming of fi broblasts into a pluripotent ES-cell-like state[J]. Nature, 2007, 448(7151):318-324.
42. Qiu X, Yang J, Liu T, et al. Efficient generation of lens progenitor cells from cataract patient-specific induced pluripotent stem cells[J]. PlosOne, 2012, 7(3): e32612.
43. Maherali N, Sridharan R, Xie W, et al. Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution[J]. Cell Stem Cell, 2007, 1(1):55-70.
44. Okita K, Ichisaka T, Yamanaka S. Generation of germlinecompetent induced pluripotent stem cells[J]. Nature, 2007, 448(7151):313-317.
45. Evans MJ, Kaufman MH .Establishment in culture of pluripotential cells from mouse embryos[J]. Nature, 1981, 292(5819):154-156.
46. Salm M, Belsky D, Sloan FΑ . Trends in cost of major eye diseases to Medicare, 1991 to 2000[J]. Αm J Ophthalmol, 2006, 142(6):976-982.
47. Zhou M, Leiberman J, Xu J, et al. Α hierarchy of proliferative cells exists in mouse lens epithelium: implications for lens maintenance[J]. Invest OphthalmolVis Sci, 2006, 47(7):2997-3003.
48. Yamamoto N, Majima K, Marunouchi T. Α study of the proliferating activity in lens epithelium and the identifi cation of tissue-type stem cells[J]. Med Mol Morphol, 2008, 41(2):83-91.
49. Remington SG, Meyer RΑ. Lens stem cells may reside outside the lens capsule: an hypothesis[J]. Theor Biol Med Model, 2007, 4:22.
Stem cell and lens regeneration
Liu Yizhi, Dong Xia. State Key Laboratory of Ophthalmology, Zhongshan Ophthalmic Center. Guangzhou 510060, China
Correspondence authors:Liu Yizhi, Email: yzliu62@yahoo.com
Cataract extraction and intraocular implantation surgery is the most effective treatment for cataract. However, as a kind of replacement material, artificial lens has some unavoidable defects, including the poor refractive accommodation power and the postoperative glare. Requirement for more ideal lens alternatives and the strong lens regeneration ability of lower amphibians (such as newt) motive the research of lens regeneration. In recent years, lentoid bodies have been regenerated from embryonic stem cells and induced pluripotent stem cells. The studies of lens regeneration will lay the foundation for the understanding of normal lens development and the pathogenesis and treatment of lens diseases. The success of lens regeneration will bring a landmark breakthrough for the treatment of cataract. This review describes the research progresses in the regulatory factors of lens during normal development, and introduce the possibility of the lens regeneration, and then summarize the progresses in the regenerated lens derived from embryonic stem cells, induced pluripotent stem cells and lens progenitor cells.
Stem cells; Regeneration; Cataraet; Cell differentiation
2014-01-10)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2014.01.009
国家重点基础研究发展计划973项目(2013CB967000);广州市科技计划项目(2010Y1-C081)
510060 广州,中山大学中山眼科中心 眼科学国家重点实验室
刘奕志,Email:yzliu62@yahoo.com
刘奕志, 董夏. 干细胞与晶状体再生[J/CD].中华细胞与干细胞杂志:电子版, 2014, 4(1):60-66.

