长链非编码RNA在癌症中的研究进展*
李艳利 张诗梦 汪菊 金由辛
①副教授,③硕士研究生,④教授,上海大学生命科学学院,上海 200444;②硕士研究生,共同第一作者,南京医科大学第一临床医学院,南京 210029
*国家自然科学基金项目(31170750)资助
长链非编码RNA在癌症中的研究进展*
李艳利①张诗梦②汪菊③金由辛④
①副教授,③硕士研究生,④教授,上海大学生命科学学院,上海 200444;②硕士研究生,共同第一作者,南京医科大学第一临床医学院,南京 210029
*国家自然科学基金项目(31170750)资助
lncRNA;癌症;转录后调控
长链非编码RNA(long noncoding RNA, lncRNA)是一类转录本长度超过200个核苷酸的非编码RNA,通常不编码蛋白质。随着研究的进展,人们发现lncRNA来源复杂、功能各异,在表观遗传学、转录水平、转录后水平等多个水平发挥着重要的作用。笔者旨在介绍lncRNA的来源及生物学功能,并着重阐述其在癌症生物学中的研究进展。
人类基因组计划研究结果表明,人类基因组仅含约20 000个蛋白质编码基因,占整个基因组序列的比例<2%,而4%~9%的基因组序列被转录为非编码RNA(noncoding RNA, ncRNA),其中具有重要调控作用的ncRNA有微小RNA(microRNA)、长链ncRNA(long noncoding RNA, lncRNA)等[1-2]。lncRNA广泛地存在于真核生物的细胞核与细胞质中,一般长度为200 bp到100 kb,缺乏明显的开放式阅读框,无或少有蛋白质编码功能,在生物体的多个水平(表观遗传学、转录水平、转录后水平等)调控基因的表达[1]。lncRNA因对细胞有重要的调节作用而成为近来研究的热点。已有的研究表明,lncRNA特异性的表达与癌症等多种疾病的发生发展有关,本文将就lncRNA的主要来源、生物学功能及其在癌症生物学中的研究进展做一综述。
1 lncRNA的来源
绝大多数的lncRNA由 RNA聚合酶II转录生成,其来源主要包括以下5个方面(图1)[2]:①编码蛋白的基因结构(左)被破坏而变成具有功能的lncRNA(右),如无活性的X染色体的特异转录本(X-inactive specific transcript, Xist)的产生即经历了一个从原始蛋白编码基因到合并了一些可转座序列的变化过程;②两个不转录且完全分隔开的序列在染色体重排后合并成含有多个外显子的lncRNA,例如狗的一个ncRNA(表达序列标签为BM537447、CO597044和DN744681)的产生就是经历了这种变化;③基因经反转录转座产生具有功能的非编码返座基因或不具功能的非编码返座假基因,如在鼠中发现的Neat2(nuclear enriched abundant transcript 2)和AK019616(a mouse testisderived lncRNA);④lncRNA基因(右)中邻近重复序列发生两次串联重复事件,如在真兽亚纲动物中发现的印记基因簇中的lncRNA基因Kcnq1ot1;⑤可转座元件的插入(图中绿三角形)而产生有功能的lncRNA基因,这在啮齿动物与类人猿中有所发现,即BC1(brain cytoplasmic RNA 1)和BC200(brain cytoplasmic RNA 200-nucleotide)。
随着生物信息学的发展,有关lncRNA的数据库也逐渐形成和完善(表1)[1]。

图1 lncRNA的来源[2]
2 lncRNA的生物学功能
lncRNA起初被认为是转录的“噪音”,是RNA聚合酶II转录的副产物,不具有生物学功能。然而,近年来的许多研究表明,lncRNA以RNA的形式调控蛋白编码基因在表观遗传水平、转录水平、转录后水平等多种层面的表达调控,并且参与了染色体沉默、基因组印记现象,以及染色质修饰、转录激活、转录干扰、转录后调控、核内运输、调节原癌基因活化等多种重要的调控过程[3]。它既可以抑制蛋白编码基因的表达,亦可活化某些蛋白编码基因表达,作用机制也多种多样。
目前人们所认为的lncRNA的功能归类为如下9种(图2):①在编码蛋白基因的上游非编码的启动子区(棕红色)转录出lncRNA,抑制RNA聚合酶Ⅱ的募集从而下调邻近的下游基因(蓝色)表达,如在啤酒酵母中发现的一种非蛋白编码基因转录出的RNA SRG1能够干扰基因SER3的表达[3];②在编码蛋白基因的上游非编码的启动子区(棕红色)转录出lncRNA,介导染色质重塑及组蛋白修饰从而激活下游基因的表达,譬如在酿酒酵母中发现的2个PHO84的反义转录本能够通过介导组蛋白的去乙酰基化而抑制PHO84的转录[3];③lncRNA(紫色,反义转录本)与蛋白编码基因的正义转录本(核内不均一RNA, hnRNA)部分碱基互补配对形成杂合双链,阻止剪接体识别hnRNA上的剪接位点,进而干扰mRNA的剪切,产生不同的剪切形式,如天然反义转录本(natural antisense transcript, NAT)能参与调控Zeb2蛋白的可变剪接[3-4];④通过与蛋白编码基因的转录本形成互补双链,进一步在Dicer酶作用下产生内源性的siRNA,调控基因的表达水平,如在秀丽隐杆线虫中发现,当过表达饥饿状态高表达的ncRNA rncs-1(RNA noncoding, starvation up-regulated)时,体内的siRNA也随之增加[3];⑤通过结合到特定蛋白质上,lncRNA转录本能调节相应蛋白质的活性,如在脊椎动物中发现的Dlx2蛋白(the homeodomain-containing protein)仅在结合Evf-2 ncRNA后才能被激活,从而发挥其转录增强因子的作用[3];⑥作为结构组分与蛋白质形成核酸蛋白复合体,如在哺乳动物中lncRNA MEN ε/β是作为亚细胞核副斑(paraspeckle)的关键RNA组分,在核副斑的形成过程及结构稳定的维持中发挥重要作用[3];⑦通过结合到特定蛋白质上改变该蛋白的细胞质定位,如NRON (noncoding repressor of NFAT)能介导转录因子NFAT(nuclear factor of activated T cells)的核转运,即专一性抑制NFAT在核内的积累,进而调控其靶基因的转录[3];⑧作为小分子RNA,如miRNA、piRNA的前体分子转录[3];⑨通过碱基互补配对原则识别结合RNA诱导的沉默复合体(RNA-induced silencing complex, RISC)中的miRNA,发挥miRNA海绵吸附作用,从而抑制miRNA的调控功能[5-7]。虽然近些年来关于lncRNA的研究进展迅速,但绝大部分的lncRNAR的功能仍然是不清楚的。
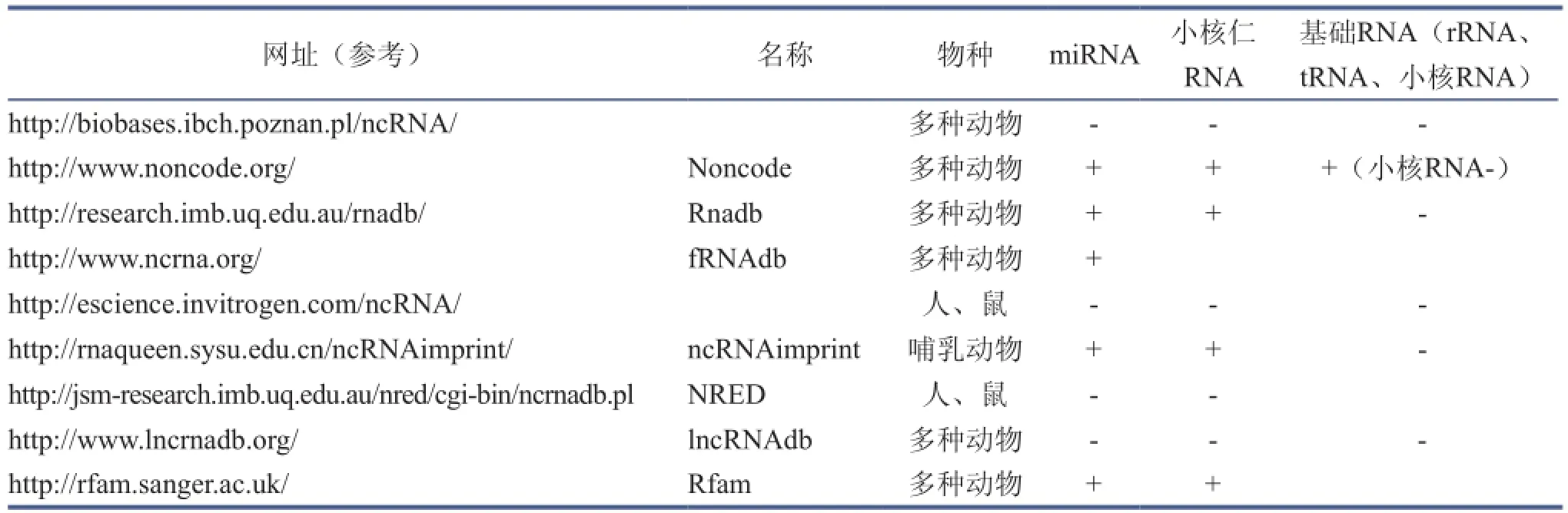
表1 公共lncRNA数据库[1]
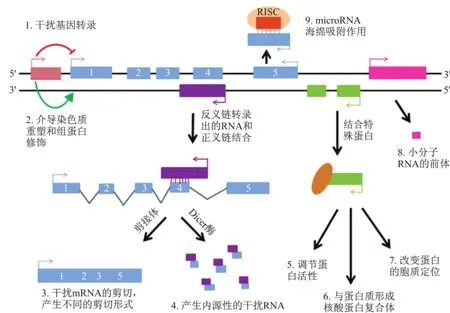
图2 lncRNA的生物学功能
3 lncRNA在癌症中的研究
随着对lncRNA在细胞生物学中的功能的深入研究,大量临床观察和实验显示,失调的lncRNA可通过多种途径调节DNA甲基化、组蛋白修饰、染色质重塑和作为miRNA的前体,在肿瘤的发生和发展中发挥重要作用。现就中国发病率较高的肿瘤与lncRNA的关系做一个总结。
3.1 肺癌
自从在非小细胞肺癌(non-small cell lung cancer, NSCLC)中发现lncRNA转移相关肺腺癌转录本1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)以来,人们一直在探讨MALAT1在肺癌癌变中的机制。Tano等[8]采用基因敲除和基因表达芯片技术,发现下调MALAT1表达后,癌细胞的迁移受到明显抑制,且AIMI、LAYN、CTHRC1等与细胞运动相关基因表达下调,而细胞增殖并未受到影响。Schmidt等[9]采用原位杂交技术分析了352 例NSCLC及其癌旁组织,发现35%高表达MALAT1,其表达与腺癌和大细胞癌高度相关,而与性别、年龄、吸烟、肿瘤大小、淋巴结转移、肿瘤分期及鳞状细胞癌无关,但是MALAT1高表达与鳞状细胞癌患者的不良预后有关。在小鼠胚胎成纤维细胞NIH3T3中过表达MALATl,显著增加了该细胞的迁移能力,同时发现细胞生长、运动、增殖、信号传导和免疫调控等相关基因表达均上调。抑制NSCLC细胞系A549中MALAT1的表达,在体外能明显抑制细胞迁移,在体内则明显抑制细胞生长。这些结果提示MALAT1具有促进肿瘤生长的功能,其表达水平与肿瘤患者的生存期呈负相关。Gutschner等[10]通过锌指核酸酶(zinc-finger nucleases, ZFNs)技术建立MALAT1敲除的肺癌细胞,发现与野生型的肿瘤细胞相比,MALAT1缺失模型的肿瘤体积更小、转移程度更低,其缺失是通过下调基因的表达而不是选择性剪接发挥作用,MALAT1的反义寡核苷酸则能抑制其对瘤体转移的促进作用。这也为肺癌的治疗提供了新的潜在的靶点。
Nakagana等[11]采用实时定量PCR(quantitative real-timePCR, qRT-PCR)的方法对77例NSCLC组织中的lncRNA HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)表达水平进行检测,发现其中有17例NSCLC中的HOTAIR表达水平是正常组织中的2倍以上,并且肿瘤体积越大、TN分期越高、淋巴转移越严重、术后患者的无癌间期越短,以及脑部转移能力越强,HOTAIR的高表达水平也就越高。体外的实验也表明,高表达HOTAIR的NSCLC细胞 A549的迁移能力及非贴壁生长的能力增强。这些都显示了HOTAIR与肺癌的发生与发展相关。Ono等[12]检测了35 例小细胞肺癌(small cell lung cancer, SCLC)临床样品,以及10种SCLC细胞系中HOTAIR的表达情况,发现它在单纯的SCLC组织中表达水平明显升高,且与淋巴结转移和复发呈正相关。体外实验的研究发现下调SCLC细胞系SBC-3的HOTAIR表达可以抑制细胞活性及侵袭能力,同时与细胞黏附相关基因如ASTN1、PCDHA1以及黏蛋白相关的基因MUC5AC表达上调,神经元生长和信号转导相关基因NTM和PTK2B表达则下调。结果提示HOTAIR在SCLC中起着癌基因的作用,可能作为诊断标志物和治疗的靶标。
Qiu等[13]的研究显示lncRNA结肠癌相关转录本2(coloncancer-associated transcript 2, CCAT2)在NSCLC组织中显著高表达,其表达水平约为癌旁组织的7.5倍,其高表达只与腺癌有关,与鳞癌无关。下调CCAT2表达可以明显抑制NSCLC细胞的增殖和侵袭。
Han等[14]通过检测50例NSCLC及癌旁组织,发现肺癌组织中的lncRNA生长阻滞特异性基因6的反义RNA1(growth-arrest-specific gene 6 antisense RNA 1, GAS6-AS1)呈显著低表达,且与肿瘤的淋巴结转移和远端转移能力呈负相关。结果提示GAS6-AS1可能在肺癌的发生发展中起着抑癌基因的作用。Lu等[15]检测了44例NSCLC组织及7种NSCLC细胞株中lncRNA母系表达基因3(materally expressed gene3, MEG3),结果显示MEG3的表达均显著下调,其低表达与肿瘤的分期及体积大小呈负相关。体外实验的结果表明,高表达MEG3能显著促进NSCLC细胞SPCA-1和A549的生长、抑制其凋亡,但对细胞的侵袭没有影响,体内实验结果也显示高表达MEG3的NSCLC细胞SPCA-1生长受抑制。结果提示MEG3在NSCLC中起着抑癌基因的作用。
此外,Yang等[16]采用芯片技术发现3种lncRNA(BX648420、ENST00000366408和AK126698)在A549细胞的顺铂耐药性方面起着重要作用,其中AK126698可以通过靶向Wnt通路介导肺癌治疗中的顺铂耐药性。然而,这些lncRNA与肺癌的具体作用机制尚不清楚。
3.2 胃癌
lncRNA在胃癌领域的研究才刚刚起步。Yang等[17]通过对20例胃癌患者的胃癌组织进行qRT-PCR分析发现,相比较正常的胃组织,胃癌组织中的lncRNA结肠癌相关转录本1(CCAT1)显著升高,且其高表达与原位瘤的生长、淋巴结转移及远端转移呈正相关。细胞水平的实验结果显示,CCAT1的高表达可以促进细胞的增殖和迁移。接着对其作用方式的研究发现,转录因子c-Myc可通过直接结合到CCAT1的启动子区域的E-box元件上启动CCAT1的转录,从而促进胃癌细胞的增殖与迁移,下调c-Myc的表达则降低CCAT1的表达水平,胃癌细胞的增殖和迁移也减缓。
Song等[18]用lncRNA微阵列芯片技术发现,相较于正常的癌旁胃组织,胃癌组织中有135个lncRNA的表达水平变化大于2倍,其中下调较明显的是FER1L4、uc001lsz、BG491697、AF131784和uc009ycs,而上调较显著的是H19、HMlincRNA717、BM709340和BQ213083。研究还发现,H19在胃癌和肝癌细胞系中高表达,而在肺癌和前列腺癌细胞系中低表达;uc001lsz在胃癌、肺癌和肝癌细胞系中低表达,而在前列腺癌细胞系中高表达,并且uc001lsz的低表达与胃癌的TNM分期相关,提示其低表达可能作为胃癌早期的诊断标志物。Yang等[19]发现,H19在胃癌组织和胃癌细胞系中表达显著升高,上调表达H19可促进胃癌细胞的增殖,而下调H19后可导致胃癌细胞的凋亡。RNA免疫共沉淀及RNA Pull down实验结果显示,H19可以与p53蛋白相结合,上调H19表达水平可以抑制p53蛋白的表达并降低p53靶基因Bax的表达水平。这些结果表明H19高表达与胃癌的分子病因学密切相关,并且在胃癌治疗方面具有潜在的应用价值。还有研究显示,另外3种lncRNA,即小泛素样修饰蛋白1假基因3(small ubiquitin-like modifier 1 pseudogene 3, SUMO1P3)、长链基因间非编码RNA00152(long intergenic non-coding RNA 00152, LINC00152)和肝癌中高度上调的lncRNA(highly upregulated in liver cancer, HULC),在胃癌组织中表达显著升高。SUMO1P3高表达与肿瘤大小、分化情况及淋巴转移呈正相关[20]。LINC00152在胃癌患者的胃液及胃癌细胞系中表达水平也明显上升,且与肿瘤的侵袭能力呈正相关[21]。HULC在胃癌细胞系中表达明显上调,且与肿瘤的淋巴结转移、远端转移能力呈正相关[22],上调胃癌细胞系中HULC的表达可促进细胞增殖和侵袭能力、抑制细胞凋亡,下调其表达则表现出相反的结果[22]。
Sun等[23]对检测了72例胃癌组织中lncRNA MEG3的表达水平,结果发现MEG3在胃癌组织中表达明显下降,是正常胃组织中的0.377倍,但是其低表达与患者年龄、性别、淋巴结转移等没有相关性。细胞水平的研究结果也显示高表达MEG3可以抑制胃癌细胞的增殖,促进胃癌细胞的凋亡,抑制MEG3的表达则可促进胃癌细胞的增殖。此外,相关机制研究结果提示MEG3的表达受到甲基化修饰的调控,细胞内高表达MEG3能促进p53蛋白的表达水平。这些结果表明MEG3的低表达在胃癌的发生发展中起着重要的作用。Sun等[24]还报道了胃癌组织中的lncRNA AC096655.1-002含量显著降低,且其低表达与肿瘤的淋巴结转移、远端转移、肿瘤分期及分化成正相关。
3.3 肝癌
肝癌在中国的死亡率仅次于胃癌和食管癌,也是研究的重点。Lai等[25]研究发现lncRNA MALAT1在9株肝细胞癌(hepatocellular carcinoma, HCC)细胞系中均高表达,其中4株细胞系中表达水平为正常肝细胞的2倍以上,在52对肝癌和相应的癌旁组织中,38例肝癌组织中的MALAT1表达水平明显高于癌旁组织。为了研究MALAT1在肝癌进展中的作用,研究人员进一步检测了60例接受肝移植治疗的肝癌患者的肝癌组织中MALAT1的表达水平,分析发现高表达MALAT1与年龄、性别、肿瘤大小、组织学分期及门静脉癌栓没有相关性,而与肿瘤的数量及术前甲胎蛋白(alpha fetal protein, AFP)含量呈正相关,并且3年无疾病生存率明显降低,尤其是超出米兰标准(用于衡量和定义早期肝癌的,指单个肿瘤直径不超过5 cm或较多发的肿瘤少于3个并且最大直径不超过3 cm,没有大血管侵犯现象,也没有淋巴结或肝外转移的现象)的患者更可能在肝移植后肝癌复发。此外,下调肝癌细胞HepG2中MALAT1的表达能明显抑制细胞增殖、迁移和浸润,增加细胞对凋亡刺激的敏感性。这都表明MALAT1在肝癌的发展及转移中起着重要作用,可以作为肝移植后肿瘤复发的标志物及药物治疗的新靶点。
Yang等[26]采用qRT-PCR方法检测了110对肝癌及癌旁组织(其中60个肝癌患者进行了肝移植)中HOTAIR的表达,发现HOTAIR在肝癌组织中明显高表达,且在肝移植病人中可能作为肝癌复发的独立标志物,在超出米兰标准的患者中,HOTAIR高表达病人的无复发生存期明显缩短。细胞水平的研究也显示下调肝癌细胞中HOTAIR的表达能明显降低细胞活力及迁移能力,增加细胞对TNF-α诱导凋亡的敏感性及对化疗药物顺铂和阿霉素的敏感性。随后,Geng等[27]检测了63例肝切除HCC患者中HOTAIR的表达情况,结果也显示在癌组织中表达水平明显升高,并且与淋巴结转移呈正相关,HOTAIR高表达HCC患者肝脏切除后复发的风险性也高。体外研究的结果还表明下调HCC细胞中HOTAIR的表达,明显抑制细胞增殖,且与细胞运动及转移相关的分子基质金属蛋白酶9(matrix metalloproteinase-9, MMP9)和血管内皮生长因子(vascular endothelial growth factor, VEGF)在细胞内的表达量也明显降低。这些结果提示HOTAIR可能作为HCC淋巴结转移的潜在标志物。由于HCC患者血管生成活跃,其生存率仍然较差。然而HCC中血管生成的具体机制仍不十分清楚。Yuan等[28]研究发现HCC中微血管浸润(microvascular invasion in HCC, MVIH)相关的lncRNA MVIH在HCC组织中高表达,在215例HCC患者中,MVIH的高表达与微血管浸润率及较高的肿瘤淋巴结转移分期呈正相关,而无复发生存率和总生存期均明显降低。小鼠动物模型中的研究结果还显示,MVIH通过激活血管生成进而促进肿瘤的生长和肝内转移。
随着研究的进展,发现lncRNA在乙肝病毒(viral hepatitis type B, HBV)相关性HCC中发挥着重要作用。Yang等[29]采用微阵列和qRT-PCR等方法分析了HBV相关肝癌中差异表达的lncRNA,发现HEIH(HCC中高表达, high expression in HCC)的表达水平与肝癌复发显著相关,是一个独立的生存预后因素。研究还发现,HEIH在肝癌细胞系中高表达,下调其表达可以抑制细胞增殖,将细胞阻滞在G0/G1期。研究结果表明HEIH是一种促癌的lncRNA,并提示它可能是肝癌发展中重要的调控中心。Panzitt等[30]采用cDNA芯片技术检测了46例HCC组织,首次发现在肝癌中高度上调表达(highly up-regulated in liver cancer, HULC)的lncRNA。Liu等[31]发现HULC中的rs7763881位点的变异基因型降低了HBV顽固携带者患肝癌的风险性。Xie等[32]检测了30例 HCC患者及20例正常人肝组织及血浆中HULC的表达水平,结果显示HULC在HCC组织及血浆中均明显高表达,且其表达水平与Edmondson的分级和(或)HBV+的肝癌患者呈正关。Huang等[33]研究发现HBx(Hepatitis B Virus X Protein)转基因小鼠中下调表达的lncRNA Dreh(down-regulate dexpression by HBx, Dreh)作为肿瘤抑制因子能够在体内及体外抑制HBV-HCC细胞的生长和转移,其机制是Dreh可与中央丝蛋白结合抑制其表达,从而改变正常的细胞骨架结构以抑制肿瘤转移。该研究还发现了人Dreh的同源RNA(hDREH)在HBV相关的HCC中通常是下调的,这与肝癌的生存率差相关。该研究表明Dreh在HBV相关HCC中发挥抑癌作用,有望成为预言其生存期的新型生物标志物,也可能成为治疗新靶点。
3.4 食管癌
食管癌是人类常见的恶性肿瘤,其死亡率仅次于胃癌。Lü等[34]等采用原位杂交和qRTPCR方法分别检测了93对石蜡包埋和30对新鲜的食管鳞癌(esophageal squamous cell cancer, ESCC)及对应的癌旁组织中HOTAIR的表达水平,发现在ESCC组织中表达显著升高,并且和瘤体大小、临床分期、淋巴结转移呈正相关,与肿瘤分化程度及5年生存率呈负相关。细胞水平的研究也显示下调HOTAIR后,细胞增殖、克隆形成及侵袭迁移能力均被明显抑制。该研究提示HOTAIR在ESCC的发展中起着重要作用,有可能成为其诊断标志物。随后3个研究小组也分别证实了HOTAIR在ESCC中高表达,起着促癌作用[35-37]。Ge等[37]还报道了HOTAIR可通过促进组蛋白H3K27甲基化、抑制WIF-1基因表达进而激活Wnt信号通路来促进ESCC细胞的转移。Wang等[38]用qRTPCR方法检测了73对ESCC及其癌旁组织,发现前列腺癌上调的lncRNA1(prostate cancer-upregulated long noncoding RNA1, PlncRNA-1)在ESCC组织中表达水平明显升高,其高表达与肿瘤的临床分期及淋巴结转移呈正相关,体外的研究也显示敲除PlncRNA-1能抑制细胞增殖、促进细胞凋亡。Li等[39]分析了360对ESCC及癌旁组织中长链基因间非蛋白编码RNA(long intergenic non-protein coding RNAs, lincRNAs),发现由紧邻转录因子POU3F3的基因编码的lincRNA(lincRNA encoded by a gene located next to POU3F3, linc-POU3F3)在ESCC中显著高表达,在ESCC细胞内上调linc-POU3F3表达后可促进细胞增殖及克隆形成,使POU3F3 mRNA表达水平降低,下调linc-POU3F3则使POU3F3 mRNA水平升高。其机制是linc-POU3F3与组蛋白甲基化酶EZH2 mRNA相互作用,促进POU3F3基因的甲基化水平。下调linc-POU3F3后的ESCC细胞在动物体内的生长也明显减慢。
Wu等[40]研究发现lncRNA肌动蛋白纤维相关蛋白1反义RNA1(actinlament-associated protein 1-antisense RNA1, AFAP1-AS1)在食管腺癌中极度低甲基化和过表达,利用siRNA沉默AFAP1-AS1的表达可以在不改变其对应编码蛋白AFAP1的情况下抑制食管癌细胞的增殖、浸润和转移的能力,诱发细胞凋亡。
3.5 乳腺癌
乳腺癌是女性最常见的恶性肿瘤之一,且发病呈年轻化趋势。Gupta 等[41]研究发现了乳腺癌转移相关lncRNA HOTAIR,其在乳腺癌转移灶中的表达水平高出正常乳腺上皮组织的200~2 000倍,在132例乳腺原位癌中也有1/3的组织中HOTAIR表达水平高出正常乳腺组织的125倍之多,并且其高表达与乳腺癌的转移及死亡率呈正相关。细胞水平的研究也显示上调HOTAIR表达水平能够促进细胞的侵袭能力,尾静脉注射高HOTAIR的乳腺癌细胞发现其肺转移能力明显高出对照细胞。研究还发现HOTAIR通过募集多梳蛋白抑制性复合物2(polycomb repressive complex 2, PRC2),引起组蛋白H3K27甲基化从而下调转移抑制相关基因表达,促进肿瘤的侵袭及转移能力。Lu等[42]评估348例原发乳腺癌发现,HOTAIR的表达与乳腺癌的临床或病理特点包括疾病分期、肿瘤分级、组织学类型、肿瘤大小或淋巴结状态等均没有明显的相关性。然而,乳腺癌中HOTAIR下游基因间CpG岛的甲基化普遍存在,且CpG岛的甲基化程度越高,HOTAIR的表达水平越高,而患者的复发风险和死亡风险反而越低。这暗示了基因间甲基化对HOTAIR有着重要的生物调节作用,HOTAIR不是乳腺癌独立的预后标志物。Bhan等[43]研究发现HOTAIR对乳腺癌细胞的生长极为重要,下调乳腺癌细胞MCF7中HOTAIR的表达可明显抑制细胞生长、促进细胞凋亡。研究还发现雌二醇可上调HOTAIR的表达水平,HOTAIR的启动子包含多功能雌激素应答元件,在雌激素依赖下雌激素受体及其共激活因子(如组蛋白甲基化酶 MLL1 (mixed lineage leukemia 1) 和MLL3以及CREB结合蛋白/p300)结合到HOTAIR的启动子区域,促进HOTAIR启动子的组蛋白H3K4三甲基化、乙酰化和RNA聚合酶II招募的水平,从而上调HOTAIR的表达;当敲除雌激素受体和MLLs时,HOTAIR的表达则下调。
Augoff等[44]的研究发现,lncRNA可以通过与miRNA的相互作用调节乳腺癌的进展和转移。lncRNA LOC554202是miR-31的宿主基因,miR-31伴随宿主基因的转录而转录,在管腔亚型的非转移性乳腺癌细胞系MCF-7中高表达,而在基底亚型的三阴性乳腺癌(triple-negative breast cancer, TNBC)细胞系MDA-MB-231中低表达。研究还显示在TNBC细胞系中miR-31和LOC554202均受到启动子甲基化的调控。单独使用去甲基化剂或联合使用去乙酰化剂处理TNBC细胞株可导致miR-31和LOC554202的表达显著上调。甲基化特异性PCR和DNA测序还发现,LOC554202启动子相关的CpG岛在TNBC细胞株高度甲基化,表明甲基化是介导这两个基因沉默的机制,而miR-31和LOC554202的沉默在乳腺癌的侵袭转移中起到重要作用。此外miR-31通过作用于一组转录基因(如RhoA和WAVE3)发挥其抑制作用。该研究表明LOC554202在TNBC细胞中低表达,具有潜在的抑癌作用。Shi等[45]的研究则显示LOC554202在乳腺癌组织中表达水平升高,其高表达与瘤体大小及临床分期呈正相关。相对于正常乳腺细胞MCF-10A,LOC554202在MCF-7中的表达降低,而在2株TNBC细胞系MDA-MB-231和MDA-MB-435S中的表达显著升高。siRNA干扰MDA-MB-435S细胞中LOC554202的表达可抑制细胞增殖、克隆形成、侵袭及迁移,其在裸鼠皮下生长也被抑制。该结果与之前Augoff等的报道相反,因此有关LOC554202在乳腺癌中的作用还需要进一步的实验验证。
Ozgur等[46]研究报道在经博来霉素和ɣ射线处理后的宫颈癌细胞系HeLa细胞和乳腺癌细胞系MCF-7细胞中,HOTAIR和MALAT1表达下调显著,而P21、GAS5、MEG3等表达上调显著,另外一些lncRNA如TUGl、UCAlDA则不受影响。同时发现,ANRIL和GAS5主要在ɣ射线处理后的细胞中被抑制。该研究结果揭示了lncRNA在基因毒性应激诱导的细胞凋亡过程中发挥着不同的功能。Silva等[47]研究发现应激介导长链非编码转录本5(long stree-induced noncoding transcript 5, LSINCT5)在乳腺癌组织和细胞系中高表达,下调乳腺癌细胞系中LSINCT5的表达能显著抑制细胞增殖,同时,另一lncRNA核副斑点装配转录本(nuclear paraspeckle assembly transcript 1, NEAT-1)的表达也显著下调。
现将中国常见癌症相关的lncRNAs的最新研究进展列于表2中。
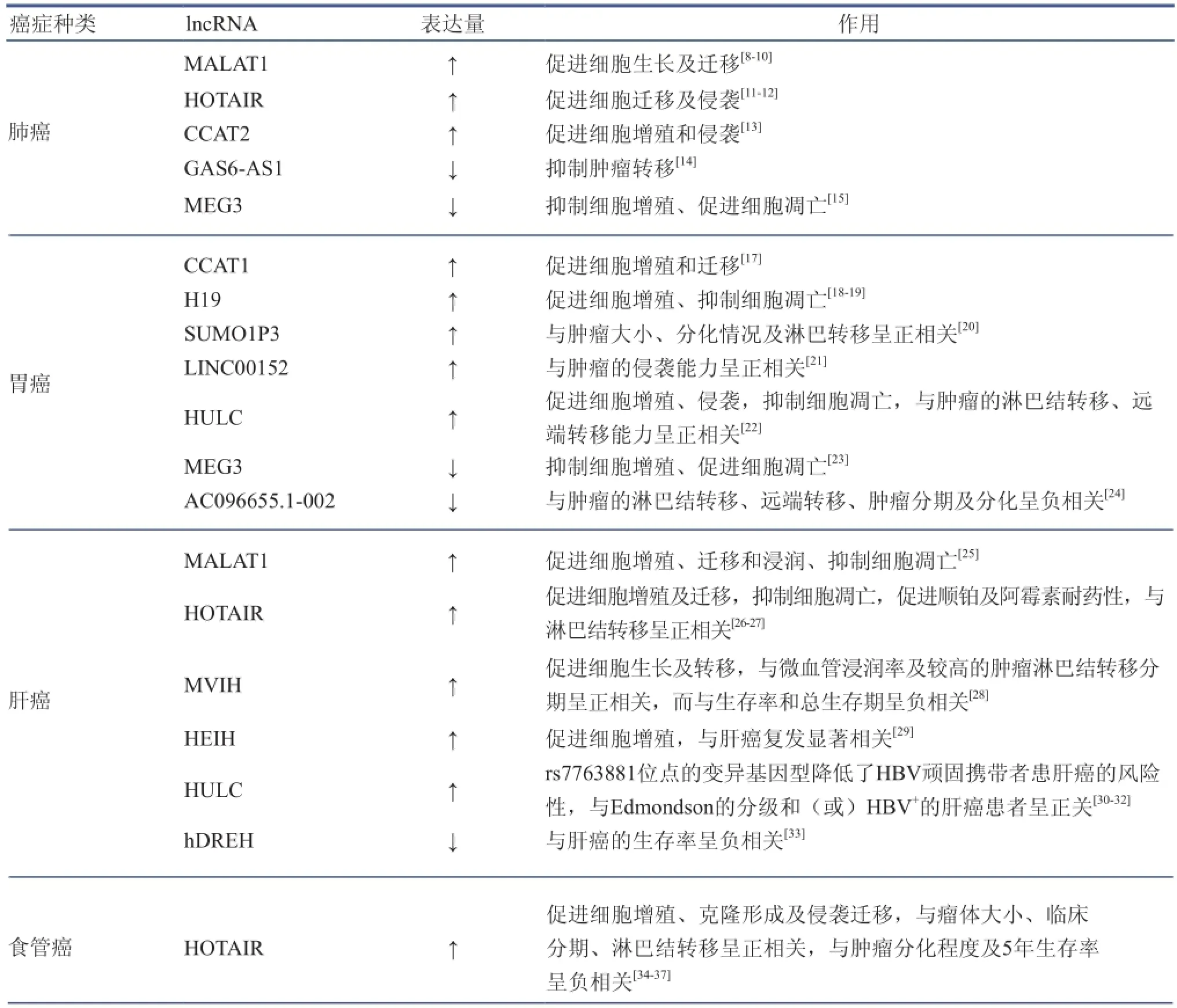
表2 癌症相关lncRNA
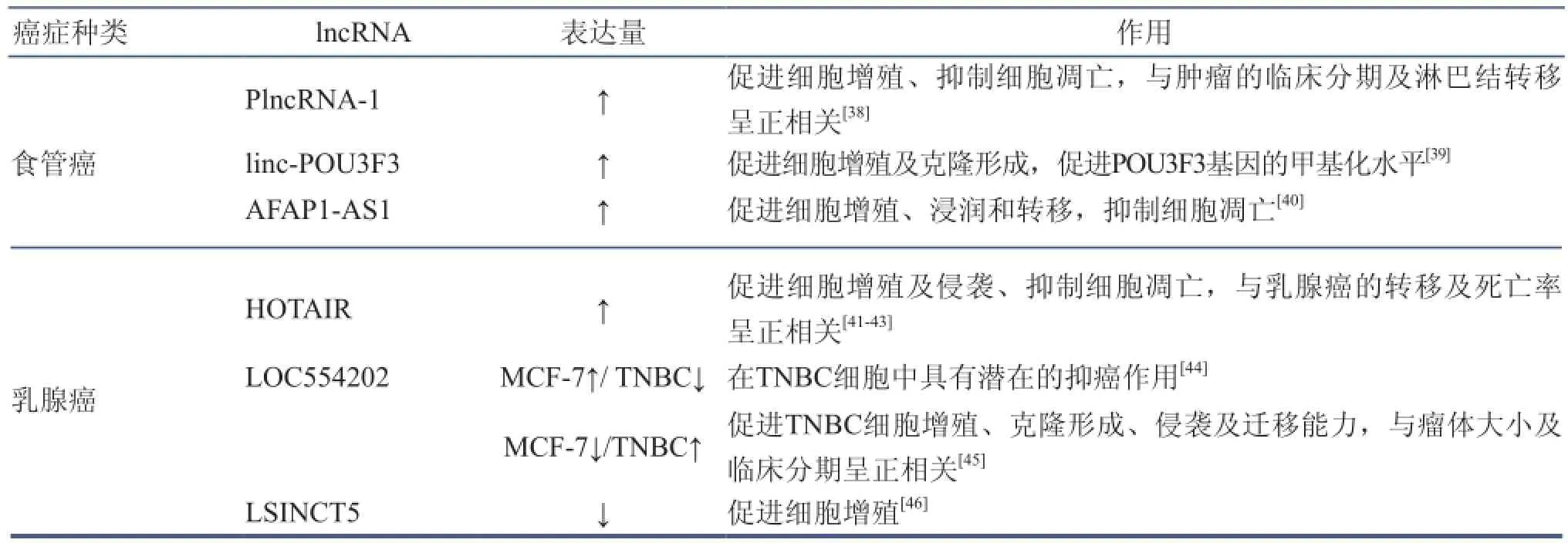
(续表)
4 问题与展望
人们对lncRNA的研究只是刚刚起步,尤其是对lncRNA具体的作用机制仍然知之甚少。为了揭示某个lncRNA的作用机制,系统的研究必不可少。因此,需要发展高通量、高分辨率的成像及实验技术推进lncRNA的研究。此外,加速生物信息学的发展,建立相应的lncRNA数据库并及时更新也势在必行。
lncRNA的研究作为一个相对新的领域正不断快速地扩大,lncRNA在疾病的诊断和治疗上代表了一个重要的分子靶标。目前的研究已表明,lncRNA在表达水平上的差异或在某些癌症类型特异型的表达,可作为肿瘤的临床诊断标志物,如HOTAIR可作为乳腺癌的高度特异性的标志物[41]。除此之外,lncRNA还可能作为治疗靶点,让人类在攻克癌症的道路上加快脚步。随着研究的深入,lncRNA将成为人类认识疾病、诊断疾病和治疗疾病过程中的重要成分。
(2014年5月6日收稿)■
[1] SPIZZO R, ALMEIDA M I, COLOMBATTI A, et al. Long noncoding RNAs and cancer: a new frontier of translational research? [J] Oncogene, 2012, 31(43): 4577-4587.
[2] PONTING C P, OLIVER P L, REIK W. Evolution and functions of long noncoding RNAs [J]. Cell, 2009, 136(4): 629-641.
[3] WILUSZ J E, SUNWOO H, SPECTOR D L. Long noncoding RNAs: functional surprises from the RNA world [J]. Genes Dev, 2009, 23(13): 1494-1504.
[4] BELTRAN M, PUIG I, PEÑA C, et al. A natural antisense transcript regulates Zeb2/Sip1 gene expression during Snail1-induced epithelialmesenchymal transition [J]. Genes Dev, 2008, 22(6): 756-769.
[5] JOHNSSON P, ACKLEY A, VIDARSDOTTIR L, et al. A pseudogene long-noncoding-RNA network regulates PTEN transcription and translation in human cells [J]. Nat Struct Mol Biol, 2013, 20(4): 440-446.
[6] POLISENO L, SALMENA L, ZHANG J, et al. A coding-independent function of gene and pseudogene mRNAs regulates tumour biology [J]. Nature, 2010, 465(7301): 1033-1038.
[7] KALLEN A N, ZHOU X B, XU J, et al. The imprinted H19 lncRNA antagonizes let-7 microRNAs [J]. Mol Cell, 2013, 52(1): 101-112.
[8] TANO K, MIZUNO R, OKADA T, et al. MALAT-1 enhances cell motility of lung adenocarcinoma cells by influencing the expression of motility-related genes [J]. FEBS Lett, 2010, 584(22): 4575-4580.
[9] SCHMIDT L H, SPIEKER T, KOSCHMIEDER S, et al. The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and induces migration and tumor growth [J]. J Thorac Oncol, 2011, 6(12): 1984-1992.
[10] GUTSCHNER T, HAMMERLE M, DIEDERICHS S. MALAT1—a paradigm for long noncoding RNA function in cancer [J]. J Mol Med (Berl), 2013, 91(7): 791-801.
[11] NAKAGAWA T, ENDO H, YOKOYAMA M, et al. Large noncoding RNA HOTAIR enhances aggressive biological behavior and is associated with short disease-free survival in human non-small cell lung cancer [J]. Biochem Biophys Res Commun, 2013, 436(2): 319-324.
[12] ONO H, MOTOI N, NAGANO H, et al. Long noncoding RNA HOTAIR is relevant to cellular proliferation, invasiveness, and clinical relapse in smallcell lung cancer [J]. Cancer Med, 2014. doi: 10.1002/cam4.220.
[13] QIU M, XU Y, YANG X, et al. CCAT2 is a lung adenocarcinomaspecific long non-coding RNA and promotes invasion of non-small cell lung cancer [J]. Tumour Biol, 2014. doi: 10.1007/s13227-014-1700-z.
[14] HAN L, KONG R, YIN D D, et al. Low expression of long noncoding RNA GAS6-AS1 predicts a poor prognosis in patients with NSCLC [J]. Med Oncol, 2013, 30(4): 694.
[15] LU K H, LI W, LIU X H, et al. Long non-coding RNA MEG3 inhibits NSCLC cells proliferation and induces apoptosis by affecting p53 expression [J]. BMC Cancer, 2013,13: 461.
[16] YANG Y, LI H, HOU S, et al. The noncoding RNA expression profile and the effect of lncRNA AK126698 on cisplatin resistance in nonsmall-cell lung cancer cell [J]. PLoS One, 2013, 8(5): e65309.
[17] YANG F, XUE X, B I J, et al. Long noncoding RNA CCAT1, which could be activated by c-Myc, promotes the progression of gastric carcinoma [J]. J Cancer Res Clin Oncol, 2013, 139(3): 437-445.
[18] SONG H, SUN W, YE G, et al. Long non-coding RNA expression profile in human gastric cancer and its clinical significances [J]. J Transl Med, 2013, 11: 225.
[19] YANG F, BI J, XUE X, et al. Up-regulated long non-coding RNA H19 contributes to proliferation of gastric cancer cells [J]. FEBS J, 2012, 279(17): 3159-3165.
[20] MEI, D, SONG H, WANG K, et al. Up-regulation of SUMO1 pseudogene 3 (SUMO1P3) in gastric cancer and its clinical association[J]. Med Oncol, 2013, 30(4): 709.
[21] PANG Q, GE J, SHAO Y, et al. Increased expression of long intergenic non-coding RNA LINC00152 in gastric cancer and its clinical significance [J]. Tumour Biol, 2014. doi: 10.1007/s13277-014-1709-3.
[22] ZHAO Y, GUO Q, CHEN J, et al. Role of long non-coding RNA HULC in cell proliferation, apoptosis and tumor metastasis of gastric cancer: a clinical and in vitro investigation [J]. Oncol Rep, 2014, 31(1): 358-364.
[23] SUN M, XIA R, JIN F, et al. Downregulated long noncoding RNA MEG3 is associated with poor prognosis and promotes cell proliferation in gastric cancer [J]. Tumour Biol, 2014, 35(2): 1065-1073.
[24] SUN W, WU Y, YU X, et al. Decreased expression of long noncoding RNA AC096655.1-002 in gastric cancer and its clinical significance [J]. Tumour Biol, 2013, 34(5): 2697-2701.
[25] LAI M C, YANG Z, ZHOU L, et al. Long non-coding RNA MALAT-1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplantation [J]. Med Oncol, 2012, 29(3): 1810-1816.
[26] YANG Z, ZHOU L, WU L M, et al. Overexpression of long noncoding RNA HOTAIR predicts tumor recurrence in hepatocellular carcinoma patients following liver transplantation [J]. Ann Surg Oncol, 2011, 18(5): 1243-1250.
[27] GENG Y J, XIE S L, LI Q, et al. Large intervening non-coding RNA HOTAIR is associated with hepatocellular carcinoma progression [J]. J Int Med Res, 2011, 39(6): 2119-2128.
[28] YUAN S X,YANG F, YANG Y, et al. Long noncoding RNA associated with microvascular invasion in hepatocellular carcinoma promotes angiogenesis and serves as a predictor for hepatocellular carcinoma patients’poor recurrence-free survival after hepatectomy [J]. Hepatology, 2012, 56(6): 2231-2241.
[29] YANG F, ZHANG L, HUO X S, et al. Long noncoding RNA high expression in hepatocellular carcinoma facilitates tumor growth through enhancer of zeste homolog 2 in humans [J]. Hepatology, 2011, 54(5): 1679-1689.
[30] PANZITT K, TSCHERNATSCH M M, GUELLY C, et al. Characterization of HULC, a novel gene with striking up-regulation in hepatocellular carcinoma, as noncoding RNA [J]. Gastroenterology, 2007,132(1): 330-342.
[31] LIU Y, PAN S, LIU L, et al. A genetic variant in long non-coding RNA HULC contributes to risk of HBV-related hepatocellular carcinoma in a Chinese population [J]. PLoS One, 2012, 7(4): e35145.
[32] XIE H, MA H, ZAOU D. Plasma HULC as a promising novel biomarker for the detection of hepatocellular carcinoma [J]. Biomed Res Int, 2013: 136106.
[33] HUANG J F, GUO Y J, ZHAO C X, et al. Hepatitis B virus X protein (HBx)-related long noncoding RNA (lncRNA) down-regulated expression by HBx (Dreh) inhibits hepatocellular carcinoma metastasis by targeting the intermediate filament protein vimentin [J]. Hepatology, 2013, 57(5): 1882-1892.
[34] LÜ X B, LIAN G Y, WANG H R, et al. Long noncoding RNA HOTAIR is a prognostic marker for esophageal squamous cell carcinoma progression and survival [J]. PLoS One, 2013, 8(5): e63516.
[35] LI X,WU Z, MEI Q, et al. Long non-coding RNA HOTAIR, a driver of malignancy, predicts negative prognosis and exhibits oncogenic activity in oesophageal squamous cell carcinoma [J]. Br J Cancer, 2013, 109(8): 2266-2278.
[36] CHEN F J, SUN M, LI S Q, et al. Upregulation of the long noncoding RNA HOTAIR promotes esophageal squamous cell carcinoma metastasis and poor prognosis [J]. Mol Carcinog, 2013, 52(11): 908-915.
[37] GE X S, MA H J, ZHENG X H, et al. HOTAIR, a prognostic factor in esophageal squamous cell carcinoma, inhibits WIF-1 expression and activates Wnt pathway [J]. Cancer Sci, 2013,104(12): 1675-1682.
[38] WANG C M, WU Q Q, LI S Q, et al. Upregulation of the long noncoding RNA plncRNA-1 eromotes esophageal squamous carcinoma cell proliferation and correlates with advanced clinical stage [J]. Dig Dis Sci, 2014, 59(3): 591-597.
[39] LI W, ZHENG J, DENG J, et al. Increased levels of the long intergenic non-protein coding RNA POU3F3 promote DNA methylation in esophageal squamous cell carcinoma Cells [J]. Gastroenterology, 2014, 146: 1714-1726.
[40] WU W, BHAGAT T D, YANG X, et al. Hypomethylation of noncoding DNA regions and overexpression of the long noncoding RNA, AFAP1-AS1, in Barrett’s esophagus and esophageal adenocarcinoma [J]. Gastroenterology, 2013, 144(5): 956-966.
[41] GUPTA R A, SHAH N, WANG K C, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis [J]. Nature, 2010, 464(7291): 1071-1076.
[42] LU L, ZHU G, ZHANG C, et al. Association of large noncoding RNA HOTAIR expression and its downstream intergenic CpG island methylation with survival in breast cancer [J]. Breast Cancer Res Treat, 2012, 136(3): 875-883.
[43] BHAN A, HUSSAIN I, ANSARI K I, et al. Antisense transcript long noncoding RNA (lncRNA) HOTAIR is transcriptionally induced by estradiol [J]. J Mol Biol, 2013, 425(19): 3707-3722.
[44] AUGOFF K, MCCUE B, PLOW E F, et al. miR-31 and its host gene lncRNA LOC554202 are regulated by promoter hypermethylation in triple-negative breast cancer [J]. Mol Cancer, 2012, 11: 5.
[45] SHI Y, LU J, ZHOU J, et al. Long non-coding RNA Loc554202 regulates proliferation and migration in breast cancer cells [J]. Biochem Biophys Res Commun, 2014, 446: 448-453.
[46] OZGUR E, MERT U, ISIN M, et al. Differential expression of long non-coding RNAs during genotoxic stress-induced apoptosis in HeLa and MCF-7 cells [J]. Clin Exp Med, 2013, 13(2): 119-126.
[47] SILVA J M, BOCZEK N J, BERRES M W, et al. LSINCT5 is over expressed in breast and ovarian cancer and affects cellular proliferation [J]. RNA Biol, 2011, 8(3): 496-505.
Progress of long noncoding RNA in cancer
LI Yan-li①,ZHANG Shi-meng②,WANG Ju③,JIN You-xin④
①Associate Professor, ③Master Candidate, ④Professor, School of Life Sciences, Shanghai University, Shanghai 200444; ②Master Candidate, First School of Clinical Medicine, Nanjing Medical University, Nanjing 210029
Long noncoding RNA (lncRNA) is defined as transcripts longer than 200 nucleotides (nt) with little or no protein-coding capacity. It was found that lncRNA was originated in complicated sources, and played different functions in multiple levels such as epigenetic, transcriptional and post-transcriptional regulation levels. Here we briefly summarize the origin and biological function of lncRNA, and emphatically focus on the progress in cancer biology.
lncRNA, cancer, post-transcriptional regulation
(编辑:段艳芳)
10.3969/j.issn.0253-9608.2014.03.007

