低频电刺激改善脑梗死大鼠神经功能障碍的机制研究①
何志承,杨万章,向云,王维
低频电刺激改善脑梗死大鼠神经功能障碍的机制研究①
何志承1,杨万章2,向云2,王维2
目的探讨低频电刺激(LFS)对脑梗死大鼠神经功能和梗死侧脑组织神经干细胞(NSC)增殖、血管再生的影响。方法制作大鼠永久性大脑中动脉梗死模型(MCAO),随机分为假手术组、对照组和实验组,每组又分为7 d和14 d两个亚组,每个亚组12只。术后2 d开始进行LFS治疗。采用大鼠神经功能缺损评分(NSS)评估大鼠神经功能缺损程度,运用免疫荧光染色检测大鼠梗死侧大脑侧脑室的室管膜下层(SVZ)的5-溴尿嘧啶脱氧核糖核苷酸(BrdU),应用酶联免疫吸附测定法(ELISA)检测大鼠梗死侧大脑的基质细胞衍生因子-1(SDF-1)、血管内皮生长因子(VEGF)含量。结果LFS治疗后14 d,实验组大鼠NSS评分明显低于对照组和假手术组(P<0.01);LFS治疗后各时间点实验组大鼠梗死侧大脑的SDF-1、BrdU和VEGF水平均较对照组有不同程度的上调(P<0.01)。结论LFS能改善脑梗死大鼠功能障碍,其可能机制是通过激活SDF-1/CXCR4轴,进而发挥促进NSC增殖和血管再生作用。
低频电刺激;基质细胞衍生因子-1;5-溴尿嘧啶脱氧核糖核苷酸;血管内皮生长因子;大鼠
[本文著录格式] 何志承,杨万章,向云,等.低频电刺激改善脑梗死大鼠神经功能障碍的机制研究[J].中国康复理论与实践, 2014,20(4):301-305.
脑卒中具有高发病率、高复发率和高致残率的特点,给家庭和社会带来沉重的负担。而偏瘫是脑卒中患者最常见的后遗症,急性期发生率为80%,严重影响患者的日常生活活动能力。如何有效恢复患者的功能障碍,提高患者的日常生活活动能力成为近年来康复界关注的重点。低频电刺激(low frequency stimulation,LFS)不仅具有输出效应而且具有输入效应,一方面通过输出效应诱发肌肉运动,增加肌力,防止肌肉萎缩;另一方面,通过输入效应提高皮层的兴奋性,促进中枢神经系统的重塑[1]。LFS以往多应用于慢性脑卒中,近来发现无论是急性期还是慢性期,LFS都有很确切的临床疗效[2],但其作用机制至今不明。有报道提示,LFS能促进受损中枢神经系统神经干细胞(neural stem cells,NSC)的增殖[3],从而产生修复受损神经组织的作用[4],但如何促进NSC增殖及增殖的程度等问题未做深入探讨。最近,有研究发现基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)能促进NSC增殖,而一些康复治疗能上调脑卒中后SDF-1的水平[5-6]。同时,SDF-1的含量高低与血管再生密切相关[7],而神经再生和血管再生往往同时发生,这就促使我们推测LFS可能是通过SDF-1/CXC chemokine receptor 4(CXCR4)轴促进NSC增殖及血管再生,进而改善脑卒中的功能障碍。因此,本研究拟结合SDF-1/ CXCR4轴探讨LFS改善大鼠急性脑卒中后功能障碍的机制。
1 材料与方法
1.1 实验动物和分组
雄性Sprague-Dawley大鼠72只,270~300 g,7~9周龄,由广东省实验动物中心提供。随机分为假手术组、对照组和实验组,每组又分为7 d和14 d两个亚组(分别于术后7 d、14 d处死大鼠),每个亚组12只。
1.2 模型制作
参照Longa等[8]的方法制永久性大脑中动脉梗死(middle cerebral artery occlusion)动物模型。用10%水合氯醛腹腔注射麻醉大鼠,沿颈正中线切开皮肤,钝性分离左侧颈总动脉、颈外动脉及颈内动脉,结扎颈总动脉近心端及颈外动脉,夹闭颈内动脉。将直径为0.26 mm日本进口鱼线经颈总动脉导入颈内动脉,从颈总动脉分叉处进入约20 mm,阻断左侧大脑中动脉血供。术后1 d对其进行改良Menzies法评分,出现提尾时右侧前肢屈曲内收,向后拖曳尾巴时向右爬行或自主爬行时向右转圈为模型制作成功,具备上述表现之一者随机编入本实验对照组或实验组,假手术组鱼线插入深度为10 mm,不足以阻断大脑中动脉血供。
1.3 神经功能缺损症状评分
术后2 d、7 d、14 d采用神经功能缺损评分(Neurological Severity Scores,NSS)[9]评定大鼠神经功能受损及恢复程度。NSS包括运动功能测试、自主运动测试、感觉测试、平衡测试、反射和异常动作测试等部分,能全面反映大鼠神经功能状况,分值越高,症状越重;分值越低,神经功能恢复越好。13~18分为重度神经功能损伤,7~12分为中度神经功能损伤,1~6分为轻度神经功能损伤。
1.4 LFS治疗
术后2 d,实验组大鼠NSS评分后,应用LFS治疗仪(NeuroTrac™,Continence,Verity Medical公司,英国)经皮电刺激大鼠右前肢,对照组大鼠接上LFS治疗仪但关闭电源,假手术组大鼠不予治疗干预。电流具体参数[10]:频率100 Hz,脉宽200 μs,强度3~4 mA,电流通断比为5 s∶8 s,双向对称方波,以产生稳定的伸腕伸指动作为宜。每次10 min,每天2次,两次间隔至少10 min。
1.5 5-溴尿嘧啶脱氧核糖核苷酸(5-bromodeoxy-dine, BrdU)注射及冰冻切片制作
取6只大鼠,处死前3 d腹腔注射BrdU溶液,每天2次,每次间隔至少8 h。BrdU溶液由生理盐水中加入BrdU粉末(SIGMA公司,B5002)配制而成,浓度为10 mg/ml,按50 mg/kg剂量注射[11]。分别于术后7 d和14 d,麻醉大鼠后予以心脏灌注。先灌入约150 ml磷酸缓冲液(PBS,0.01 mol/L)再灌入约150 ml 4%多聚甲醛(PFA),直至大鼠全身僵硬后断头取脑。脑组织浸于4%PFA 24~48 h后,移至25%蔗糖溶液中直至沉底,冰冻包埋剂包埋。冰冻切片机将脑组织室管膜下层区(subventricular zone,SVZ)切成30 μm冠状切片,放入含叠氮化钠的0.01 mol/L PBS溶液中,4℃下保存备用。
1.6 免疫荧光检测
将切片置于载有0.01 mol/L PBS的24孔板,复温30 min后0.01 mol/L PBS漂洗3次。2 mol/L盐酸DNA变性(37℃下)20 min后,0.01 mol/L PBS漂洗3次,滴加封闭液即0.3%PBST(0.01 mol/L PBS+0.3%TritonX 100)+0.03 g/ml小牛血清蛋白粉末,摇床孵育1 h。吸干封闭液后加入浓度为1∶200的一抗溶液(绵羊多抗,ABCAM公司Ab1893,用封闭液稀释)置于摇床30 min后存入4℃冰箱1~2 d。取出切片,复温30 min后0.01 mol/L PBS漂洗3次。吸干一抗溶液,滴加二抗溶液(驴抗绵羊,1∶200,Dylight488,ABCAM公司Ab96939,用0.3%PBST稀释),避光摇床孵育2 h。0.01 mol/L PBS漂洗3次后贴片,用含DAPI防荧光淬灭液封片,通过激光共聚焦显微镜(Leica SP5)拍片统计。观察部位为大鼠梗死侧大脑的SVZ,每亚组取6只大鼠,每只大鼠随机抽取5张SVZ脑片。每张切片上选取1个0.15×0.15 mm的固定区域,用Image Pro Plus软件统计该区域内所有阳性细胞(/mm2)。
1.7 ELISA检测
另外6只大鼠于术后7 d、14 d处死后断头取脑,用0.01 mol/L PBS冲洗脑组织表面多余的血液,称量脑组织重量后在1 ml 0.01 mol/L PBS中匀浆(低温下进行),匀浆液置于≤-20℃环境过夜。两个冻-融周期后组织细胞膜破损,将匀浆液放入离心机,4℃下12000 r/min离心5 min后提取上清液,立即检测或分装储存于≤-20℃环境。样本检测操作分别按照SDF-1和血管内皮生长因子(vascular endothelial growth factor,VEGF)试剂盒(EIAab公司:E0477r、E0143r)说明书严格执行。酶标仪450 nm处测OD值,绘制标准曲线计算样本浓度(ng/g或pg/g)。
1.8 统计学分析
采用SPSS 19.0统计软件进行统计学处理。实验所得数据采用(±s)表示,两组间比较用t检验,多组之间的比较采用单因素方差分析,显著性水平α=0.05。
2 结果
2.1 NSS评分
假手术组大鼠术后各时间点的NSS评分均为0,故不纳入统计。术后2 d、7 d时实验组与对照组NSS评分均无显著性差异(P>0.05);术后14 d时,实验组大鼠NSS评分显著低于对照组(P<0.001)。对照组大鼠术后14 d NSS评分明显低于术后2 d、7 d(P<0.01);实验组大鼠NSS评分呈逐渐下降趋势,术后各时间点两两比较均有非常显著性差异(P<0.01)。见表1。
2.2 SDF-1含量
术后7 d和14 d实验组大鼠梗死侧大脑SDF-1含量均明显高于对照组和假手术组(P<0.01),对照组均明显高于假手术组(P<0.01)。对照组术后14 d SDF-1含量明显低于术后7 d(P<0.01),实验组和假手术组术后7 d和14 d之间均无显著性差异(P>0.05)。见表2。
2.3 SVZ BrdU阳性细胞数
BrdU免疫荧光染色结果发现,低倍镜下大鼠SVZ见明亮绿色的BrdU阳性细胞,呈层状排列,高倍镜下BrdU表达于细胞核,呈椭圆形或颗粒状。假手术组大鼠SVZ的BrdU阳性细胞分布较稀疏,对照组BrdU阳性细胞数量较之明显增多,而实验组较对照组更加密集。见图1。
术后7 d和14 d实验组大鼠梗死侧SVZ BrdU阳性细胞数均明显高于对照组和假手术组(P<0.01),对照组均明显高于假手术组(P<0.01)。实验组术后14 d明显低于术后7 d(P<0.01),假手术组和对照组术后7 d和14 d之间均无显著性差异(P>0.05)。见表3。
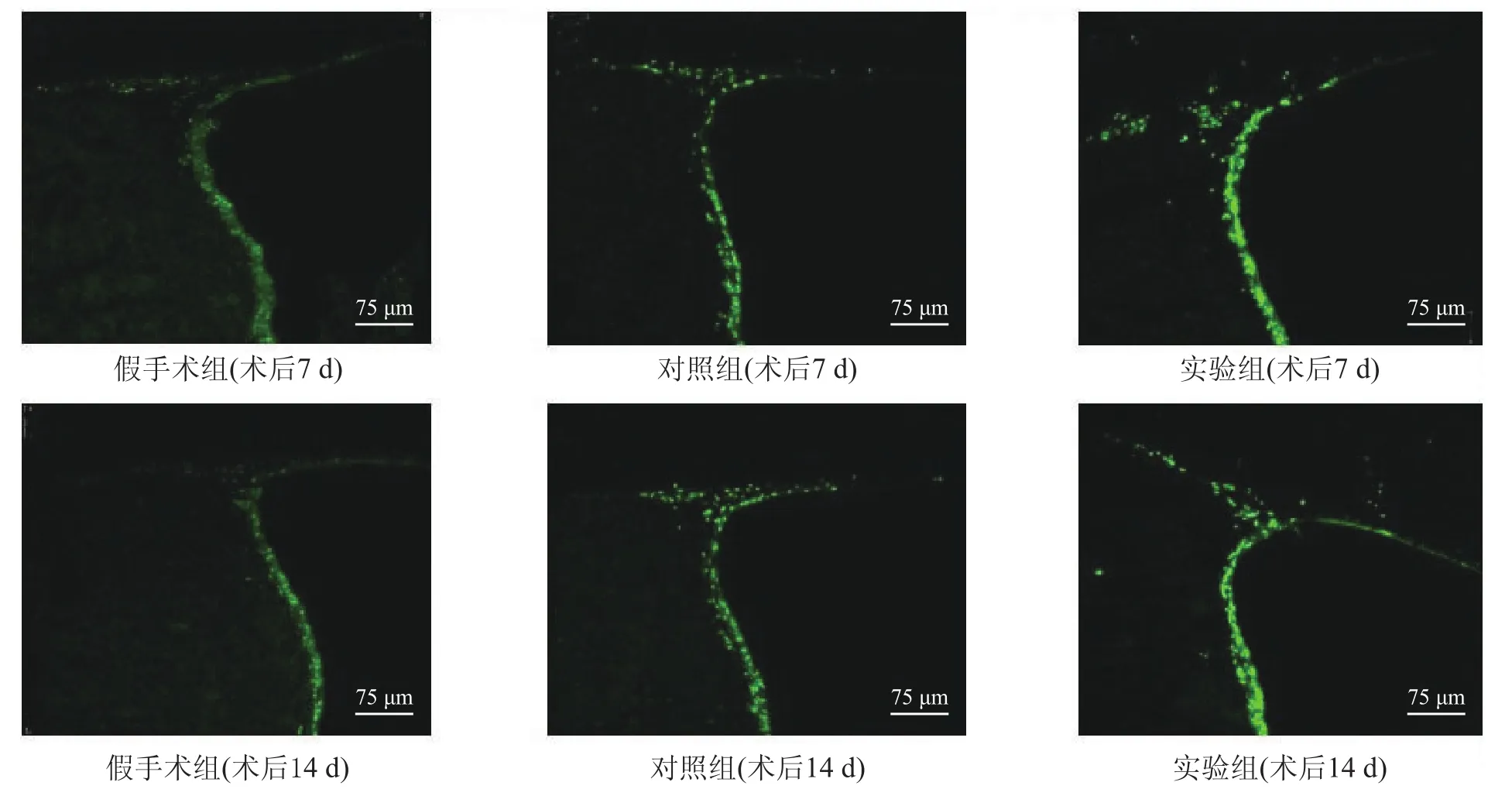
图1 各组大鼠SVZ BrdU阳性细胞数(激光共聚焦,200×)
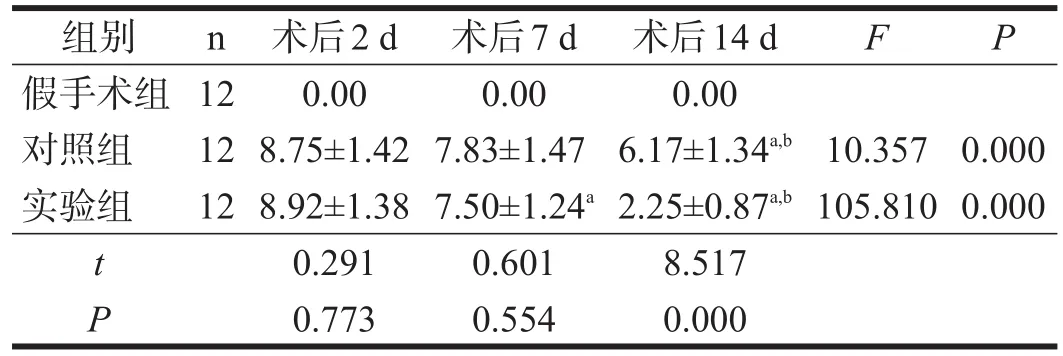
表1 各组动物术后各时间点NSS评分

表2 各组大鼠各时间点梗死侧大脑SDF-1含量(ng/g)
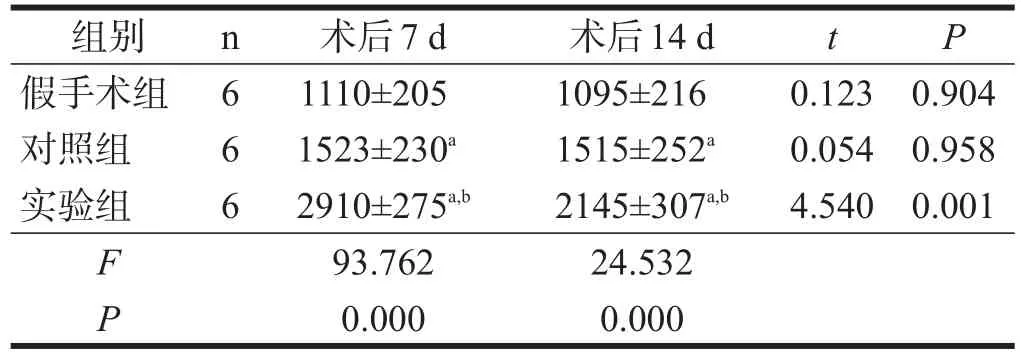
表3 各组大鼠各时间点梗死侧大脑SVZ BrdU阳性细胞数(/mm2)
2.4 VEGF含量
术后7 d和14 d实验组大鼠梗死侧大脑VEGF含量均明显高于对照组和假手术组(P<0.01),对照组均明显高于假手术组(P<0.01)。实验组和对照组术后14 d VEGF含量高于术后7 d(P<0.05),假手术组术后7 d和14 d之间无显著性差异(P>0.05)。见表4。
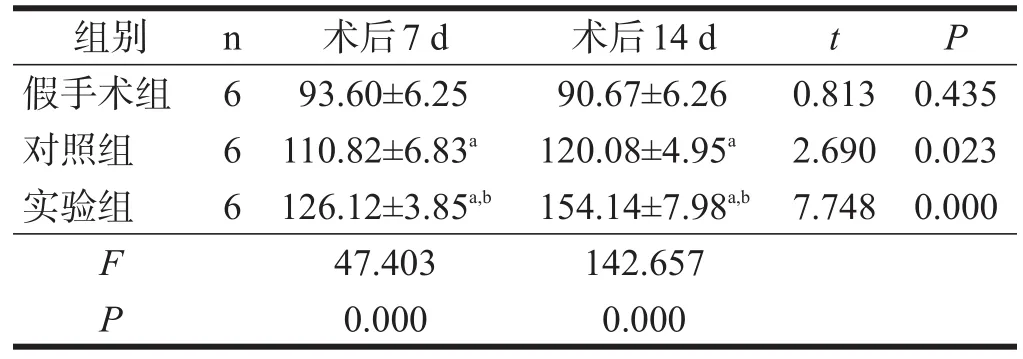
表4 各组大鼠7 d和14 d梗死侧大脑VEGF含量(pg/g)
3 讨论
NSC的发现打破了神经细胞不能再生的传统观念。脑组织受损后,调控NSC增殖与分化的微环境发生改变,NSC因而被激活并参与受损脑组织的修复[12]。而受损脑组织的修复主要体现在神经再生和血管再生,已有研究提示两者之间紧密联系:①神经前体细胞和血管前体细胞在成人神经生发中心直接相连[13];②血管能为NSC提供营养支持;③NSC的靶向迁移受血管信号的影响;④神经和血管的前体细胞有相同的信号传导途径和基因信息通路;⑤NSC上也能表达内皮祖细胞特异标记。故有“神经血管单元”学说[14]的形成。神经血管单元主要由神经细胞、血管内皮细胞、神经胶质细胞和周围细胞外基质构成,单元内的各种细胞之间、细胞与基质之间的相互作用和动态平衡,筑成调控NSC的微环境。
有关神经血管单元形成的研究甚少,SDF-1可能在其形成中起着重要的作用。正常成年动物大脑有低水平的SDF-1、CXCR4表达;脑卒中后,SDF-1在细胞表面整合素激酶、低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的作用下表达释放增加[15]。SDF-1主要由缺血灶周围的星形胶质细胞释放[16],当这些星形胶质细胞兴奋性升高时,SDF-1释放的量可能会更多。低频电刺激可能通过其输入效应提高星形胶质细胞的兴奋性,上调脑卒中后脑梗死侧SDF-1的水平,进而激活SDF-1/CXCR4轴产生生物效应。SDF-1/CXCR4轴能通过细胞外调节蛋白激酶和磷脂酰肌醇3-激酶信号通路促进神经再生[17],通过募集血管内皮祖细胞(endothelial progenitor cells,EPCs)参与血管网络重建,促进血管再生[18]。可见,SDF-1/CXCR4轴既能促进神经再生又能促进血管再生,可能在脑卒中后神经血管单元的形成中起着重要的作用。
本实验用NSS法全面评估脑梗死大鼠神经功能障碍(包括运动功能、感觉功能和平衡功能等)恢复的情况,结果显示,实验组NSS评分逐渐下降,术后各时间点之间均有非常显著性差异(P<0.01),而对照组直到术后14 d时NSS评分才出现明显下降(P<0.01),说明LFS治疗在术后7 d时已经显示出改善大鼠神经功能的作用。术后7 d时实验组NSS评分与对照组无显著性差异(P>0.05),术后14 d时实验组NSS评分显著低于对照组(P<0.01),提示随着LFS治疗时间的延长疗效更明显,这结果与向云等研究结果[19]基本一致。
综上分析显示,早期LFS治疗对于脑梗死大鼠神经功能障碍的恢复有益。本研究显示,术后7 d和14 d实验组的SDF-1含量均明显高于对照组(P<0.01),实验组和对照组术后14 d SDF-1含量均低于术后7 d,其中,实验组术后7 d和14 d之间无显著性差异(P>0.05),而对照组术后7 d和14 d之间则有非常显著性差异(P<0.01),提示实验组SDF-1含量一直维持在较高水平,而对照组则有降至低水平的趋势。可见,LFS治疗可能激活了SDF-1/CXCR4轴,推测LFS正是通过这一作用促进脑梗大鼠神经功能障碍恢复。
成年大鼠的神经生发中心为SVZ和海马齿状回(dentate gyrus,DG)的颗粒下层(subgranular layer, SGL),故本实验选取脑梗死侧SVZ作为观察区域[20]。BrdU是一种胸腺嘧啶核苷类似物,在细胞增殖周期的S期可替代胸腺嘧啶嵌入正在复制的细胞核DNA中,广泛应用于标记增殖的细胞,常作为NSC增殖的标记物,具有半衰期长、可遗传到子代细胞的特点[21]。因此,本实验用BrdU标记NSC。本研究的BrdU免疫荧光检测结果与Matsumoto等研究结果[22]相近,假手术组各时间点均发现少量BrdU阳性细胞,可见非脑梗死状态下大鼠脑内亦有少量的NSC存在。术后7 d和14 d实验组和对照组BrdU阳性细胞数均明显高于假手术组(P<0.01)。这提示脑梗死是刺激大鼠脑内NSC增殖的一个重要因素。术后7 d和14 d实验组BrdU阳性细胞数均明显高于对照组(P<0.01),表明脑梗死虽能刺激大鼠脑部NSC增殖,但增殖的程度并不高,而LFS能促进脑梗死大鼠脑部的NSC的增殖。增殖后的NSC可能转化为星形胶质细胞、少突细胞,甚至神经元,参与神经损伤处神经网络结构与功能的重组,修复受损的脑组织[23]。实验组术后14 d BrdU阳性细胞数明显低于术后7 d(P<0.01),说明部分增殖的NSC难以存活。本课题对于NSC的分化、迁移及增殖NSC的存活率未作进一步的观察,将是今后研究的方向。
VEGF被证明是对血管形成有关键特异性作用的生长因子,在启动脑缺血后血管新生调控中,起着中心环节的作用[24],故本实验检测VEGF以了解脑卒中后大鼠的血管再生情况。本研究显示,假手术组术后7 d和14 d VEGF含量均较低,且无显著性差异(P>0.05)。提示非脑梗死大鼠血管再生并不活跃。术后7 d和14 d对照组和实验组VEGF含量均高于假手术组(P<0.05),表明脑梗死能刺激大鼠脑部的血管再生。术后7 d和14 d实验组VEGF含量均明显高于对照组(P<0.01),这说明LFS能促进脑梗死大鼠缺血侧脑部的血管再生,且血管再生的程度较未接受LFS治疗的脑梗死大鼠为高。血管再生能为NSC营造良好的微环境,使NSC能更好地修复受损脑组织。本实验结果提示,LFS可能通过激活SDF-1/CXCR4轴,促进神经和血管再生,营造良好的微环境,利于脑梗死大鼠受损脑组织的修复。该通路阻断的反证研究、SDF-1/CXCR4轴与神经血管发生的相关性研究等内容,我们将在今后的实验中进行探讨。
本研究的结果显示,LFS能够改善脑梗死大鼠的神经功能,并能上调梗死侧脑组织的BrdU阳性细胞数和VEGF含量,其可能的机制就是通过激活SDF-1/ CXCR4轴,至于有无其他通路激活和神经发生、血管再生的交互关系值得深入研究。
[1]Sasaki K,Matsunaga T,Tomite T,et al.Effect of electrical stimulation therapy on upper extremity functional recovery and cerebral cortical changes in patients with chronic hemiplegia[J]. Biomed Res,2012,33(2):89-96.
[2]Thrasher TA,Zivanovic V,McIlroy W,et al.Rehabilitation of reaching and grasping function in severe hemiplegic patients using functional electrical stimulation therapy[J].Neurorehabil Neural Repair,2008,22(6):706-714.
[3]Becker D,Gary DS,Rosenzweig ES,et al.Functional electrical stimulation helps replenish progenitor cells in the injured spinal cord of adult rats[J].Exp Neurol,2010,222(2):211-218.
[4]Minger SL,Ekonomou A,Carta EM,et al.Endogenous neurogenesis in the human brain following cerebral infarction[J]. Regen Med,2007,2(1):69-74.
[5]Wu Y,Peng H,Cui M,et al.CXCL12 increases human neural progenitor cell proliferation through Akt-1/FOXO3a signaling pathway[J].J Neurochem,2009,109(4):1157-1167.
[6]方杰,胡昔权.功能训练对脑梗死后神经干细胞影响的研究进展[J].中国康复医学杂志,2009,24(4):374-376.
[7]Balabanian K,Lagane B,Infantino S,et al.The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J].J Biol Chem,2005,280(42): 35760-35766.
[8]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[9]Chen J,Sanberg PR,Li Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32(11):2682-2688.
[10]Ke Z,Yip SP,Li L,et al.The effects of voluntary,involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery:a rat brain ischemia model[J].PloS One,2011,6(2):e16643.
[11]Wojtowicz JM,Kee N.BrdU assay for neurogenesis in rodents[J].Nat Protoc,2006,1(3):1399-1405.
[12]Martino G,Pluchino S.The therapeutic potential of neural stem cells[J].Nat Rev Neurosci,2006,7(5):395-406.
[13]Tavazoie M,Van der Veken L,Silva-Vargas V,et al.A specialized vascular niche for adult neural stem cells[J].Cell Stem Cell,2008,3(3):279-288.
[14]Ohab JJ,Fleming S,Blesch A,et al.A neurovascular niche for neurogenesis after stroke[J].J Neurosci,2006,26(50):13007-13016.
[15]Moll NM,Ransohoff RM.CXCL12 and CXCR4 in bone marrow physiology[J].Expert Rev Hematol,2010,3(3):315-322.
[16]Shen LH,Li Y,Chen J,et al.Therapeutic benefit of bone marrow stromal cells administered 1 month after stroke[J].J Cereb Blood Flow Metab,2006,27(1):6-13.
[17]Gong X,He X,Qi L,et al.Stromal cell derived factor-1 acutely promotes neural progenitor cell proliferation in vitro by a mechanism involving the ERK1/2 and PI-3K signal pathways[J].Cell Biol Int,2006,30(5):466-471.
[18]Teng H,Zhang ZG,Wang L,et al.Coupling of angiogenesis and neurogenesis in cultured endothelial cells and neural progenitor cells after stroke[J].J Cereb Blood Flow Metab,2007, 28(4):764-771.
[19]向云,燕铁斌,庄志强,等.功能性电刺激促进急性脑梗死大鼠脑部内源性神经干细胞增殖的研究[J].中华神经医学杂志, 2009,8(12):1197-1202.
[20]Jiao J,Feldheim DA,Chen DF.Ephrins as negative regulators of adult neurogenesis in diverse regions of the central nervous system[J].Proc Natl Acad Sci USA,2008,105(25):8778-8783.
[21]Taupin P.BrdU immunohistochemistry for studying adult neurogenesis:paradigms,pitfalls,limitations,and validation[J]. Brain Res Rev,2007,53(1):198-214.
[22]Matsumoto J,Morioka M,Hasegawa Y,et al.Sodium orthovanadate enhances proliferation of progenitor cells in the adult rat subventricular zone after focal cerebral ischemia[J].J Pharmacol Exp Ther,2006,318(3):982-991.
[23]Christophidis LJ,Gorba T,Gustavsson M,et al.Growth hormone receptor immunoreactivity is increased in the subventricular zone of juvenile rat brain after focal ischemia:A potential role for growth hormone in injury-induced neurogenesis[J]. Growth Horm IGF Res,2009,19(6):497-506.
[24]Arany Z,Foo SY,Ma Y,et al.HIF-independent regulation of VEGF and angiogenesis by the transcriptional coactivator PGC-1alpha[J].Nature,2008,451(7181):1008-1012.
Effect of Low Frequency Stimulation on Neural Dysfunction in Rats with Cerebral Infarction
HE Zhi-cheng,YANG Wan-zhang, XIANG Yun,et al.Graduate School,Guangzhou Medical University,Guangzhou 510182,Guangdong,China
ObjectiveTo investigate the effects of low frequency stimulation(LFS)on proliferation and angiogenesis of neural stem cells(NSC)in cerebral infarction side in rats.MethodsThe rats with permanent middle cerebral artery occlusion(MCAO)were randomly divided into sham-operation group,control group and LFS group,each group was divided into 7 days and 14 days subgroups with 12 rats in each subgroup.LFS therapy was started 2 days after operation.The degree of nerve function defect was evaluated with Neurological Severity Score(NSS),and the 5-bromodeoxy-dine(BrdU)positive cells in the subventricular zone(SVZ)of cerebral infarction side were detected with immunofluorescence.Stromal cell-derived factor 1(SDF-1)and vascular endothelial growth factor(VEGF)in infarction side were detected with enzyme-linked immunosorbent assay(ELISA).ResultsThe NSS score was lower in the LFS group than in the control group and the sham-operation group 14 days after surgery(P<0.01).The number of BrdU positive cells,the content of SDF-1 and VEGF in the ischemic side were more in the LFS group than in the other groups(P<0.01)after treatment.ConclusionLFS can improve the neurological function in rats with acute cerebral infarction,which may associate with activating SDF-1/CXCR4 axis.
low frequency stimulation;stromal cell-derived factor-1;5-bromodeoxy-dine;vascular endothelial growth factor;rats
10.3969/j.issn.1006-9771.2014.04.001
R743.3
A
1006-9771(2014)04-0301-05
2013-09-29
2013-11-04)
1.深圳市科技计划项目(医疗卫生类)(No.201203223);2.南山区卫生科技计划项目(No.2011006)。
1.广州医科大学研究生学院,广东广州市510182;2.深圳市第六人民医院康复医学科,广东深圳市518052。作者简介:何志承(1987-),男,广东广州市人,硕士研究生,主要研究方向:神经康复。通讯作者:杨万章(1957-),男,教授,主要研究方向:神经干细胞、周围神经康复。

