静磁场对骨髓间充质干细胞增殖及骨向分化的影响①
宋国丽,周翠红,张宇,张小云
静磁场对骨髓间充质干细胞增殖及骨向分化的影响①
宋国丽,周翠红,张宇,张小云
目的研究0.25 T、0.35 T、0.42 T静磁场持续或间歇曝磁对骨髓间充质干细胞(MSCs)增殖及骨向分化的影响。方法全骨髓贴壁筛选法分离MSCs,取第三代MSCs采用强度分别为0.25 T、0.35 T、0.42 T静磁场持续曝磁或间歇曝磁,CCK-8法检测各组细胞增殖活力,并观察0.35 T连续曝磁后MSCs碱性磷酸酶活性、骨钙素含量。结果细胞经过磁场处理后,与对照组相比,细胞增殖活力均降低,连续曝磁第7天效果最为显著(P<0.001),而0.25 T、0.35 T间歇曝磁第2~8天持续表现出显著抑制效应(P<0.001)。0.35 T持续曝磁后,MSCs碱性磷酸酶活性和骨钙素水平均增高(P<0.05)。结论0.25 T、0.35 T、0.42 T静磁场连续曝磁或间歇曝磁均可抑制MSCs增殖,0.35 T连续曝磁能促进MSCs向成骨细胞方向分化。
静磁场;骨髓间充质干细胞;增殖;骨向分化;大鼠
[本文著录格式] 宋国丽,周翠红,张宇,等.静磁场对骨髓间充质干细胞增殖及骨向分化的影响[J].中国康复理论与实践, 2014,20(4):322-326.
骨髓间充质干细胞(mesenchymal stem cells, MSCs)具有来源丰富、自我更新能力强和多向分化潜能等生物学特性,是目前公认的组织工程重要的种子细胞,探索其体外扩增及定向分化的条件是目前的研究热点之一[1-2]。而磁场作为一种外加物理因子,对组成机体的各种类型细胞具有丰富的生物学效应。本实验室前期研究发现,磁场能够促进成骨细胞生长,抑制破骨细胞功能,促进放化疗损伤小鼠的造血修复[3-6]。研究磁场对MSCs增殖及骨向分化过程中的影响,对探讨影响MSCs体外增殖及骨向分化的物理因素,以及磁场在治疗放化疗损伤和骨质疏松等疾病过程中的具体作用机制有重要意义。
1 材料与方法
1.1 实验动物与材料
1.1.1 实验动物 SPF级Sprague-Dawley大鼠8只,6~8周龄,体重180~240 g,雌雄不限,由广东医学实验动物中心提供。
1.1.2 静磁场 采用方形和夹层型恒定永磁体,以高斯计测量磁体表面各位置磁场强度,磁体经75%乙醇消毒后置于培养箱内。
1.1.3 试剂 改良型α-MEM培养基、新生牛血清(newborn bovine serum,NBS)、胰蛋白酶(hyclone);β-甘油磷酸钠、地塞米松、维生素C、青霉素、链霉素(SIGMA公司),Cell Counting Kit-8(CCK-8,日本同仁);碱性磷酸酶(alkaline phosphatase,ALP)活性检测试剂盒(东瓯津玛);骨钙素检测试剂盒(中国人民解放军总医院科技开发中心放免研究所)。
1.2 方法
1.2.1 全骨髓贴壁筛选法分离培养MSCs 将大鼠引颈脱臼处死后,无菌条件分离股骨和胫骨,分别剪开股骨与胫骨两端,以含10%NBS的α-MEM培养基冲洗骨髓腔,制备骨髓细胞悬液,200目筛网过滤后以改良型α-MEM培养基+10%NBS接种于培养瓶内,置于37℃、5%CO2细胞培养箱中静置培养。3 d后全量换液,以后每2~3天全量换液。待细胞长至70%~80%汇合,0.25%胰酶消化传代培养。由于不同细胞的贴壁能力不同,掌握消化时间,利用差时消化法,通过传代,纯化并扩大培养MSCs。流式细胞仪检测MSCs表面标志CD45、CD90及CD73的表达率,并进行其脂肪细胞、软骨细胞及成骨细胞分化能力鉴定。连续传代3次以后,取P3代的MSCs进行实验。
1.2.2 细胞曝磁处理 取对数生长期P3代细胞,以1× 105/ml的浓度接种于96孔板,每孔100µl,设实验对照组(没有经过曝磁处理的细胞悬液)、空白对照组(等体积的培养基,用于调零)和曝磁组,各组设3个重复孔。
连续曝磁:磁场组细胞接种于细胞培养板后,置于培养箱中的方形或者夹层型恒定永磁体上,对照组在另一同样条件培养箱培养。
间歇曝磁:磁场组细胞接种于细胞培养板后,置于培养箱中的方形或者夹层型恒定永磁体上曝磁24 h后取出,脱离磁场培养24 h后重新放进磁场中,对照组在另一同样条件培养箱培养。
1.2.3 CCK-8法检测细胞增殖活力 细胞曝磁处理1、3、5、7或2、4、6、8 d后,分别进行CCK-8检测。每孔加入CCK-8溶液10µl,置于37℃、5%CO2、饱和湿度条件下的细胞培养箱内避光培养3 h后,震荡5 min,立即用酶标仪测450 nm处吸光度值(OD)。实验重复3次以上取平均值。
1.2.4 骨髓MSCs成骨性分化分析 将P3代的MSCs以2×105/m1密度接种于预先置有小盖玻片的6孔板中,待细胞达到70%~80%融合后,分为成骨诱导剂组、磁场组、磁场+诱导剂组和对照组。成骨诱导液为培养基中加入1×10-7mol/L地塞米松、50 μg/ml抗坏血酸、10 mmol/L β-甘油磷酸钠。每组设3个复孔,置0.35 T静磁场连续曝磁。在37℃、5%CO2培养箱中培养,每3天换液。
1.2.5 ALP活性检测 诱导培养3 d、7 d,PBS冲洗细胞,加入0.25%胰酶37℃消化3~5 min,培养基终止消化,收集细胞,PBS液洗涤2次,1500 r/min离心5 min,弃上清液,调整细胞浓度为1×105/ml,加入2%TritonX-100 1 ml,4℃裂解细胞后,裂解液采用ALP检测试剂盒检测ALP活性。
1.2.6 骨钙素含量 诱导培养24 d后,分别收集细胞培养液中的上清液及加入0.1%的TritonX-100的细胞裂解液1 ml用于骨钙素含量的测定。样品送中国人民解放军总医院科技开发中心放免研究所检测。
1.3 统计学分析
所有实验数据均采用SPSS 13.0进行统计学分析,数据以(±s)表示,采用独立样本t检验,显著性水平α=0.05。
2 结果
2.1 大鼠MSCs形态观察及鉴定
原代培养48 h后可见大量贴壁细胞,5 d后细胞形成集落,10 d左右进行传代,传代后细胞生长迅速,几次传代后能得到大量均一的细胞群。MSCs贴壁生长,形态类似于成纤维细胞,部分贴壁细胞呈三角形或多角形,细胞体积大。传代后细胞增殖迅速,3~5 d可形成典型旋涡状或者辐射状细胞集落,集落不断扩大和汇合,细胞紧密排列,形态趋于一致,细胞边界清晰。随着传代次数的增加,MSCs均一性提高(见图1),流式细胞仪分析其表面抗原:CD45阳性率为10.4%,CD90阳性率为95.7%,CD73阳性率为92%。经过定向诱导培养基诱导后,证明其具有向脂肪细胞、软骨细胞及成骨细胞方向分化的能力。
2.2 细胞增殖活力
0.35 T静磁场连续曝磁在第3天开始即抑制MSCs增殖(P<0.05);0.25 T、0.35 T、0.42 T静磁场连续曝磁7 d后MSCs增殖活力均显著低于对照组(P<0.001)。见表1。
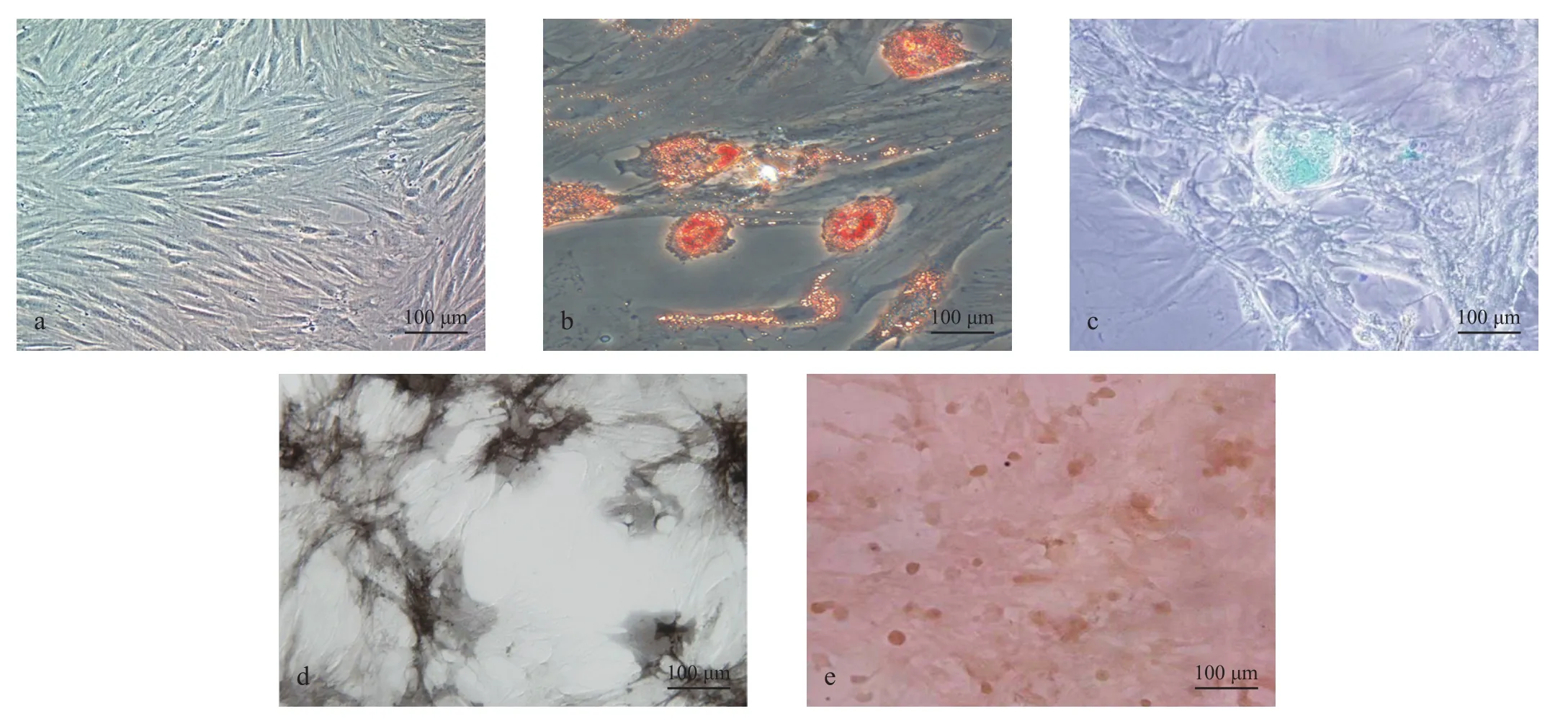
图1 MSCs形态观察及鉴定

表1 不同强度静磁场连续曝磁对MSCs增殖活力的影响(OD)
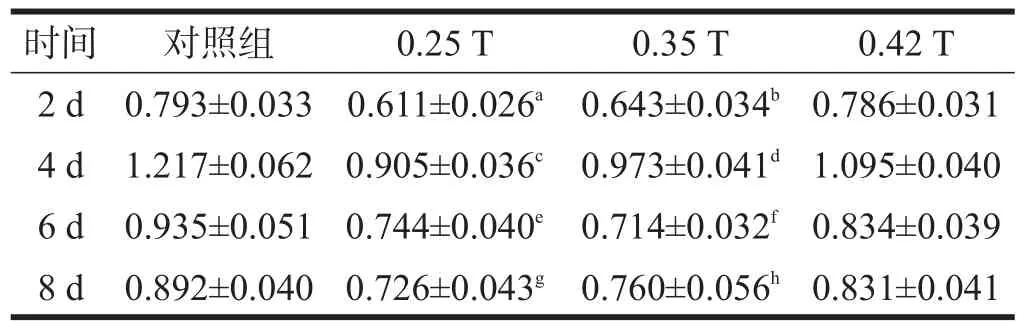
表2 不同强度静磁场间歇曝磁对MSCs增殖活力的影响(OD)
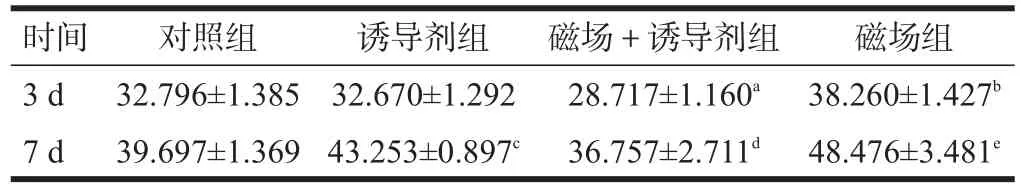
表3 0.35 T静磁场连续曝磁3 d和7 d对MSCsALP活性的影响(U/L)
静磁场间歇曝磁表现出的效应稍有不同,0.25 T和0.35 T静磁场间歇曝磁均从曝磁第2天开始即表现出对MSCs增殖的显著抑制效应,这种效应一直持续到第8天(P<0.001),而0.42 T静磁场间歇曝磁对MSCs增殖无影响。见表2。
2.3 ALP活性
MSCs经过0.35 T静磁场连续曝磁和/或诱导剂诱导3 d后,与对照组相比,诱导剂组无显著性差异;磁场+诱导剂组ALP活性明显降低(P<0.01);而磁场组ALP活性明显升高(P<0.01)。诱导7 d后,与对照组相比,诱导剂组ALP活性升高(P<0.05);磁场+诱导剂组ALP活性降低(P<0.05);磁场组ALP活性显著升高(P<0.001)。见表3。
2.4 骨钙素
MSCs经过0.35 T静磁场连续曝磁和/或诱导剂诱导24 d后,诱导剂组、磁场+诱导剂组和磁场组骨钙素水平均高于对照组(P<0.05)。见表4。

表4 0.35 T静磁场连续曝磁24 d后各组细胞骨钙素含量(ng/ml)
3 讨论
作为再生医学和组织工程中非常有潜力的一种种子细胞,MSCs的应用近年来受到广泛关注。如何调控其向特定方向分化是实现MSCs有效应用的一个重要问题。已有研究表明对MSCs外加适当的物理刺激如电磁场有比较大的潜力。外界物理刺激(如脉冲电磁场、低频脉冲超声)已经在临床得到一定的应用,如加速新鲜骨折愈合,促进有“骨不连”风险的骨折愈合以及促进骨组织的自我修复能力(如在延迟愈合或假关节病等病理情况下重新激活愈合过程)[7-9]。这些都有可能是通过电磁波促进成骨细胞增殖以及MSCs的骨向分化等作用实现的[10-12]。
我们的前期研究发现,特定参数的恒定磁场可以促进大鼠成骨细胞的生长和分泌功能、抑制破骨细胞生长和破骨功能,从而提高骨密度及骨强度,对于骨质疏松有较好的干预效果[3-4];同时它也对放化疗损伤小鼠具有明显的保护作用,促进放化疗损伤小鼠的造血修复[5-6],但是其具体作用机制目前尚不清楚。骨质疏松主要是由于骨重建的失衡所致,即由成骨细胞介导的骨形成和破骨细胞介导的骨吸收二者脱偶联。成骨细胞由骨髓MSCs分化而来,而破骨细胞源于造血干细胞单核-巨噬细胞前体分支。骨髓MSCs作为骨髓造血微环境的主要生成细胞,可以多向分化为造血微环境的多种组成成分,包括软骨细胞、成骨细胞以及脂肪细胞等,也可以通过分泌多种细胞因子及细胞外基质维持骨髓造血微环境的稳定,促进造血干细胞移植及造血重建[1-2]。因此,骨髓MSCs在骨生成及造血过程中均扮演重要角色,静磁场可能是通过对MSCs的直接作用来发挥其提高骨密度及造血修复的作用的。
在本实验中,在0.25 T、0.35 T、0.42 T磁场强度下,连续曝磁和间歇曝磁均抑制细胞增殖,但连续曝磁和间歇曝磁的效应不完全相同,这与磁场的“窗口效应”是吻合的,某一特定频率、特定强度范围的磁场作用方式不同,对细胞的影响不同[13]。综合考虑其效应,我们选择0.35 T磁场连续曝磁对细胞骨向分化过程进行干预。
MSCs诱导至表达典型的成骨细胞标志的过程是一个连续演变的过程,在这一过程中每一个形态学或功能的变化都是受基因控制的。一般认为ALP是成熟骨祖细胞初始表达的成骨分化早期标志,其表达具有时间依赖性,一般在第7天达最高峰,随后开始减少。骨钙素,又名骨谷氨酸蛋白,是成骨细胞分泌的一种非胶原蛋白,在MSCs成骨分化后期表达量最高,当钙存在时,骨钙素可以结合羟基磷灰石,并稳定其构象,是成骨细胞分化成熟的一个重要指标。因此ALP和骨钙素是反映成骨细胞分化成为骨细胞和基质钙化的两个重要指标[14]。据报道静磁场可以直接刺激成骨细胞分化成熟,Yamamoto等用0.16 T静磁场照射3种成骨细胞,结果显示,从第4天开始磁场组细胞内ALP活性增加,第8~12天达到高峰;骨钙素分泌从第8天开始增高,持续到第20天,且有一定的时间-效应关系[15]。Huang等采用0.4 T的铷铁硼永磁体照射人成骨肉瘤细胞MG63,发现静磁场明显促进成骨细胞合成以及分泌ALP、骨桥蛋白和I型胶原,因此静磁场可以促进成骨细胞早期合成和分泌矿化相关蛋白,刺激胞外基质的合成,分化成熟[16-17]。
本实验选择ALP活性和骨钙素的表达作为检测指标,观察静磁场对MSCs向成骨方向分化的影响。ALP结果显示,单纯磁场干预能促进MSCs向成骨方向分化,但联合诱导剂共同作用后,诱导效果反而没有单独诱导剂作用强。骨钙素的实验结果表明,诱导组骨钙素表达量最高,其次为磁场组和磁场+诱导组。纵观ALP和骨钙素结果,在成骨诱导早期和后期,磁场的作用基本一致,都表现为单独作用时有促进MSCs向成骨细胞方向分化的趋势,联合诱导培养基作用后,效果反而有所下降。因此静磁场可能通过促进rMSCs成骨分化来发挥其在骨折、骨质疏松等骨科疾病中的治疗作用。
本研究表明,静磁场连续曝磁能够抑制MSCs增殖,诱导MSCs骨向分化,在调控MSCs向特定方向分化方面具有比较大的潜力,但与诱导剂联合作用未表现出促进MSCs向成骨细胞方向分化的效应,具体作用机制有待进一步探讨。
[1]Kim EJ,Kim N,Cho SG.The potential use of mesenchymal stem cells in hematopoietic stem cell transplantation[J].Exp Mol Med,2013,45(1):e2.
[2]Fan CG,Zhang QJ,Zhou JR.Therapeutic potentials of mesenchymal stem cells derived from human umbilical cord[J].Stem Cell Rev,2011,7(1):195-207.
[3]张小云,张宇.旋转恒定强磁场对大鼠骨密度及生物力学参数以及破骨细胞影响的体内外实验[J].中国临床康复,2006,10 (5):74-77.
[4]Zhang XY,Xue Y,Zhang Y.Effects of 0.4 T rotating magnetic field exposure on density,strength,calcium and metabolism of rat thigh bones[J].Bioelectromagnetics,2006,27(1):1-9.
[5]宋国丽,王敏,季百苗,等.不同频率旋转磁场对放射损伤小鼠的保护及造血作用恢复的研究[J].中国康复医学杂志,2006, 21(8):689-692.
[6]王敏,季百苗,宋国丽,等.不同频率旋转强恒磁场对抗肿瘤药物损伤小鼠造血功能恢复效果的差异[J].中国临床康复, 2006,29(10):124-128.
[7]Massari L,Caruso G,Sollazzo V,et al.Pulsed electromagnetic fields and low intensity pulsed ultrasound in bone tissue[J]. Clin Cases Miner Bone Metab,2009,6(2):149-154.
[8]Huang LQ,He HC,He CQ,et al.Clinical update of pulsed electromagnetic fields on osteoporosis[J].Chin Med J(Engl), 2008,121(20):2095-2099.
[9]Sun LY,Hsieh DK,Lin PC,et al.Pulsed electromagnetic fields accelerate proliferation and osteogenic gene expression in human bone marrow mesenchymal stem cells during osteogenic differentiation[J].Bioelectromagnetics,2010,31(3):209-219.
[10]Song MY,Yu JZ,Zhao DM,et al.The time-dependent manner of sinusoidal electromagnetic fields on rat bone marrow mesenchymal stem cells proliferation,differentiation,and mineralization[J].Cell Biochem Biophys,2013.[Epub ahead of print].
[11]Ceccarelli G,Bloise N,Mantelli M,et al.A comparative analysis of the in vitro effects of pulsed electromagnetic field treatment on osteogenic differentiation of two different mesenchymal cell lineages[J].Biores OpenAccess,2013,2(4):283-294.
[12]Luo F,Hou T,Zhang Z,et al.Effects of pulsed electromagnetic field frequencies on the osteogenic differentiation of human mesenchymalstem cells[J].Orthopedics,2012,35(4):e526-e531.
[13]Markov MS.Angiogenesis,magnetic fields and'window effects'[J].Cardiology,2010,117(1):54-56.
[14]Kim HK,Cho SG,Kim JH,et al.Mevinolin enhances osteogenic genes(ALP,type I collagen and osteocalcin),CD44,CD47and CD51expression during osteogenic differentiation[J].Life Sci,2009,84(9-10):290-295.
[15]Yamamoto Y,Ohsaki Y,Goto T,et al.Effects of static magnetic field on bone formation in rat osteoblast culture[J].Dent Res,2003,82(2):962-966.
[16]Huang HM,Lee SY,Yao WC,et al.Static magnetic fields upregulate osteoblast maturity by affecting local differentiation factors[J].Clin Orthop Relat Res,2006,447:201-208.
[17]Feng SW,Lo YJ,Chang WJ,et al.Static magnetic field exposure promotes differentiation of osteoblastic cells grown on the surface of a poly-L-lactide substrate[J].Med Biol Eng Comput,2010,48(8):793-798.
Effects of Static Magnetic Field on Proliferation and Osteogenic Differentiation of Mesenchymal Stem Cells
SONG Guo-li,ZHOU Cui-hong,ZHANG Yu,et al.College of Life Sciences,Shenzhen University,Shenzhen 518060,Guangdong,China
ObjectiveTo investigate the effect of exposure to 0.25 T,0.35 T,0.42 T static magnetic fields(SMF)on the proliferation and osteogenic differentiation of mesenchymal stem cells(MSCs).MethodsPrimary bone marrow MSCs were obtained from Sprague-Dawley rats and screened by adhesive method.MSCs were exposed to 0.25 T,0.35 T,0.42 T SMF continuously and 24 h intermittently respectively. The cell proliferation activity was detected by Cell Counting Kit(CCK-8)assay.The osteogenic differentiation markers including alkaline phosphatase(ALP)activity and osteocalcin were analyzed after continuously exposure to 0.35 T SMF.ResultsCompared with the control group,the proliferation activity of SMF-treated cells significantly decreased,especially on the 7th day(P<0.001)after continuous exposure, and on the 2nd to 8th day in 0.25 T,0.35 T SMF intermittent exposure groups(P<0.001).Both the alkaline phosphatase activity and the level of osteocalcin significantly increased in MSCs after continuous exposure to 0.35 T SMF(P<0.05).ConclusionContinuous or intermittent exposure to 0.25 T,0.35 T and 0.42 T SMF could effectively inhibit the proliferation of MSCs.Continuous exposure to 0.35 T SMF could enhance the osteogenic differentiation of MSCs.
static magnetic field;mesenchymal stem cells;proliferation;osteogenic differentiation;rats
10.3969/j.issn.1006-9771.2014.04.005
R329
A
1006-9771(2014)04-0322-05
2013-11-28
2014-01-17)
深圳市科技研发资金基础研究计划项目(No.JC201005280537A)。
深圳大学生命科学学院,广东深圳市518060。作者简介:宋国丽(1976-),女,汉族,山东莱阳市人,博士,副教授,主要研究方向:细胞生物学。

