溶血磷脂酰胆碱在肝脏疾病中的研究进展
宋丹军,潘家琪,李鹏旭,褚赞波,冯 达,刘爱明,杨菊林
(宁波大学医学院生理学与药理学研究室,浙江宁波 315211)
肝脏疾病和肝毒性对人类的健康构成了极大的威胁。在美国平均每年有2万5千多人死于慢性肝病和肝硬化,肝脏疾病已经成为主要的死亡原因之一[1]。在新西兰报告的药物不良反应中,药物性肝损伤占4.2%[2],在美国的住院黄疸的病人病因中,药物性肝损伤占2%~5%[3]。人们对肝脏疾病和肝毒性的研究越来越多,因此,找到更准确、更敏感的肝脏疾病生物标志物也变的更加重要。目前临床常用的肝脏疾病和毒性的检测指标主要包括谷丙转氨酶(alanine transaminase,ALT)、天门冬氨酸氨基转移酶(aspartate transaminase,AST)、碱性磷酸酶(aspartate transaminase,ALP)等。寻找肝脏疾病发生、发展过程中的相关代谢产物及其变化规律有助于研究肝病的发生及发展机制,为部分肝病的预防、诊断和治疗提供依据。
实验和临床研究表明,溶血磷脂酰胆碱类(lysophosphatidylcholines,LPCs)物质在多种肝脏疾病和肝毒性中有明显的变化。本文综述了近年来LPCs与肝脏疾病和化学性肝毒性关系的一些新认识,特别是其在实验性肝脏疾病模型和临床肝脏疾病中的变化,为肝脏疾病的基础研究与临床治疗提供参考。
1 LPCs的体内代谢与生物学功能
LPCs是磷脂质中的一类物质,又称溶血卵磷脂,不溶于丙酮、乙醚;LPCs的分子结构通式见Fig 1。LPCs在细胞膜和组织中少量或微量存在,其在细胞膜的含量≤3%,在血浆中占8%~12%,正常的浓度范围是12~166μmol·L-1。LPCs具有细胞毒性,使内皮细胞变性、坏死、脱落,其含量高的时候会发生溶血反应,破坏纤溶和凝血系统的平衡;在组织中,LPCs能够运输甘油磷脂成分,如脂肪酸、磷脂酰甘油和胆碱。
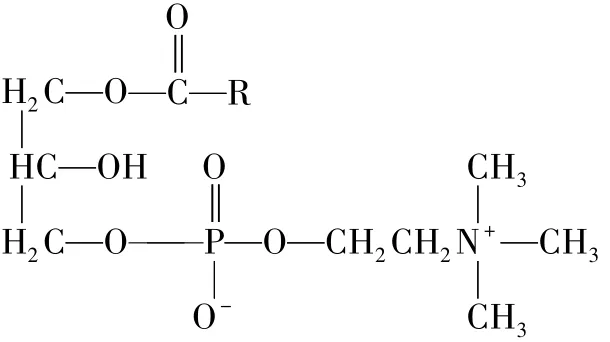
Fig 1 Chem ical scaffold of LPCs
血浆中的LPCs部分由分泌型磷脂酶A2(secretory phospholipase A2,sPLA2)水解磷脂失去一分子的脂肪酸产生。组织中的LPCs也可以通过水解磷脂酰胆碱(phosphatidylcholine,PC)而生成,并依靠磷脂酶 A2(phospholipase A2,Pla2)作为脱乙酰化/再乙酰化循环的一部分来调控整个分子的合成。LPCs的合成与分解代谢主要发生在肝脏,并表现为血浆中LPCs水平的波动,因此其在诊断和防治肝脏疾病中有一定的价值。LPCs在肝脏中可以通过卵磷脂胆固醇酰基转移酶(lecithin cholesterol acyltransferase,Lcat)催化 PC生成,在溶血磷脂酰胆碱酰基转移酶(lysophosphatidylcholine acyltransferase,Lpcat)1-4,溶血磷脂酶 A1(lysophospholipase A1,Lypla1)和核苷酸内焦磷酸酶/磷酸二酯酶(ectonucleotide pyrophosphatase/phosphodiesterase2,Enpp2)等代谢酶的作用下,LPCs又能被分解代谢。
已有研究表明LPCs在人体内某些疾病中会发生变化,如LPCs能调节低密度脂蛋白的代谢,参与固醇引起的动脉粥样硬化病变[4-5];可以诱导细胞膜脂质过氧化而损伤内皮细胞[6];LPCs也可以激活白细胞杀死入侵的细菌,调控单核巨噬细胞和淋巴细胞的免疫功能,促进体内的炎症反应,预防败血症[7]。由于多种肝脏疾病和药物引起的肝损伤中血浆LPCs的水平发生了明显的变化,随着研究的深入,LPCs可能会成为肝脏疾病和肝毒性损伤的生物标志物,对肝脏疾病和药物肝毒性的诊断与治疗发挥重要作用。
2 LPCs与肝癌的关系
在大鼠肝癌的模型中,学者们对♂ SD大鼠每周腹腔注射1次70 mg·kg-1的二乙基亚硝胺,每两周处死1只大鼠以研究癌变进展,并在6~20周每两周收集隔夜空腹的大鼠血清。该研究发现,在8~10周炎症时期,LPC 22∶5的水平下降,第16周后,随着肿瘤的生长,代谢物LPC 22∶5水平明显升高,因此推测LPC 22∶5是癌症的代谢标志物之一[8]。为了验证该标志物在临床上的实用性,该课题组又通过对262个肝癌患者、76个肝硬化患者和74个乙型肝炎病毒感染的患者进行临床研究,发现这个代谢物对肝癌具有较高的敏感性和特异性[8]。但另有学者通过对Fisher大鼠肝癌模型,以及肝癌和肝硬化患者的血清进行代谢组学研究,发现LPC 24∶0可能是肿瘤的生物标志物[9];可见,肝脏肿瘤、肝硬化等病变过程中确实伴随LPCs的变化,但基于检测手段的不同和实验设计的差异,究竟哪一个LPC是肿瘤的特异性标志物有待进一步研究。
另一项研究通过二乙基亚硝胺诱导建立大鼠肝炎-肝硬化-肝癌动物模型,运用液相色谱-质谱联用分析技术(LC-MS)研究了大鼠肝癌模型,对血浆和肝组织进行代谢组学研究,观察血浆小分子在不同阶段的变化,寻找、筛选及鉴定血浆代谢产物分子标志物,结果发现LPC 22∶5在18周之后浓度升高,并且其可以区分肝癌早期(16周)和肝癌进展期(20周)[10]。又通过对28例慢性肝炎、28例肝硬化和45例肝癌病人进行代谢组学的研究,将动物实验中发现的区分肝癌与非肝癌的代谢产物与临床肝炎、肝硬化和肝癌病人的血浆代谢组数据进行比较[10],结果发现LPC 22∶5是其中一个潜在的分子标志物。
Patterson等[11]基于超高效液相色谱-三重四级杆-飞行时间质谱联用(UPLC-ESI-QTOFMS)技术对20例肝癌患者的血浆进行了代谢组学分析,并通过把健康人和肝硬化患者作为对照组,发现与肝硬化患者相比,肝癌患者中的LPC 14∶0、LPC 20∶3和LPC 22∶6的水平明显下降,与健康的人相比,肝癌患者中脱氧胆酸的浓度明显升高,LPC 14∶0、LPC 16∶0、LPC 18∶1、LPC 20∶2、LPC 20∶3、LPC 20∶4、LPC 20∶5的浓度下降。结果表明肝硬化能够降低肝癌患者血清中LPCs的浓度。
国内学者也对肝癌患者的肝组织代谢物谱进行了分析,并寻找潜在的肿瘤代谢标志物。学者们收取了13例原发性肝癌患者(经病理学确认)的肝癌组织、癌旁过渡组织、正常肝组织标本,利用LC-MS技术对样本进行检测,结果发现LPC 17∶0和LPC 18∶0在过渡组织和癌组织中均明显上调[12]。在研究病毒性肝炎所致的肝癌患者的血清代谢物谱中,发现了26种差异性代谢物,其中LPC 20∶1、LPC 20∶2、LPC P-18∶0和LPC 15∶0被鉴定为潜在的原发性肝癌的肿瘤标志物[13]。另一项研究通过对23名肝癌患者和22名肝硬化患者的粪便代谢物检测分析,发现LPC 16∶0和LPC 18∶0的浓度明显升高[14]。
可见,LPCs在肝癌实验模型和临床患者中均变化明显,但不同的学者所发现的标志LPC成分并不相同,究竟哪一些LPCs可以做为肝癌的警示标志物有待于在统一的实验方案中进行确认。
3 LPCs与胆汁淤积的关系
在用胆酸(cholic acid,CA)食饲野生型小鼠和PPARα-/-小鼠的实验中,PPARα-/-小鼠体内血清 LPC 16:0、LPC 18:0下降,磷脂的体内稳态被破坏。说明PPARα对胆汁酸和LPCs的合成、运输和分泌起着重要的调控作用[15]。我们课题组的研究表明,PPARα激动剂吉非罗齐食饲干预野生型小鼠和PPARα-/-小鼠,结果野生型小鼠中胆汁酸水平明显升高,LPC 16∶0和LPC 18∶1明显升高,而LPC 18∶0和LPC 22∶6明显降低,基因表达检测结果支持了这些代谢物变化的趋势[16]。
石胆酸(lithocholic acid,LCA)是引起肝毒性的有效化学物质。给予♀法尼酯X受体基因敲除(FXR-/-)小鼠质量分数为0.006克/百克的LCA食饲干预后,对血清LPCs成分进行定量,发现血清 LPC 16∶0、LPC 18∶0、LPC 18∶1和LPC 18∶2的水平明显下降,提示LPCs可能是石胆酸型胆汁淤积的生物标志物[17]。另一项研究采用了Smad3-/-小鼠,在给予质量分数为0.006克/百克的 LCA食饲干预后对小鼠血清中的BA和LPCs进行测定,结果显示LCA暴露后BA的水平增加,LPCs的水平下降[18]。
在上述胆汁淤积模型中,多个LPCs的稳态被打乱,但在不同的模型中,它们的变化趋势不完全相同,因此临床实践中无论LPCs升高还是降低,都应当警惕胆汁淤积的发生。
4 LPCs与肝硬化的关系
早期的研究表明,LPCs与硫代乙酰胺诱导慢性肝细胞坏死有关[19]。应用利福平(rifampicin,RIF)对拟人化(hPXR)小鼠、Pxr-/-小鼠、野生型小鼠以及 TgCYP3A4/hPXR小鼠进行预处理并用扑热息痛(acetaminophen,APAP)干预后,血清代谢组学显示LPC 18∶0、LPC 20∶3、LPC 20∶4、LPC 22∶6和LPC 18∶3的水平明显下降,LPCs的变化与毒性升高有关[20]。研究显示LPCs可以被多种P450s代谢[21],50% ~75%的依赖 P450的花生四烯酸(arachidonic acid,AA)代谢物产生于肝脏微粒[22],因此,利福平诱导的hPXR活化作用可能加强LPCs分解代谢,而LPCs/AA的代谢物又可能会加重肝病,特别是肝硬化。
在临床研究中,对17名肝硬化患者和24名健康人的粪便代谢物进行检测,发现他们的代谢物中LPC 16∶0、LPC 18∶0、LPC 18∶1和LPC 18∶2的浓度明显增加,而胆汁酸和胆色素的浓度下降[23],表明肝硬化患者中伴随肝功能损伤,脂肪酸及脂质的代谢稳态也发生紊乱。另一项研究对18名酒精性肝硬化和19名乙肝病毒引起的肝硬化患者的血液样品进行了分析,结果发现在酒精性肝硬化和乙肝病毒引起的肝硬化患者的血清样本中,LPC 16∶0、LPC 18∶0、LPC 18∶2、LPC 18∶3、LPC 20∶3和 LPC 20∶5的浓度明显下降[24]。因此,LPCs可能是酒精性肝硬化和乙肝病毒引起的肝硬化的鉴别诊断的生物指标,与另一份研究报告LPCs是肝硬化的代谢标志物的结论相一致[25],证明了LPCs预警肝硬化疾病中的潜在价值。
5 LPCs与脂肪肝的关系
非酒精性脂肪肝炎(non-alcohol steatohepatitis,NASH)的发病机制尚未清楚,但是通过脂肪细胞凋亡模型进一步了解了非酒精性脂肪肝炎的发病机制。Han等[26]对棕榈酸(palmitic acid,PA)诱导的肝细胞凋亡进行研究,对小鼠肝细胞中的LPCs含量进行测量,结果发现LPCs是肝细胞脂性凋亡的一个死亡效应器。此前已有研究表明外源性的LPCs能诱导细胞凋亡[27-28],而在大多数内源性血清代谢物中,代谢物LPCs和胆汁酸同样被认为是NASH小鼠中重要的代谢改变物,并且,在NASH患者血清中,牛黄胆酸盐的增加和多种LPCs的减少已经被报道[29-30]。之后,Han等[26]用 60 mg·kg-1的LPCs对ICR小鼠进行尾静脉注射,AST/ALT的水平明显升高,结果验证了他们之前的假设:LPCs参与肝细胞损伤。
Tanaka等[31]用MCD饲料食饲♂ C57BL小鼠诱导非酒精性脂肪性肝炎,6~8周后对小鼠进行处理,对传统的由MCD饮食诱导的NASH小鼠模型的血清代谢物进行分析,结果发现在这些小鼠中LPC 16∶0、LPC 18∶0和LPC 18∶1的含量明显下降,LPCs的代谢功能在NASH小鼠中被破坏,可能是肝脏炎症加强的信号。此前也有研究表明,在肝细胞中部分物质的积累可以导致脂质代谢物如LPCs的生成,致使肝细胞死亡;而细胞的死亡激活炎症通道,从而导致炎症细胞的募集[7,32-33]。
国内学者通过调查、比较酒精性肝损伤的裸鼠和带有一个异种肝细胞癌移植的裸鼠的代谢物;血清中代谢物进行的分析表明,与对照组相比,饱和或不饱和的溶血磷脂酰胆碱类在肝损伤和肝细胞癌异种移植这两组小鼠中减少,而含有多不饱和脂肪酸的溶血磷脂酰胆碱类则升高[34]。这些结果表明血清中的LPCs可能是酒精性脂肪肝和非酒精性脂肪肝两种疾病的生物标志。
6 LPCs在病毒性肝炎中的变化
研究数据显示,与健康志愿者相比,37名慢性乙型肝炎急性肝功能恶化的患者血清中,LPC 18∶0、LPC 16∶0、LPC 18∶1和LPC 18∶2可能是慢性乙型肝炎急性肝功能恶化的潜在生物标志物[35]。在HBV感染的不同阶段,LPC 14∶0、LPC 16∶0、LPCP-18∶1、LPCP-18∶0、LPC 17∶0、LPC 18∶3、LPC 18∶0和LPC 20∶5等LPC成分的浓度在各组中均下降,在免疫清除期中下降尤为明显[36]。这些重要的代谢物都与肝炎的病理生理过程有关,这些LPCs被认为是免疫耐受期潜在的特异生物标志物,它们在肝细胞的损伤、修复、能量代谢、脂肪酸和胆汁酸的生物合成和炎症的进展中发挥重要作用。
在丙型肝炎患者中,病毒自发清除组、慢性丙型肝炎组和健康组之间的差异代谢物包括LPC 22∶5、LPC 16∶0,说明丙型肝炎感染后的脂质代谢稳态也发生变化[37]。LPCs能够引发各种促炎效应,例如上调黏附分子和增加内皮通透性等[38],这一特性也与LPCs在肝炎中水平变化有关。
7 结论
综上可见,LPCs 22∶5已经在多个实验中被推测为可能的肝细胞癌生物标志物。在胆汁淤积型疾病中,LPC 18∶0在多个实验中均下降,这对寻找胆汁淤积型疾病的生物标志物提供方向。LPC 22∶5、LPC 16∶0等多个成分都是乙型和丙型肝炎病毒共同的标志成分。可见这些常见的肝脏疾病和化学性肝毒性模型中都存在LPCs代谢稳态的破坏。由于检测手段和实验设计的差异,不排除它们可能有共同的标志物没有被确认,并且这些LPCs产生的机制尚没有进行系统的研究和阐释。采用统一的实验设计和实验平台,发现和确认共同的生物标志物,并发现其发生变化的生化机制,预期能够对肝脏疾病和肝毒性的基础研究、临床诊断和治疗产生巨大的推动作用,也是今后科学家需要面对的重要议题。
参考文献:
[1] Miniño A M,Murphy S L,Xu JQ,et al.Deaths:final data for 2008[J].Nat Vital Stat Rep,2011,59(10):1-126.
[2] LeeW M.Drug-induced hepatotoxicity[J].New England JMed,2003,349(5):474-85.
[3] Larrey D.Drug-induced liver diseases[J].JHepatol,2000,32:77-88.
[4] Schmitz G,Ruebsaamen K.Metabolism and atherogenic disease association of lysophosphatidylcholine[J].Atherosclerosis,2010,208(1):10-8.
[5] Domeij H,Hua X,Su J,et al.Annexin A5 inhibits atherogenic and pro-inflammatory effects of lysophosphatidylcholine[J].Prostaglandins Other Lipid Med,2013,106:72-8.
[6] 刘 勇,余艳荣,彭维杰,等.吴茱萸次碱改善溶血性磷脂酰胆碱诱导的内皮细胞缝隙连接细胞间通讯功能障碍[J].中国药理学通报,2013,29(11):1514-9.
[6] Liu Y,Yu Y R,PengW J,etal.Rutaecarpine prevents the disfunction of gap junction inter-cellular communication induced by LPC in endothelial cells[J].Chin Pharmacol Bull,2013,29(11):1514-9.
[7] Yan JJ,Jung JS,Lee JE,etal.Therapeutic effects of lysophosphatidylcholine in experimental sepsis[J].NatureMed,2004,10(2):161-7.
[8] Tan Y X,Yin PY,Tang L,etal.Metabolomics study of stepwise hepatocarcinogenesis from themodel rats to patients:potential biomarkers effective for small hepatocellular carcinoma diagnosis[J].Mol Cell Proteomics,2012,11(2):1-12.
[9] Shariff M,Lewis M,Want E,et al.PWE-264 blood lipidomic profiling of hepatocellular carcinoma in human and animal studies identifies lysophosphatidylcholine(24,0,0),a discriminatory biomarker[J].Gut,2012,61(Suppl 2):A405.
[10]汤 靓.DEN诱导大鼠肝癌模型的代谢组学研究[D].第二军医大学,2010.
[10]Tang L.Metabonmic investigations of DEN induced hepatocellular carcinoma in SD rat[D].The Second Military Medical University,2010.
[11]Patterson A D,Maurhofer O,Beyoglu D,etal.Aberrant lipidmetabolism in hepatocellular carcinoma revealed by plasmametabolomics and lipid profiling[J].Cancer Res,2011,71(21):6590-600.
[12]范志娟.肝细胞肝癌患者组织代谢物的研究[D].天津医科大学,2011.
[12]Fan Z J.The study on tissuemetabolomites in hepatocellular carcinoma patients[D].Tianjin Medical Unversity,2011
[13]丁黎莉.基于UPLC/Q-TOF-MS技术的肝硬化和肝癌患者血清代谢组学研究[D].吉林大学,2011.
[13] Ding L L.A metabonomics study about liver cirrhosis and liver cancer plasma based on UPLC/Q-TOF-MS[D].Jilin Universcity,2011.
[14]Cao H C,Huang H J,Xu W,etal.Fecalmetabolome profiling of liver cirrhosis and hepatocellular carcinoma patients by ultra performance liquid chromatography-mass spectrometry[J].Anal Chim Acta,2011,691(1-2):68-75.
[15]Li F,Patterson A D,Krausz KW,et al.Metabolomics reveals an essential role for peroxisome proliferator-activated receptor alpha in bile acid homeostasis[J].J Lipid Res,2012,53(8):1625-35.
[16]Liu AM,Krausz KW,Fang ZZ,etal.Gemfibrozildisrupts lysophosphatidylcholine and bile acid homeostasis via PPARαand its relevance to hepatotoxicity[J].Arch Toxicol,2014,88(4):983-96.
[17]Matsubara T,Tanaka N,Patterson A D,et al.Lithocholic acid disrupts phospholipid and sphingolipid homeostasis leading to cholestasis in mice[J].Hepatology,2011,53(4):1282-93.
[18]Matsubara T,Tanaka N,Sato M,et al.TGF-beta-SMAD3 signaling mediates hepatic bile acid and phospholipid metabolism following lithocholic acid-induced liver injury[J].J Lipid Res,2012,53(12):2698-707.
[19]Osada J,Aylagas H,Mirò-Obradors M,et al.Lyso-phosphatidylcholine is implicated in thioacetamide-induced liver necrosis[J].Biochem Biophys Res Commun,1988,154(2):803-8.
[20]Cheng J,Ma X C,Krausz K W,et al.Rifampicin-activated human pregnane X receptor and CYP3A4 induction enhance acetaminophen-induced toxicity[J].Drug Met Dispos,2009,37(8):1611-21.
[21]Cho E Y,Yun CH,Chae H Z,et al.Lysophosphatidylserine-induced functional switch of human cytochrome P450 1A2 and 2E1 from monooxygenase to phospholipase D[J].Biochem Biophys Res Commun,2008,376(3):584-9.
[22]Sacerdoti D,Gatta A,McGiff JC.Role of cytochrome P450-dependent arachidonic acidmetabolites in liver physiology and pathophysiology[J].Prostagl Other Lipid Med,2003,72(1):51-71.
[23]Huang H J,Zhang A Y,Cao H C,etal.Metabolomic analyses of faeces reveals malabsorption in cirrhotic patients[J].Dig Liver Dis,2013,45(8):677-82.
[24]Lian JS,LiW,Hao SR,et al.A serum metabonomic study on the difference between alcoholand HBV-induced liver cirrhosis by ultraperformance liquid chromatography coupled tomass spectrometry plus quadrupole time-of-flight mass spectrometry[J].Chin Med J,2011,124(9):1367-73.
[25]杜振华,张 磊,刘树业.液相色谱-质谱联用系统在肝硬化不同阶段代谢轮廓研究中的应用[J].色谱,2011,29(4):314-9.
[25]Du Z H,Zhang L,Liu S Y.Application of liquid chramatographymass spectrametry in the study ofmetabolic profiling of cirrhosis in different grades[J].Chin JChromatography,2011,29(4):314-9.
[26]Han M S,Park SY,Shinzawa K,et al.Lysophosphatidylcholine as a death effector in the lipoapoptosis of hepatocytes[J].J Lipid Res,2008,49(1):84-97.
[27]Takahashi M,Okazaki H,Ogata Y,et al.Lysophosphatidylcholine induces apoptosis in human endothelial cells through a p38-mitogen-activated protein kinase-dependentmechanism[J].Atherosclerosis,2002,161(2):387-94.
[28]Masamune A,Sakai Y,Satoh A,et al.Lysophosphatidylcholine induces apoptosis in AR42Jcells[J].Pancreas,2001,22(1):75-83.
[29]Puri P,Wiest M M,Cheung O,et al.The plasma lipidomic signature of nonalcoholic steatohepatitis[J].Hepatology,2009,50(6):1827-38.
[30]Kalhan SC,Guo L,Edmison J,etal.Plasmametabolomic profile in nonalcoholic fatty liver disease[J].Metabolism,2011,60(3):404-13.
[31]Tanaka N,Matsubara T,Krausz KW,et al.Disruption of phospholipid and bile acid homeostasis in mice with nonalcoholic steatohepatitis[J].Hepatology,2012,56(1):118-29.
[32]Kakisaka K,Cazanave SC,Fingas CD,etal.Mechanisms of lysophosphatidylcholine-induced hepatocyte lipoapoptosis[J].Am J Physiol Gastroint Liver Physiol,2012,302(1):G77.
[33]Ruiz A G,Casafont F,Crespo J,et al.Lipopolysaccharide-binding protein plasma levels and liver TNF-alpha gene expression in obese patients:evidence for the potential role of endotoxin in the pathogenesis of non-alcoholic steatohepatitis[J].Obesity Surgery,2007,17(10):1374-80.
[34]Li S,Liu H,Jin Y,et al.Metabolomics study of alcohol-induced liver injury and hepatocellular carcinoma xenografts inmice[J].J Chromatogr B Analyt Technol Biomed Life Sci,2011,879(24):2369-75.
[35]Yang J,Zhao X,Liu X,et al.High performance liquid chromatography-mass spectrometry formetabonomics:potentialbiomarkers for acute deterioration of liver function in chronic hepatitis B[J].JProteome Res,2006,5(3):554-61.
[36]邵 雪.基于HPLC/TripleTOF-MS/MS技术慢性乙型肝炎感染不同阶段的代谢组学研究[D].吉林大学,2012.
[36]Shao X.A metabonomics study of chronic hepatitis B in different stages using HPLC/TripleTOF-MS/MS[D].Jinlin University,2012.
[37]姜 翠,吴瑞红,王晓美,等.丙型肝炎病毒自发清除者的血清代谢组学研究[J].中华传染病杂志,2013,31(002):101-6.
[37]Jiang C,Wu R H,Wang XM,etal.A serum metabonomics study of hepatitis C virus spontaneous clearance patients[J].Chin J Infect Dis,2013,31(002):101-6.
[38]Zalewski A,Macphee C.Role of lipoprotein-associated phospholipase A2 in atherosclerosis:biology,epidemiology,and possible therapeutic target[J].Arterioscler Thromb Vasc Biol,2005,25(5):923-31.