芍药苷药物代谢动力学研究进展
王 春,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽合肥 230032)
白芍总苷(total glucosides of paeony,TGP)是从芍药根部提取的有效部位,成分主要包括芍药苷(paeoniflorin,Pae,见Fig 1)、羟基芍药苷、芍药花苷、芍药内酯苷和苯甲酰芍药苷等。TGP有良好的抗炎和免疫调节作用[1],因此上世纪80年代初至90年代末,国内学者将TGP开发成用于治疗类风湿关节炎(rheumatoid arthritis,RA)的抗炎免疫调节药,产生了重要的经济社会效益。临床用药实践表明,TGP治疗RA效果肯定,能明显缓解病人关节疼痛、改善关节功能;长期用药不良反应较少,耐受性较好;但起效较为缓慢。Pae是TGP主要活性成分,也具有良好的抗炎和免疫调节活性[2]。研究发现[3],Pae口服绝对生物利用度约为 3% ~4%,提示TGP起效缓慢可能与Pae口服吸收较差存在一定关系。基于药物生物活性发挥与其药动学过程密切相关,故本文参考近年来相关文献,简述Pae的药代动力学过程,并就一些存在的问题做一初步探讨。
1 Pae药代动力学过程
1.1 吸收 1995年 Takeda等[3]报道 Pae口服吸收较差,其绝对生物利用度约为3%~4%(Tab 1);在体肠吸收结果表明[4]:Pae在整个小肠均有吸收,无特征性吸收部位;各个肠段之间吸收渗透率大小和吸收速率近似相同;吸收机制为被动扩散。近年来研究证实,Pae吸收较差主要与肠首过效应、药物转运体外排蛋白和理化性质有关。首先,芍药甘草汤[5](剂量相当于 Pae 25 mg·kg-1)灌胃大鼠后,血浆 Pae和代谢产物芍药代谢素-I(paeonimetabolin-I,PM-I)血药浓度峰值(Cmax)分别为 0.21 mg·L-1和 2.05 mg·L-1,同时PM-I药时曲线下面积(AUC)约为前者30倍,但与抗菌药氧氟沙星或阿莫西林+甲硝唑联合运用后,PM-I Cmax分别下降至 0.25 mg·L-1和 0.04 mg·L-1,而 Pae Cmax则分别上升至0.59 mg·L-1和 0.95 mg·L-1。此外研究还发现白芍煎剂[6](剂量相当于 Pae 110 mg·kg-1)灌胃大鼠,Pae另一代谢产物芍药苷元(paeoniflorgenin,PG)在血浆中Cmax高达8 mg·L-1(Tab 1),而在同等分析条件下却无法检测出原型药Pae。在此基础上,Liu等[7]进一步证实,Pae可在肠道被糖苷酶降解成 PG。值得一提的是,PM-I[5]和 PG[6]血药达峰时间(Tmax)分别为3.0 h和10 min(Tab 1),提示 Pae口服后主要以PM-I和PG代谢物形式进行吸收。其次,Pae[8-9]是药物外排蛋白P糖蛋白(p-glycoprotein,p-gp)的作用底物。p-gp抑制剂维拉帕米、奎尼丁和具有抑制p-gp活性的药用辅料(如吐温80)与Pae联合给药后,均可提高Pae在肠道吸收。再次,Pae亲水性较强,亲脂性较弱,跨膜吸收能力较弱。通过去除Pae结构中亲水性吡喃糖获得的PG渗透结肠癌Caco-2细胞膜能力是Pae的48倍[7],同样增加脂溶性化学基团获得的Pae脂肪族酯化物[10]和芳香族酯化物体外跨Caco-2细胞膜吸收能力明显强于Pae。整体实验上,研究[11]证实,Pae-磺酸盐的苯甲酸酯(剂量110 mg·kg-1)灌胃小鼠AUC均值为 1343.8 mg·min·L-1,而 Pae-磺酸盐和 Pae AUC均值分别为 478.5 mg·min·L-1和 615.7 mg·min·L-1,提示Pae脂溶性较低是制约其口服吸收影响因素之一。
1.2 分布 大鼠灌胃 TGP[12](2.82 g·kg-1),Pae组织分布特征如下:1 h,小肠>胃>大肠>肾>肝>肺>脾>心;3h,小肠>胃>大肠>肾>脾>肝>肺>心;6h,小肠>大肠>胃>肾>肝>脾>肺>心,提示被吸收的原型药Pae在体内血流量较大的脏器均有一定分布。此外,大鼠皮下[13]注射 Pae(10 mg·kg-1)20 min后,脑组织 Pae含量即达到峰值153μg·L-1,而大鼠静脉注射白芍提取物[14](剂量相当于60 mg·kg-1Pae)5 min后,海马组织 Pae含量已大于2.5 μg·g-1。鉴于Pae亲脂性较差,为何能迅速通过血脑屏障到达脑组织?推测Pae穿过血脑屏障过程不是单一的被动转运过程,可能还存在主动转运过程。
1.3 代谢 Pae化学结构属于典型的氧苷结构(Fig 1),早期研究结果[15]表明,Pae受肝脏代谢影响较小,但在肠道可受到糖苷酶和厌氧菌群的双重降解作用(Fig 2)。在糖苷酶作用下,降解产物是苷元PG和苯甲酸[7];在肠道菌群作用下,代 谢 产 物 则 是 PM-Ⅰ 和 PM-Ⅱ[7]。 大 鼠 单 次 灌 胃Pae[15],24 h内粪便和尿累积排泄量总和约占给药剂量的11.68%,基于Pae绝对生物利用度不足4%,提示绝大部分Pae在肠道被生物转化为PG或PM。研究表明,芍药甘草汤[5]与氧氟沙星或阿莫西林-甲硝唑联合给药后,Pae肠道的代谢物PM含量比单用Pae分别下降33%和16%,而白芍煎剂[6]灌胃大鼠,PG血浆 Cmax高达8 mg·L-1。通过在体实验[7]进一步研究发现,Pae在肠道约有42%被代谢成PG,说明糖苷酶酶解也是Pae肠道代谢主要途径之一。大鼠灌胃Pae后,血浆和尿液中可检测到一些结构已确认的化合物,包括:Desbenzoylpaeoniflorin、4-O-desbenzoylpaeoniflorin、PM-Ⅰ glucuronide、PM-Ⅰ和 PM-Ⅱ等代谢产物[16](Fig 3),和一些结构信息未完全确定的代谢物,根据分子量推测它们结构可能如Fig 3所示,主要有C10H14O3-sulfate、C10H18O2-glucuronide和C10H18O4-glucuronide。这些研究表明,Pae在体内主要经历I相酯键水解、糖苷键水解和甲基化反应以及Ⅱ相葡萄糖醛酸化和硫酸酯化反应,提示少部分原型药Pae或肠道代谢物经肝脏进入循环系统时可能会被P450酶代谢,但目前尚未见文献报道。

Fig 1 The chem ical structure of Pae

Fig 2 M etabolic pathways of paeoniflorin in intestine[7]
1.4 排泄 早期研究[15]结果表明,大鼠灌胃 Pae(550 mg·kg-1)后,24 h粪便和尿中Pae累积排泄量分别占给药量的 10.61%和 1.08%;大鼠静脉注射 Pae(55 mg·kg-1)后,7 h内胆汁排泄量占总量8.64%,而犬静脉注射 Pae(11.25 mg·kg-1),Pae会迅速出现在尿中,前20 min和7 h内累积排泄量分别占给药量的36.85%和79.3%,7 h内胆汁排泄量占注射量的3.77%。以上结果表明,口服Pae原型药主要经粪便排出体外;静脉注射Pae主要以肾脏排泄,通过胆汁和粪排泄则比较少,Pae药动学参数信息详见Tab 1。
2 影响Pae药动学过程相关因素
2.1 药物合用的影响 目前药物合用研究多集中在对Pae吸收的影响,对Pae体内组织分布特征、代谢途径和代谢物的影响报道较少。在细胞和肠吸收模型上,p-gp抑制剂(如环孢素和维拉帕米)[7]和植物药来源的单体成分(如青藤碱[7]和柴胡皂苷[5])可明显提高 Caco-2细胞摄取 Pae能力;在整体动物实验上,一些植物药活性单体成分(如青藤碱[17]和甘草次酸[18])和植物药[19](如吴茱萸、肉桂、小茴香和花椒)可提高Pae口服吸收并影响其药动学过程,如延长T max[17]、提高 Cmax和 AUC[17-18]、降低清除率(CL)[17-18]、增加表观分布容积(Vd)[17]等。此外,也有研究报道川穹[20]或甘草[21]联合Pae给药均能降低Pae生物利用度。甘草酸[22]联合Pae后,Pae在十二指肠、空肠、回肠和结肠吸收量分别为单用时的 0.61、0.60、0.34、0.60倍,而甘草酸联合 Pae灌胃[23]后,联合组Pae的Cmax和AUC明显降低、CL明显升高,这些研究结果提示甘草酸可能从吸收和代谢两个方面同时影响Pae药动学过程,见Tab 2。

Fig 3 Themetabolites of paeoniflorin in rat’s p lasma and urine[22]
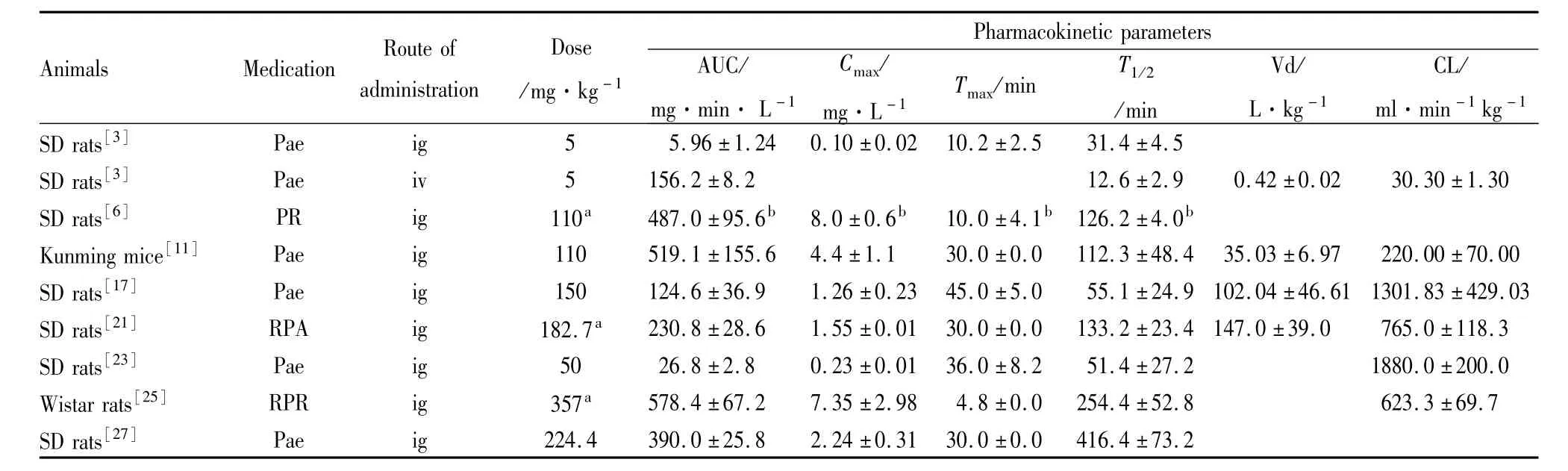
Tab 1 The pharmacokinetic parameters of paeoniflorin and itsmetabolite
2.2 机体状况 在病理状态下,机体某些器官生理功能和正常机体存在差别,从而影响并导致药物体内过程存在一定的差异。在一些肝脏疾病,如大鼠免疫性肝损伤和急性肝炎模型中,Pae AUC[24-25]明显升高、CL明显降低[25],而平均滞留时间[25](MRT)明显延长,提示肝功能异常可致Pae吸收增加以及代谢减慢。基于肝脏对Pae代谢影响较小,肝性疾病通过何种环节影响Pae体内代谢过程值得进一步研究。另外,Pae静脉注射缺血性再灌注大鼠[26],Pae分布半衰期(T1/2a)明显增加、CL明显降低、MRT明显延长;在大鼠血管性痴呆模型[27]中,相比正常大鼠,Pae药动学参数Cmax、AUC明显增加,消除半衰期(T1/2β)明显延长、CL明显下降,详见Tab 2。
2.3 剂型因素 目前,Pae无上市单体制剂,Pae主要作为TGP或其它中药复方制剂有效成分之一被用于临床。一些已报道的Pae相关制剂均处于临床前研究。研究发现,微乳剂[9,28]可明显提高 Pae在大鼠肠道吸收、增加 Cmax和 AUC、降低CL、延长MRT;通过经皮给药途径[29],微乳剂仍可提高Pae生物利用度,血药浓度上升较平稳,具有一定缓释作用;另外,也有研究发现TGP包裹于脂质体[30]静脉注射后,体内消除过程较为缓慢,具备延长作用时间的效果,详见Tab 2。
3 问题与探讨
近年来随着药动学相关文献的报道,Pae体内过程逐渐被阐明,但一些问题仍然未明确。首先,TGP临床上疗效肯定,但起效缓慢,其药效发挥存在明显的滞后效应。作为TGP主要活性成分,Pae生物利用度和体内病变组织分布水平均较低,提示改善Pae口服吸收、增加组织分布量可能是提高TGP疗效的有效手段之一。其次,Pae口服后,相当一部分在肠道被代谢成PG和PM,而PG和PM均具有良好的吸收,但目前PG和PM抗炎免疫调节活性以及体内组织分布特征尚不清楚,因此需要进一步明确PG或PM是否为Pae药理活性的体内物质基础。再次,如何提高Pae口服生物利用度?基于Pae在肠道吸收受到p-gp外排作用,因此联合p-gp抑制剂给药是解决问题的有效手段之一。值得一提的是青藤碱,一方面,青藤碱可提高Pae的吸收,另一方面,青藤碱也具有抗炎及免疫抑制作用,提示两者联合给药后可能会具有药效协同作用,故开发青藤碱与Pae的复方制剂具有良好应用前景。此外,基于Pae亲脂性较弱,对Pae进行酯化修饰也是有效途径之一。非甾体抗炎药胃肠道损伤较为明显,其结构多具有羧酸结构,将这类药物羧酸基团与Pae羟基缩合成酯,所获得的酯化产物口服吸收可能会高于Pae。理论上,酯化产物被吸收后,在体内酯酶催化下重新酯解成Pae和非甾体抗炎药,在药效上可能会起到协同效应,由于Pae具有一定的保护胃黏膜作用,对非甾体抗炎药胃肠道不良反应可能也具有一定的改善作用,这些问题有待进一步研究阐明。

Tab 2 The affecting factors of paeoniflorin pharmacokinetics
参考文献:
[1] 吴华勋,陈镜宇,汪庆童,等.白芍总苷对胶原性关节炎大鼠滑膜β抑制蛋白的影响与其抑制滑膜细胞增殖的关系[J].中国药理学通报,2012,28(7):934-7.
[1] Wu H X,Chen JY,Wang Q T,et al.Relationship between the effectsof total glucosidesof paeony on expression ofβ-arrestinsand inhibition on synoviocyte proliferation from CIA rats[J].Chin Pharmacol Bull,2012,28(7):934-7.
[2] 汪庆童,马昱琨,黄 蓓,魏 伟.芍药苷通过调节前列腺素E2受体抑制大鼠成纤维滑膜细胞增殖[J].中国药理学通报,2012,28(1):43-7.
[2] Wang Q T,Ma Y K,Huang B,WeiW.Inhibitory effect of paeoniflorin on rat fibroblast-like synoviocytes hyperplasia induced by PGE 2 viaβ-arrestin 2 regulating EP2 receptor[J].Chin Pharmacol Bull,2012,28(1):43-7.
[3] Takeda S,Isono T,Wakui Y,et al.Absorption and excretion of paeoniflorin in rats[J].J Pharm Pharmacol,1995,47(12A):1036-40.
[4] Chen Y,Wang J,Yuan L,et al.Interaction of themain components from the traditional Chinese drug pair Chaihu-Shaoyao based on rat intestinal absorption[J].Molecules,2011,16(11):9600-10.
[5] He JX,Akao T,Tani T.Influence of co-administered antibiotics on the pharmacokinetic fate in rats of paeoniflorin and its active metabolite paeonimetabolin-I from Shaoyao-Gancao-tang[J].J Pharm Pharmacol,2003,55(3):313-21.
[6] Hsiu SL,Lin Y T,Wen K C,etal.A deglucosylatedmetabolite of paeoniflorin of the root of Paeonia lactiflora and its pharmacokinetics in rats[J].Planta Med,2003,69(12):1113-8.
[7] Liu Z Q,Jiang Z H,Liu L,Hu M.Mechanisms responsible for poor oral bioavailability of paeoniflorin:Role of intestinal disposition and interactions with sinomenine[J].Pharm Res,2006,23(12):2768-80.
[8] Chan K,Liu ZQ,Jiang ZH,et al.The effects of sinomenine on intestinal absorption of paeoniflorin by the everted ratgut sacmodel[J].JEthnopharmacol,2006,103(3):425-32.
[9] Wang C,Yuan J,Yang Z Y,et al.Pharmacokinetics of paeoniflorin microemulsion after repeated dosing in ratswith adjuvant arthritis[J].Pharmazie,2012,67(12):997-1001.
[10]杨秀伟,郭 洁,徐 嵬.芍药苷类化合物在人源肠 Caco-2细胞单层模型中的吸收转运研究[J].中草药,2013,44(15):2097-104.
[10]Yang X W,Guo J,Xu W.Absorption and transport characteristic of paeoniflorin and its derivatives inmodel of Caco-2 cellmonolayers[J].Chin Tradit Herb Drugs,2013,44(15):2097-104.
[11]Cheng Y,Peng C,Wen F,Zhang H.Pharmacokinetic comparisons of typical constituents in white peony rootand sulfur fumigated white peony root after oral administration to mice[J].J Ethnopharmacol,2010,129(2):167-73.
[12]张玲非,李向军,王玉峰,等.白芍总苷在正常大鼠体内的组织分布研究[J].天然产物研究与开发,2012,24(8):1040-6.
[12]Zhang L F,Li X J,Wang Y F,et al.Tissue distribution of total glucosides of paeony in normal rats[J].Nat Prod Res Dev,2012,24(8):1040-6.
[13]Xia SM,Shen R,Sun X Y,etal.Developmentand validation of a sensitive liquid chromatography-tandem mass spectrometry method for the determination of paeoniflorin in ratbrain and itsapplication to pharmacokinetic study[J].JChromatogr B Analyt Technol Biomed Life Sci,2007,857(1):32-9.
[14]He X,Xing D,Ding Y,etal.Determination of paeoniflorin in rat hippocampus by high-performance liquid chromatography after intravenous administration of Paeoniae Radix extract[J].JChromatogr B Analyt Technol Biomed Life Sci,2004,802(2):277-81.
[15]陈光亮,陈崇宏,徐叔云.芍药甙在兔和大鼠体内药动学研究[J].中国药理学通报,1992,8(4):278-80.
[15]Cheng G L,Chen CH,Xu SY.The studieson pharmacokinetics of paeoniflorin in rabbits and rats[J].Chin Pharmacol Bull,1992,8(4):278-80.
[16]Liang J,Xu F,Zhang Y Z,et al.The profiling and identification of the absorbed constituents and metabolites of Paeoniae Radix Rubra decoction in rat plasma and urine by the HPLC-DAD-ESIIT-TOF-MS(n)technique:a novel strategy for the systematic screening and identification of absorbed constituents and metabolites from traditional Chinesemedicines[J].J Pharm Biomed A-nal,2013,83:108-21.
[17]Liu ZQ,Zhou H,Liu L,etal.Influence of co-administrated sinomenine on pharmacokinetic fate ofpaeoniflorin in unrestrained conscious rats[J].JEthnopharmacol,2005,99(1):61-7.
[18]Xu C H,Wang P,Wang Y,et al.Pharmacokinetic comparisons of two different combinations of Shaoyao-Gancao Decoction in rats:competingmechanismsbetween paeoniflorin and glycyrrhetinic acid[J].JEthnopharmacol,2013,149(2):443-52.
[19]杨祖贻,裴 瑾,刘荣敏,等.温里药配伍提高赤芍效应成分芍药苷生物利用度的研究[J].中国中西医结合杂志,2005,25(9):822-4.
[19]Yang Z Y,Pei J,Liu R M,et al.Study on enhancing bioavailability of paeoniflorin by combined use with Chinese herbs for inner-warming[J].Chin J Integr Med,2005,25(9):822-4.
[20]张 壮,闫彦芳,陈可冀.川穹赤芍配伍比例对芍药苷药代动力学的影响[J].中国中药杂志,2000,25(11):688-91.
[20]Zhang Z,Yan Y F,Chen K J.Effects of Chuanxiong-Chishao dispensing ratio on the pharmacokinetics of paeoniflorin in the canine[J].China JChin Mat Med,2000,25(11):688-91.
[21]Gan P,Zhong M,Huang X,et al.Pharmacokinetic comparisons of albiflorin and paeoniflorin after oral administration of Shaoyao-Gancao-Tang and single herb Paeony decoction to rats[J].Planta Med,2012,78(3):237-43.
[22]李 娜,陈西敬,吴 磊,等.甘草酸对芍药苷大鼠肠吸收的影响[J].时珍国医国药,2008,19(12):2908-9.
[22]Li N,Chen X J,Wu L,et al.Influence of glycyrrhizin on intestinal absorption of paeoniflorin by the everted rat gut sacmodel[J].Lishizhen Med MatMed Res,2008,19(12):2908-9.
[23]刘 卉,单进军,康 安,等.甘草酸和甘草次酸对芍药苷在大鼠体内药动学参数的影响[J].中草药,2013,44(12):1610-4.
[23]Liu H,Shan JJ,Kang A,et al.Effects of glycyrrhizic acid and glycyrrhetinic acid on in vivo pharmacokinetic parameters of paeoniflorin in rats[J].Chin Tradit Herb Drugs,2013,44(12):1610-4.
[24]张玲非,刘敏彦,潘会敏,等.白芍总苷在免疫性肝损伤大鼠体内的药代动力学研究[J].中国药药理通报,2011,27(10):1462-6.
[24]Zhang L F,Liu M Y,Pan H M,etal.Pharmacokinetic study of total glucosides of paeony in immunological liver injured rats[J].Chin Pharmacol Bull,2011,27(10):1462-6.
[25]Jiang F,Zhao Y,Wang J,et al.Comparative pharmacokinetic study of paeoniflorin and albiflorin after oral administration of Radix Paeoniae Rubra in normal ratsand the acute cholestasishepatitis rats[J].Fitoterapia,2012,83(2):415-21.
[26]He X,Xing D,Ding Y,et al.Effects of cerebral ischemia-reperfusion on pharmacokinetic fate of paeoniflorin after intravenous administration of Paeoniae Radix extract in rats[J].JEthnopharmacol,2004,94(2-3):339-44.
[27]Liu J,Wang J S,Kong L Y.Comparative pharmacokinetics of paeoniflorin in plasma of vascular dementia and normal rats orally administrated with Danggui-Shaoyao-San or pure paeoniflorin[J].Fitoterapia,2011,82(3):466-73.
[28]王 春,杨昭毅,聂欣欣,魏 伟.芍药苷微乳在大鼠在体肠吸收动力学研究[J].中国药理学通报,2009,25(2):181-5.
[28]Wang C,Yang Z Y,Nie X X,WeiW.Studies on absorption kinetics of paeoniflorin microemulsion in rat’s intestines[J].Chin Pharmacol Bull,2009,25(2):181-5.
[29]韩旭华,牛 欣.白芍有效成分经皮微乳的抗炎镇痛作用及其药效物质基础[D].北京:北京中医药大学,2006:75-6.
[29]Han X H,Niu X.Study on anti-inflammatory and analgesic effects of percutaneousmicroemulsion ofeffective components in Radix paeoniae alba and its pharmacodynamic material basis[D].Beijing:Beijing University of Traditional Chinese Medicine,2006:75-6.
[30]李东芬,尹蓉莉.白芍总苷脂质体的研究[D].成都:成都中医药大学,2012:57-8.
[30]Li D F,Yin R L.Study on liposome of total glucosides of paeonia[D].Chengdu:Chengdu University of Traditional Chinese Medicine,2012:57-8.