电针合谷穴对大鼠局灶性脑缺血再灌注后脑内毛细血管密度及CD34表达的影响①
马璟曦,罗勇
·专题·
电针合谷穴对大鼠局灶性脑缺血再灌注后脑内毛细血管密度及CD34表达的影响①
马璟曦1,罗勇2
目的 观测电针大鼠双侧合谷穴(LI04)对局灶性脑缺血再灌注后脑内CD34表达及血管新生的影响。方法90只大鼠随机分为正常组(n=6)、模型组(n=42)和电针组(n=42)。模型组和电针组采用线栓法制备大鼠局灶性脑缺血再灌注模型,电针组采用电针治疗。局灶性脑缺血1 h后再灌注,观察再灌注后2 h、12 h、24 h、3 d、7 d、14 d、21 d共7个时相点大鼠神经症状学评分,采用HE染色观察并计算梗死体积和毛细血管密度,免疫组织化学法检测CD34的表达。结果电针组与模型组比较,再灌注后各时间点神经症状学评分降低(P<0.05)。电针组梗死体积显著小于模型组(P<0.001)。与模型组相比,电针组毛细血管密度再灌注后2 h开始增加(P<0.05),再灌注后24 h到再灌注后14 d均较模型组明显增加(P<0.01)。电针组再灌注后3 d CD34阳性细胞表达较模型组明显增加(P<0.01),7 d增加达高峰(P<0.01),14 d仍有显著性差异(P<0.05)。结论电针能促进局灶性脑缺血再灌注后CD34的表达,增加毛细血管密度,促进血管新生。
缺血再灌注;电针;毛细血管密度;CD34;大鼠
[本文著录格式]马璟曦,罗勇,等.电针合谷穴对大鼠局灶性脑缺血再灌注后脑内毛细血管密度及CD34表达的影响[J].中国康复理论与实践,2014,20(3):201-205.
脑缺血损伤后神经修复过程包括神经发生、突触重塑和血管新生。新生血管可以为缺血组织重新提供必需的氧气和营养,并且为新生神经元提供神经营养支持。神经发生和血管新生的作用机制可能是相互联系的。研究表明,缺血区周围毛细血管密度高的脑卒中患者存活时间更长[1]。因此,刺激脑内毛细血管生成的干预措施可能成为临床治疗缺血性脑卒中的手段之一。脑缺血后的血管生成分为血管发生(vasculogenesis)、血管新生(angiogenesis)和动脉形成(arteriogenesis)三个相互联系的过程[2]。血管新生是成人脑缺血后血管生成三种方式中最主要的一种,也是现在主要的研究方向。本文在课题组原有研究工作的基础上[3-4],进一步观察局灶性脑缺血再灌注后大鼠脑内血管内皮细胞(CD34标记)的生成和毛细血管密度以及电针合谷穴(LI04)对它们的影响,初步探讨电针对内源性血管新生的影响及其可能的机制。
1 材料与方法
1.1 实验分组
成年健康雄性Wistar大鼠90只,体重250~300 g,随机分为正常组(n=6)、局灶性脑缺血再灌注模型组(模型组,n=42)、局灶性脑缺血再灌注+电针治疗组(电针组,n=42)。后两组分别分为脑缺血再灌注后2 h、12 h、24 h、3 d、7 d、14 d、21 d共7个时相点,每个时相点6只。正常组不作特殊处理。
1.2 局灶性脑缺血再灌注模型制备
线栓法制备右侧大脑中动脉局灶性脑缺血再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型。3.5%水合氯醛腹腔注射麻醉(1 ml/100 g),大鼠仰卧位固定,经颈部正中切口依次暴露颈总动脉、颈外动脉、颈内动脉颅外段。在颈外动脉残端作一环形切口,将预先处理的栓子尼龙绳线向颈内动脉颅内方向插入17~20 mm,如遇阻力,表明线栓头端已通过大脑中动脉起始部,造成缺血。1 h后拔回线栓至颈外动脉的残端,完成再灌注。模型成功的判断标准[5]:①左侧肢体疼痛回缩迟钝或不出现;②行走时向左侧偏倒或原地向左侧旋转;③提尾倒悬时左上肢不向前下伸;④右侧出现Honer氏征。
1.3 神经症状学评分[6]
大鼠清醒后评分。0分:无神经功能缺失症状;1分:轻度局灶性神经功能缺失(不能完全伸展左侧前肢);2分:中度局灶性神经功能缺失(向左侧转圈);3分:中度局灶性神经功能缺失(向左侧倾倒);4分:不能自发行走,意识水平降低。
1.4 电针刺激方法及参数
电针组参照中国针灸学会实验针灸委员会实验动物穴位图谱,选取双侧合谷穴(LI04)为电针穴位。局灶性脑缺血后45 min,电针刺激上述穴位。每次电针时间为15 min。刺激参数:疏密波F1=40 Hz,F2=60 Hz,空载输出电压1.5 V。对超过1 d的时相点,每天电针1次,最多电针7 d,7 d后自然喂养,不作特殊处理。
1.5 取材
每组动物到达相对应时相点时,麻醉后用生理盐水200 ml快速左心室灌注冲洗,再用4%多聚甲醛(pH 7.4的0.1 mol/L PBS配置)加0.1%焦碳酸二乙酯(DEPC)500 ml先快后慢灌注固定,断头取脑,制备石蜡切片。取相邻切片用于HE染色及免疫组化。
1.6 梗死体积测定
切片脱蜡,HE染色,每隔200µm取一张切片,利用网格计数器对不同平面梗死灶面积进行计数,然后根据梯形法则算每只大鼠梗死灶面积:

V代表梗死灶体积,t代表相邻切片间的距离,A代表每个所选切片的梗死灶面积。观察比较局灶性脑缺血大鼠穴位电针刺激前后梗死灶体积变化。
1.7 毛细血管密度测定
切片脱蜡,HE染色,在400倍视野下计数毛细血管(由单个内皮细胞核围成管壁,管腔直径<10µm),取5个连续缺血区域视野下的均值,以毛细血管数/ mm2表示毛细血管密度。
1.8 CD34免疫组化检测
切片脱蜡至水,抗原热修复92~98℃15 min,滴加封闭液,滴加1∶75小鼠抗大鼠CD34单克隆抗体(Santa Cruz公司)4℃过夜,滴加SABC。DAB显色、脱水、透明、封片。阳性细胞计数:在400倍视野下计数,以胞浆染成棕黄色为阳性细胞。
1.9 统计学分析
每只动物随机选取3张非连续切片,每张切片取10个不连续视野的均值。每组数据用(±s)表示,用SPSS 12.0软件进行t检验,显著性水平α=0.05。
2 结果
2.1 神经症状学评分
电针组与模型组比较,再灌注后2 h、12 h、24 h、3 d神经症状学评分明显降低(P<0.01);再灌注后7 d、14 d、21 d神经症状学评分降低(P<0.05)。见表1。
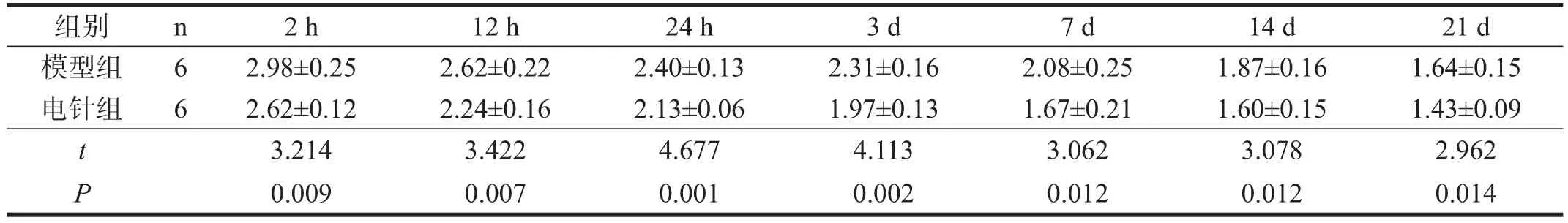
表1 各组神经症状学评分比较
2.2 梗死体积
对连续的脑缺血组织切片(包括视交叉后2~4 mm),HE染色发现,电针组再灌注1 d后在冠状切面上梗死灶累及范围比模型组小,电针组梗死体积(53.86±4.11)mm³显著小于模型组(75.45±4.43)mm³(t= 8.754,P<0.001)。
2.3 毛细血管密度
正常组:毛细血管密度是(132.4±9.5)/mm2。
模型组:再灌注后2 h~21 d均较正常组明显增加(P<0.01),表达增加趋势呈单峰,表达高峰是再灌注后14 d(P<0.01)。
电针组:再灌注后2 h~21 d均较正常组显著增加(P<0.001),表达高峰是再灌注后7 d,高峰出现时间较模型组早。电针组与模型组相比,除再灌注后12 h、21 d外,各时间点均增加(P<0.05)。见表2。
2.4 CD34阳性细胞(血管内皮细胞)计数
CD34阳性细胞主要是在内皮细胞较早期表达,以它作为血管内皮细胞计数。
模型组CD34阳性细胞数在再灌注后2 h与正常组无显著性差异(P>0.05),但仍存在增加的趋势。从再灌注后12 h到再灌注后14 d CD34阳性细胞表达逐渐增加(P<0.01),持续时间较长,直到14 d达高峰,21 d仍未回到正常组水平(P<0.01)。见表3。缺血坏死区周围大脑皮质表达明显增多,排列密集,且强阳性表达,侧脑室脉络膜、室管膜细胞及周围小血管的内皮细胞胞浆呈棕黄色。缺血区内残存细胞形态不清楚,界限不清晰,但仍可见阳性表达。缺血区周围新生细胞不成熟,形态不完整。见图1。
电针组(见图2)CD34阳性细胞数在再灌注后2 h~21 d均较正常组明显升高(P<0.01),高峰出现在再灌注后7 d,表达部位同模型组,但更加广泛。电针组与模型组比较,再灌注后2 h到再灌注后24 h CD34阳性细胞表达逐渐增加,但无显著性差异(P>0.05)。3 d后有显著性差异(P<0.01),14 d仍有显著性差异(P<0.05),21 d无显著性差异(P>0.05)。见表3。缺血侧较缺血对侧表达明显增加,缺血区残存细胞界限模糊,缺血区周围内皮细胞计数增多围绕梗死灶带状近似环形分布。见图2。
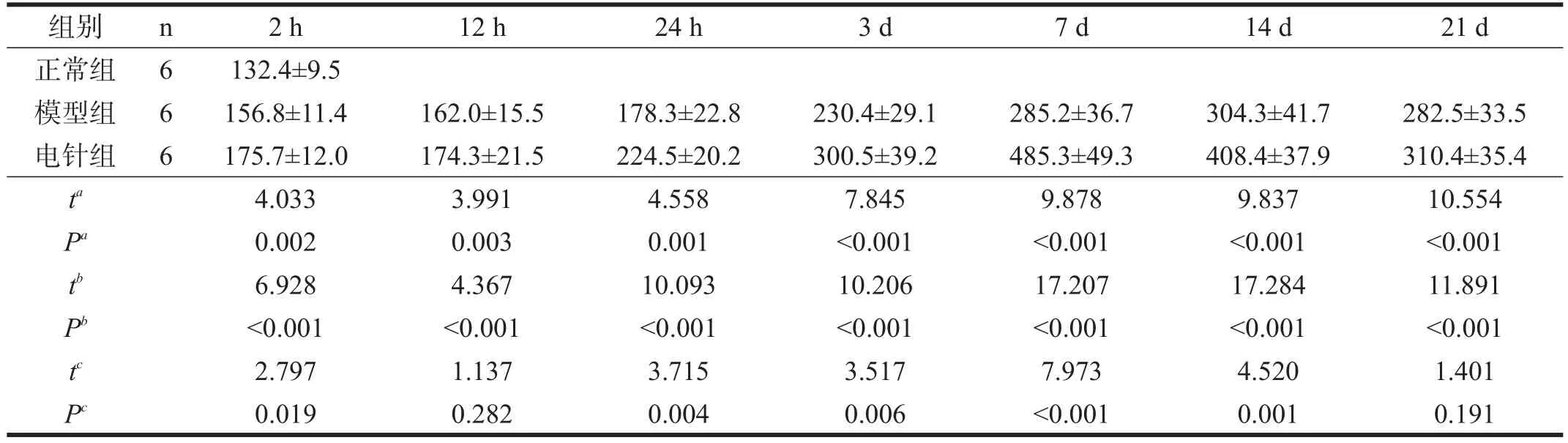
表2 各组毛细血管密度比较(/mm2)
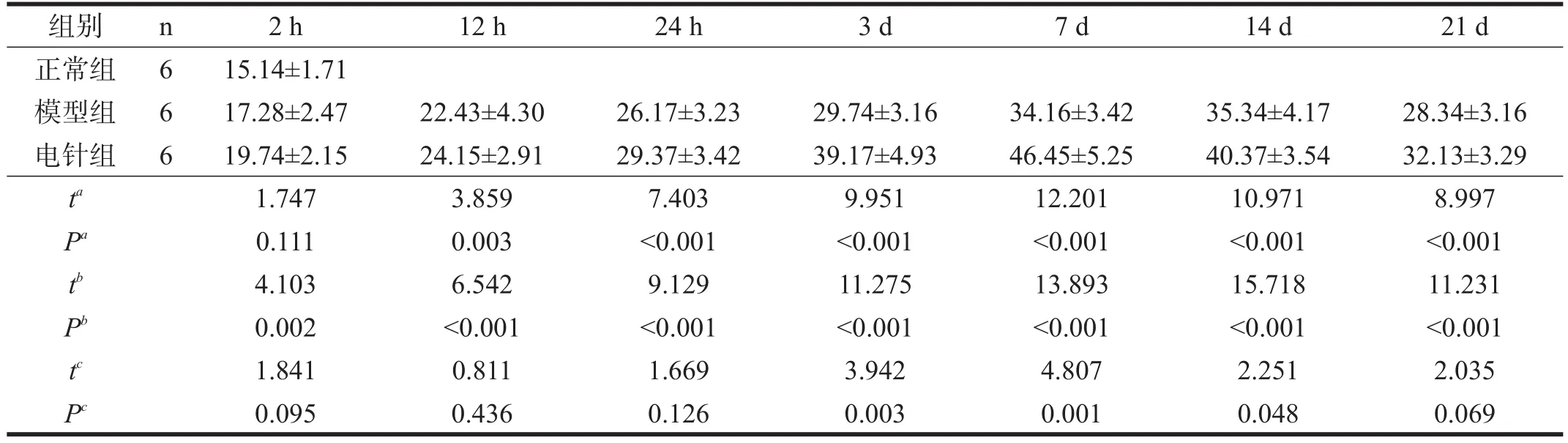
表3 各组CD34阳性细胞(血管内皮细胞)计数比较

图1 模型组7 d CD34阳性细胞表达(免疫组化染色,400×)
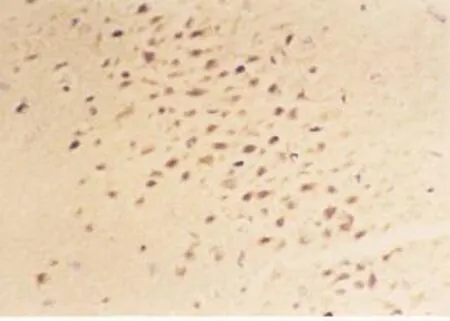
图2 电针组7 d CD34阳性细胞表达(免疫组化染色,400×)
3 讨论
3.1 血管发生与血管新生
血管发生指原始血管网的形成,通过血管母细胞分化成内皮细胞形成迷宫样的血管网络。本课题组前期研究发现,电针合谷穴能增加局灶性脑缺血再灌注大鼠外周血和骨髓内皮祖细胞数量[7]。蔡绍皙等发现,电针足三里穴和曲池穴能增加局灶性脑缺血再灌注大鼠外周血内皮祖细胞数量[8]。这是电针激活局灶性脑缺血再灌注后血管发生的过程的可能机制之一。而血管新生是指新生的毛细血管从已存在的血管侧支的出芽与再塑。包括三个连续的环节:①血管舒张,内皮通透性增加,基底膜溶解;②内皮细胞增生、迁移;③管腔形成,再塑,内皮细胞分化成熟。因此,血管发生和血管新生是动态和连续的过程。本研究在前期研究的基础上,观察电针对新生血管内皮细胞的影响。
3.2 血管内皮细胞标记
脑缺血后内源性血管生成机制被激活,怎样衡量血管新生情况、计数血管内皮细胞,国内外尚没有一个统一的金标准。作为血管内皮细胞的表达标志有CD34、CD31和因子Ⅷ相关抗原等。目前将同时具有CD34、AC133、VEGFR2三种表面标志的细胞作为早期功能性的内皮祖细胞。CD34+/AC133+/VEGFR2+细胞经过血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)等诱导分化后,CD34和AC133表达逐渐减弱,并开始表达内皮细胞表面特有的分子标志如CD31和因子Ⅷ相关抗原等,而VEGFR2继续表达,最终转化为成熟的血管内皮细胞。因此可以看出,CD34主要在内皮细胞分化较早期表达,而成熟血管内皮细胞表达较弱。CD34作为新生血管内皮细胞的表达标志,阳性细胞作为血管内皮细胞的计数可能较CD31和因子Ⅷ相关抗原更准确反映新生血管内皮细胞的情况。既往实验有电针对CD31[9]和因子Ⅷ相关抗原[10]表达影响的报道,而没有电针对CD34表达影响的报道。毛细血管密度能更加直接反映机体血管生成的程度。我们计数有形态的毛细血管(直径<10µm),更能反映有功能的新生血管状态。
3.3 电针与内源性血管新生
Du等研究发现,电针对MCAO大鼠促进血管内皮细胞增生(采用ki67和vWF双标记),增加缺血周围脑血流量(采用激光多普勒流量计探测),并改善神经功能评分[11]。毛庆菊等采用透射电子显微镜观察发现,电针对MCAO/R大鼠大脑皮层微血管超微结构形态学损伤具有明显的保护作用,可促进VEGF表达并调控血管新生[12]。万赛英等发现,电针对脑缺血再灌注损伤的保护作用可能与促进脑缺血区的血管新生有关[13]。
本实验观察到毛细血管密度在MCAO/R后增加,于再灌注后14 d达到高峰。这说明脑缺血后立即启动机体自身的血管生成机制。电针组毛细血管密度在MCAO/R后增加,高峰提前到再灌注后7 d,持续时间更长,比模型组的表达增加更加显著。CD34阳性细胞计数在MCAO/R后持续增加,速度由快变慢。表达高峰在再灌注14 d,较正常组显著增加。电针组CD34阳性细胞计数在MCAO/R后持续增加,且较模型组增加幅度更加明显,高峰提前在再灌注后7 d。以上结果表明,电针能激活大鼠脑组织内内源性血管新生机制。本课题组前期研究提示其机制可能与以下有关:上调血管生长因子VEGF、Ang-1和下调血管抑制因子Endostatin表达[3];上调胎盘生长因子及其受体Flt-1的表达[14];上调基质细胞衍生因子-1α表达[15];上调内皮型一氧化氮合酶及基质金属蛋白酶-9表达[16];加强PI3K/AKT信号转导通路的激活[17];上调干细胞因子(SCF)及其受体c-kit、基质金属蛋白酶-9的表达[18]。电针促进内源性血管新生的机理仍有待进一步的研究。
3.4 电针与局灶性脑缺血再灌注
本实验观察到,电针可减少MCAO/R大鼠梗死体积,改善神经症状学评分,促进神经功能恢复。其机理可能与电针促进CD34阳性细胞表达,促进血管内皮细胞增生,增加毛细血管密度,激活内源性血管新生相关。作为具有代表性的传统非药物疗法,针刺具有整体的良性调节作用。本课题组前期研究还提示,电针对MCAO/R大鼠通过上调bFGF促进神经干细胞的增殖、迁移[19]。张运康等研究发现,电针通过增加脑梗死侧海马区VEGF的表达来促进血管新生,进而诱导内源性神经干细胞增殖[20]。黄浏娇等研究发现,电针增加脑缺血再灌注大鼠缺血区大鼠皮层微血管密度,促进神经功能恢复[21]。李占标等研究发现,针刺降低局灶性脑缺血大鼠缺血侧大脑皮层的细胞凋亡,提高皮层蛋白激酶A表达,促进神经修复与再生[22]。Hong等研究发现,电针通过调节维甲酸信号通路改善局灶性脑缺血大鼠神经功能[23]。
综上所述,电针对神经血管单元[24]具有整体的良性调节作用。电针对脑缺血再灌注可发挥多环节、多水平、多层次、多途径的调节作用,有利于全面促进整个脑缺血后的血管新生和神经功能恢复。本研究结果提示,电针促进神经功能康复可能与电针促进神经发生、血管生成两方面都有关。电针促进血管内皮细胞增生,增加毛细血管密度,如何进一步促进神经功能恢复,电针对神经血管单元中各成分的影响及它们的相互作用,这些问题仍有待进一步的研究。
[1]Zhang ZG,Zhang L,Jiang Q,et al.VEGF enhances angiogenesis and promotes blood-brain barrier leakage in the ischemic brain[J].J Clin Invest,2000,106(7):829-838.
[2]Carmeliet P.Mechanisms of angiogenesis and arteriogenesis[J].Nature Medicine,2000,6(3):389-395.
[3]马璟曦,罗勇.电针对大鼠局灶脑缺血再灌注后脑内血管生长因子和血管抑制因子表达的影响[J].中国针灸,2007,27(2): 129-133.
[4]马璟曦,罗勇,蔡敏.电针对大鼠局灶脑缺血再灌注后脑内血管内皮生长因子受体-2 mRNA和脑源性神经营养因子蛋白质表达的影响[J].中国康复理论与实践,2013,19(2):114-118.
[5]罗勇,董为伟.Wistar大鼠插线法局灶脑缺血/再灌注模型的实验研究[J].重庆医科大学学报,2002,27(1):1-4.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[7]孙宏毅,罗勇,卢桃利,等.电针对局灶性脑缺血/再灌注大鼠外周血和骨髓内皮祖细胞的作用[J].针刺研究,2012,37(3): 179-185.
[8]蔡绍皙,于文娟,张莉,等.电针对脑缺血再灌注大鼠外周血内源性内皮祖细胞的作用[J].针刺研究,2009,34(2):114-119.
[9]左朝,陈邦国,丁玲,等.电针对局灶性脑缺血再灌注大鼠脑组织CD31表达的影响[J].陕西中医学院学报,2012,35(1):54-56.
[10]张慧敏,费宇彤,时宇静,等.针刺“百会”“太阳”改善局灶性脑缺血脑微血管内皮细胞功能的动态观察[J].针刺研究,2006, 31(2):67-72.
[11]Du Y,Shi L,Li J,et al.Angiogenesis and improved cerebral blood flow in the ischemic boundary area were detected after electroacupuncture treatment to rats with ischemic stroke[J]. Neurol Res,2011,33(1):101-107.
[12]毛庆菊,陈邦国.电针对局灶性脑缺血再灌注大鼠大脑皮层微血管超微结构及血管内皮生长因子表达的影响[J].针刺研究,2012,37(6):476-481.
[13]万赛英,谭峰,吴海科,等.电针干预高血压脑缺血再灌注大鼠血管新生及细胞损伤的研究[J].中华中医药杂志,2011,26 (2):350-353.
[14]武磊,罗勇,张珊珊.电针对局灶脑缺血再灌注大鼠大脑皮质胎盘生长因子及其受体Flt-1 mRNA和蛋白表达的影响及其促进脑内血管再生的作用[J].中国动脉硬化杂志,2010,18 (8):589-593.
[15]赵旺,罗勇.电针对局灶脑缺血再灌注大鼠大脑皮质基质细胞衍生因子-1α表达的影响及其促进脑内血管再生的作用[J].中华物理医学与康复杂志,2010,32(6):409-413.
[16]卢桃利,罗勇,孙宏毅,等.电针对局灶脑缺血再灌注大鼠大脑皮质eNOS mRNA及蛋白、MMP-9蛋白表达的影响[J].基础医学与临床,2012,32(2):158-163.
[17]张珊珊,罗勇,武磊,等.PI3K/AKT通路在电针促进局灶脑缺血再灌注大鼠脑内血管再生中的作用[J].第三军医大学学报,2010,32(23):2488-2491.
[18]Lu T,Luo Y,Sun H,et al.Electroacupuncture improves behavioural recovery and increases SCF/c-kit expression in a rat model of focal cerebral ischemia/reperfusion[J].Neurol Sci, 2013,34(4):487-495.
[19]赵振强,罗勇.电针对大鼠局灶脑缺血/再灌注后神经上皮干细胞蛋白表达的影响[J].中国中西医结合杂志,2006,26 (S1):20-24.
[20]张运康,陶连方.电针对脑缺血再灌注大鼠学习记忆能力及血管内皮生长因子表达的影响[J].华中科技大学学报(医学版),2013,42(1):70-73.
[21]黄浏娇,陈邦国,洪亚群.电针对脑缺血再灌注大鼠神经功能及脑组织微血管密度影响的研究[J].湖北中医药大学学报, 2013,15(1):9-11.
[22]李占标,刘方铭,刘维菊.针刺疗法对局灶性脑缺血大鼠神经功能、大脑皮层蛋白激酶A表达及细胞凋亡率的影响[J].针刺研究,2013,38(2):106-111.
[23]Hong J,Wu G,Zou Y,et al.Electroacupuncture promotes neurological functional recovery via the retinoic acid signaling pathway in rats following cerebral ischemia-reperfusion injury[J].Int J Mol Med,2013,31(1):225-231.
[24]Lo EH,Dalkara T,Moskowitz MA.Mechanisms,challenges and opportunities in stroke[J].Nat Rev Neurosci,2003,4(5): 399-415.
Effect of Electroacupuncture at Hegu(LI04)on Capillary Density and Expression of CD34after Focal Cerebral Ischemia/Reperfusion in Rats
MA Jing-xi,LUO Yong.Chongqing Zhongshan Hospital,Chongqing 400013,China
ObjectiveTo observe the effect of electroacupuncture at Hegu(LI04)on capillary density and expression of CD34after focal cerebral ischemia/reperfusion in rats.Methods90 rats were randomly divided into normal group(n=6),model group(n=42)and electroacupuncture group(n=42).A rat model of focal cerebral ischemia/reperfusion was made by filament occlusion in the model group and the electroacupuncture group.And the electroacupuncture group received electroacupuncture.They were observed 2 h,12 h,24 h,3 d,7 d,14 d,21 d after reperfusion 1 h followed ischemia.HE staining was used to observe and calculate the infarct volume and capillary density,and immunohistology was used to detect the expression of CD34after neurologic symptoms rating.ResultsCompared with the model group,the neurologic symptoms score significantly decreased 2 h after reperfusion in the electroacupuncture group(P<0.01),and still decreased 21 d after reperfusion(P<0.05).The infarct volume significantly was smaller in the electroacupuncture group than in the model group(P<0.01).The capillary density was higher 2 h,24 h,3 d,7 d,14 d after reperfusion in the electroacupuncture group than in the model group(P<0.05).Compared with the model group,the expression of CD34significantly increased 3 d after reperfusion in the electroacupuncture group(P<0.01), and it reached a peak at 7 d after reperfusion(P<0.01),and still higher at 14 d.ConclusionElectroacupuncture can promote the expression of CD34and the capillary density,and stimulate the angiogenesis after focal ischemia/reperfusion.
ischemia/reperfusion;electroacupuncture;capillary density;CD34;rats
R743.3
A
1006-9771(2014)03-0201-05
2013-05-06)
1.教育部“高等学校博士学科点专项科研基金”项目(No.20095503110001);2.重庆市卫生局中医药科研项目(No.2005-B-24;No. ZY20131027)。
1.重庆市中山医院,重庆市400013;2.重庆医科大学附属第一医院神经内科,重庆市神经病学重点实验室,重庆市400016。作者简介:马璟曦(1980-),男,回族,湖南隆回县人,硕士,主治医师,主要研究方向:脑血管病。通讯作者:罗勇,男,博士生导师。
10.3969/j.issn.1006-9771.2014.03.001

