犬防御素-3基因的真核表达及活性检测
陈征兵,莫永正,张晓明,陈瑞爱,2,罗满林,2*
(1.华南农业大学兽医学院,广东广州510642;2.广东大华农动物保健品股份有限公司,广东云浮527300)
美国Lehrer实验室1980年从兔肺巨噬细胞中分离得到了一种阳离子性极强的小分子抗菌肽,随后科研人员从兔和人中性粒细胞胞浆颗粒中发现了一系列一级结构相似的小分子肽,由于这些小分子肽广谱的抗微生物活性而被命名为“防御素(defensins)”。
防御素是一类富含半胱氨酸的阳离子活性肽,主要存在于中性粒细胞、巨噬细胞或上皮细胞,并根据其空间结构特性可以分为α、β和θ防御素[1];哺乳动物防御素通过与病原体生物膜直接的相互作用不但可以杀灭病原菌[2],而且具有一定的免疫调节作用[3-4],这些内源性短肽是广泛存在于机体内的天然抗生素,代表着抵御病原体感染的一种天然防御机制[5-6]。与植物或昆虫防御素相比,哺乳动物防御素拥有更为广泛的抗菌谱[7];已经有关于从组织中分离的犬β防御素的报道。犬防御素属于β防御素家族,抗菌范围广,其对革兰阳性菌(如金黄色葡萄球菌)、革兰阴性菌(如大肠埃希菌)、白色念珠菌和一些支原体(如解脲支原体)均表现出一定的抗菌活性,但也有研究表明,当盐浓度高于140 mmol/L时,其抗菌活性逐渐减弱。本试验采用人工合成犬防御素-3基因,整合至毕赤酵母中进行分泌表达,并通过琼脂空穴扩散法测定其抗菌活性。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠埃希菌DH 5ɑ、金黄色葡萄球菌和毕赤酵母菌株X33 均由华南农业大学传染病教研室保存。
1.1.2 试剂 限制性内切酶EcoRⅠ、KpnⅠ、SacⅠ、TaqDAN 聚合酶,Fermenntas公司产品;DNA Marker、pMD18-T Simple Vector、T4DNA Ligase,宝生物工程(大连)有限公司产品;胰蛋白胨和酵母提取物,OXOID 公司产品;丙烯酰胺、甲叉 双丙烯酰胺、TEMED、过硫酸铵,Sigma公司产品;质粒小提试剂盒,OMEGA 公司产品;其余试剂均为国产。
1.2 方法
1.2.1 基因合成 根据NCBI(基因登录号:NM-001024641.1)发表的犬防御素-3氨基酸序列,参照赵翔[8]毕赤酵母偏好性密码子设计基因,并添加终止密码子TAA,送上海英潍捷基全基因合成。
1.2.2 引物设计 根据改造后的密码子序列设计合成了4条引物,分别用于扩增目的基因和重组表达载体质粒检测,并在上下游引物分别添加EcoRⅠ和KpnⅠ酶切位点及保护碱基,引物序列如表1所示。
1.2.3 目的基因的扩增 以P1、P2为引物,合成的犬防御素-3基因为模板,用TaqDNA 聚合酶扩增目的基因,反应条件为,95 ℃5 min;95 ℃30s,60 ℃30s,72 ℃45s,35 个循环;终延伸10 min;PCR 产物预计大小252bp。
1.2.4 pMD18-T-cbd-3 重组质粒构建 胶回收PCR 产物,连接pMD18-T Simple Vector,转化大肠埃希菌DH5α感受态细胞,Amp+抗性琼脂平板筛选重组子;摇菌,PCR鉴定,抽提质粒,EcoRⅠ、KpnⅠ双酶切鉴定,并将阳性克隆送上海立菲生物公司测序。

表1 引物序列Table 1 Primer sequences
1.2.5 pPiczɑC-cbd-3重组质粒构建 将测序正确的重组质粒pMD18-T-cbd-3 与酵母表达载体PpiczɑC,用EcoRⅠ、KpnⅠ双酶切,胶回收酶切产物,连接回收片段和载体,转化大肠埃希菌DH 5ɑ感受态细胞,Zeocin抗性琼脂平板筛选阳性克隆,用AOXP1、AOXP2引物作PCR鉴定和EcoRⅠ、KpnⅠ双酶切鉴定后,将阳性克隆送往上海立菲生物公司测序。
1.2.6 pPiczɑC-cbd-3转化及鉴定 抽提测序正确的重组质粒pPiczɑC-cbd-3,SacⅠ线性化重组质粒,胶回收线性化质粒,取20μL回收产物和80μL X33感受态细胞混匀,加入预冷电转杯,设置电转参数1 500V,25μF,200Ω,5ms;迅速加入1mL冰预冷1mol/L的山梨醇,28 ℃静置1.5h,然后加入1mL YPD 振荡培养1h;4 000r/min 离心5 min,弃上清,沉淀物涂YPDS(ZeocinTM)抗性琼脂平板,28 ℃静置培养3d~5d,挑取平板菌落,PCR鉴定转化子。
1.2.7 阳性转化子诱导表达 将PCR鉴定为阳性的克隆接种至BMGY 液体培养基中,培养至OD值为2.0~6.0,离心培养物弃上清,沉淀用BMMY 稀释至OD值为1.0后进行诱导,诱导培养72h,每间隔24h加入甲醇至终浓度为10mL/L,并取样测定蛋白浓度。
1.2.8 表达蛋白Tricine-SDS-PAGE 检测 取一定量的诱导表达物,12 000r/min离心5 min,取上清,按比例加入5×SDS 上样缓冲液,沸水浴煮沸5min,12 000 再次离心5 min,上清进行Tricine-SDS-PAGE检测。
1.2.9 表达蛋白活性检测 取适量处于对数生长期的菌液加入一定量45 ℃的LB 固体琼脂培养基(经高压灭菌)中,待培养基凝固后打孔,分别加入蛋白表达产物、空载体表达产物、空酵母培养液、氨苄青霉素阳性对照,先置4 ℃冰箱培养2h,然后置于37 ℃温箱培养过夜,观察抑菌圈大小。
2 结果
2.1 目的基因扩增
以人工合成的基因cbd-3 为模板,用引物P1、P2进行PCR 扩增,20g/L琼脂糖电泳凝胶检测,得到了与预期大小(252bp)一致的目的条带(图1)。
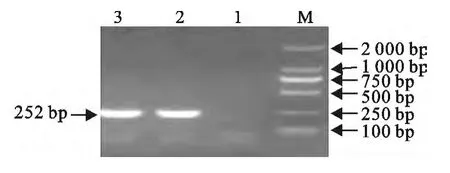
图1 PCR 目的基因的扩增Fig.1 PCR amplifications of target gene
2.2 重组质粒pMD18-T cbd-3的双酶切鉴定
抽提质粒pMD18-T cbd-3,经EcoRⅠ、KpnⅠ双酶切鉴定,得到2条片段,1条大小2 700bp左右,另一条250bp左右,结果与预期相同(图2)。

图2 pMD18-T simple-cbd-3的双酶切鉴定Fig.2 Double enzyme digestion identification of pMD18-T simple-cbd-3
2.3 重组质粒pPiczɑC-cbd-3的双酶切鉴定
抽提质粒pPiczɑC-cbd-3,经EcoRⅠ、KpnⅠ双酶切鉴定,得到2条片段,1条大小3 600bp左右,另1条250bp左右,结果与预期相同(图3)。
2.4 酵母转化子PCR鉴定
酵母重组质粒克隆用酵母基因抽提试剂盒抽提基因,PCR鉴定,在预期位置获得了目的条带(图4)。

图3 pPiczɑC-cbd-3的双酶切鉴定

图4 重组酵母菌的PCR鉴定Fig.4 PCR identification of recombinant yeast
2.5 表达蛋白的检测
将诱导表达产物离心浓缩后,与5×SDS 上样缓冲液混匀,沸水浴变性处理后,Tricine-SDSPAGE检测,在8.5ku处出现目的条带(图5)。

图5 目的蛋白Tricine-SDS-PAGE的检测Fig.5 Tricine-SDS-PAGE detection of the objective protein
2.6 抑菌活性检测
琼脂空穴扩散法检测表达产物的抑菌活性,结果显示表达的犬防御素-3对革兰阴性菌(大肠埃希菌DH5ɑ)和革兰阳性菌(金黄色葡萄球菌)均有一定的抑菌活性(图6)。

图6 犬防御素-3对大肠埃希菌和金黄色葡萄球菌的抑制作用Fig.6 Inhibitory action of the expressed cbd-3to Escherichia coli and Staphylococcus aureus
3 讨论
犬β防御素(-1,-2,-3)虽然都属于犬β防御素家族,但存在部位有一定差异;原位杂交实验证明cbd-1主要存在于曲细精管支持细胞,cbd-2主要在睾丸间质细胞,cbd-3主要在支持细胞,这说明犬β防御素主要表达在犬睾丸组织[9]。当犬遭遇病原体感染时,犬防御素就会在体内高效表达以抑制泌尿生殖道的病原体。鉴于犬防御素的作用机制和抗菌活性,本研究选择巴斯德毕赤酵母表达系统体外表达cbd-3,毕赤酵母表达系统作为一种优秀的表达系统具备了其他表达系统不具备的优点[10],既克服了大肠埃希菌表达杂蛋白多,表达蛋白多以包涵体形式存在外,也避免了昆虫表达细胞操作复杂,投入和产出严重不成比例的缺点。毕赤酵母表达系统不但能高效表达重组蛋白,而且能对表达蛋白加工修饰。因此本试验选择利用甲醇能力强,生长快的X-33酵母表达菌株和分泌型表达载体,能够将表达产物直接分泌到酵母培养基中,这样不但避免了表达产物在菌体内的堆积和对细胞毒害,同时也由于缩短了破碎菌体对蛋白的损伤;但对于载体系列来说,试验设计的重点是要反复确定自己的读码框是否正确;由于本试验中表达目的蛋白分子量相对较小,为避免多余氨基酸序列对蛋白结构的影响,因此在合成基因的时候,在目的基因末端添加了终止密码子序列。由于毕赤酵母没有天然质粒,犬防御素-3通过SacⅠ线性化后以同源重组的方式整合至酵母基因组染色体内,这样不但增加了基因重组几率,而且重组表达框更加稳定。
毕赤酵母表达系统表达过程中伴随着液泡蛋白酶和分泌途径蛋白酶的产生,培养过程中,由于细胞密度不断增加以及部分细胞的裂解,蛋白酶从胞液释放到培养基中,致使目的蛋白被降解。蛋白酶降解目的蛋白是酵母表达系统共有缺陷,培养过程中,外源蛋白和蛋白酶都会不断地释放到培养基中,蛋白分泌和降解就同时发生了,降解发生的结果不仅导致目的蛋白的产率下降,降解产生的氨基酸片段又给目的蛋白的纯化带来了困难,尤其是像本研究中表达的短肽,常规的分离方法很难将目的蛋白和降解产物分离开来,导致产品回收率下降,产品纯度进一步降低,蛋白的比活性降低,因此,做毕赤酵母表达时有必要采取一定措施减少蛋白酶的降解作用和提高外源蛋白的稳定性,主要方法有培养基中添加10g/L酪氨酸水解物,在不影响细胞正常生长的情况下调节培养基pH 等。
本研究中表达产物经Tricine-SDS-PAGE 电泳分析,在8.5ku左右出现目的条带,与预期大小一致,同时琼脂空穴扩散法检测出现了抑菌圈,说明cbd-3在毕赤酵母中成功表达;研究选择大肠埃希菌DH 5α和金黄色葡萄球菌作为抑菌活性的指示菌,结果表明表达产物抑菌效果和一定量氨苄青霉素阳性对照比较效果较差;根据抑菌圈大小判断,表达产物和已报道的天然犬防御素-3 成熟肽也有不小差距,这可能是因为成熟肽在表达中被进行了影响结构与活性的无关修饰[11],因此继续筛选高表达菌株和提高其抗菌活性将是下一步的研究工作重点。
[1]Wang W,Cole A T,Hong A J,et al.Retrocyclin,an antiretroviral theta-defensin,is a lectin[J].Immunology,2003,170(9):4708-4716.
[2]Toke O.Antimicrobial peptides:new candidates in the fight against bacterial infections[J].Biopolymers,2005,80:717-735.
[3]Dhople V,Krukemyer A,Ramamoorthy A.The human-defensin-3,an antibacterial peptide with multiple biological functions[J].Biochim Biophys Acta,2006,1758(9):1499-1512.
[4]Hirsch T,Jacobsen F,Steinau H U,et al.Host defense peptides and the new line of defence against multiresistant infections[J].Protein Pept Lett,2008,15(3):238-243.
[5]Bals R.Epithelial antimicrobial peptides in host defense against infection[J].Respir Res,2000,1:141-150.
[6]Boman H G.Peptide antibiotics and their role in innate immunity[J].Immunology,1995,13:61-92.
[7]余兴邦,郭锁链,乌翠兰,等,防御素研究进展[J].动物医学进展,2006,27(8):47-51.
[8]赵 翔,霍克克,李育阳.毕赤酵母的密码子用法分析[J].生物工程学报,2000,16(3):308-311.
[9]Sang Y M,Ortega M T,Blecha F,et al.Molecular cloning and characterization of threeβ-defensins from canine testes[J].Infect Immun,2005,73(5):2611-2620.
[10]Najakshin A M,Mechetia L V,Alabyev B Y,et al.indentification of an IL-8homolog in lamprey(Lampetra fluviatilis):early evolutionary divergence of chemokines[J].Immunology,1999,29:375-382.
[11]王艾平,王军平,粟永萍.防御素基因工程制备研究进展[J].微生物学通报,2008,35(3):436-442.

