禽肺炎病毒实时荧光定量RT-PCR检测方法的建立
谢志勤,谢芝勋,刘加波,庞耀珊,邓显文,谢丽基,范 晴,罗思思
(广西壮族自治区兽医研究所广西畜禽疫苗新技术重点实验室,广西南宁530001)
禽肺炎病毒(Avian pneumovirus,APV)是禽偏肺炎病毒属的成员,属于禽副黏病毒科[1],该病毒主要危害火鸡。但是近几年发现这种病毒也侵害不同品种的鸡,包括种鸡、商品肉鸡和鸡蛋,引起这些鸡发病,发病鸡的日龄一般在4周龄~7周龄,5周龄~6 周龄时最易发生。发病鸡没有特征性症状,主要引起鸡的呼吸道症状,临床上与禽流感、鸡新城疫、禽传染性支气管炎、支原体感染等的症状相似,以喷嚏,眼结膜潮红,泪腺肿,有时头部出现皮下水肿;产蛋鸡感染该病毒主要引起产蛋下降2%~40%,种蛋孵化率降低;随着病情的发展,会出神经症状;该病引起的发病率为1%~90%,引起鸡死亡率为1%~20%,如继发其他感染,引起的死亡率会更高,对养禽业造成的危害极大[2-4]。
禽肺炎病毒基因组为不分节段的负链RNA,长度约为14kb,禽肺炎病毒编码有8种蛋白,这8种编码蛋白依次为N-P-M-F-M2-SH-G-L[5]。在8 种编码蛋白中,融合蛋白(F)尤为重要,是主要抗原结构蛋白,目前已知的作用是具有抗原性和细胞吸附作用[6]。根据禽肺炎病毒核苷酸和氨基酸序列可以将其分为A、B、C、D 等4个亚型[7]。A 亚型最早报道发生于南非和英格兰;B亚型发生于匈牙利、西班牙和意大利等欧洲国家;现在A 亚型和B 亚型在世界很多国家都流行;C亚型是1997年从美国火鸡中分离的禽肺炎病毒,经鉴定其不同于A 亚型和B 亚型[8],韩国从野鸡中分离到1株C亚型禽肺炎病毒[9];而D 亚型目前仅见报道于法国[5]。
我国哈尔滨兽医研究所的沈瑞忠等[10]于1998年首次分离到该病毒,证明该病毒在我国的鸡群中存在。Owoade A A 等[11]对我国南方部分地区鸡群进行禽肺炎病毒病原学调查,结果发现A 亚型的禽肺炎病毒阳性检出率达39%,B 亚型则为阴性。郭龙宗等[12]对我国部分种鸡开展禽肺炎病毒血清学调查,结果发现在种鸡中禽肺炎病毒感染也普遍存在。陈琳等[13]应用RT-PCR 方法检测出我国有B亚型禽肺炎病毒存在。
实时荧光定量RT-PCR 是一种融PCR 和DNA探针杂交技术为一体的基因体外扩增技术,它通过实时检测PCR 产物荧光信号的变化而达到检测病原核酸的目的,该技术具有操作简便、结果直观、敏感性高、特异性强、重复性好等优点,已成为动物病原检测的重要方法[14-18]。另外,该技术还可以根据建立的标准曲线,直接从检测到的荧光阈值推算样品中相应病原的含量,在临床检测和对疾病进程的评价上具有很高的实用价值。目前,国外检测禽肺炎病毒主要是通过病毒分离鉴定[19]、反转录-聚合酶链反应(RT-PCR)[20]、酶联免疫吸附试验(ELISA)[21-22]、荧光PCR[23]等,但国内还没有应用SYBR Green Ⅰ实时荧光定量RT-PCR 技术检测鉴别禽肺炎病毒的研究报道。本研究采用SYBR GreenⅠ实时荧光定量RT-PCR 技术,建立了检测鉴别C亚型禽肺炎病毒的方法。
1 材料与方法
1.1 材料
1.1.1 毒株 C 亚型禽肺炎病毒APV/MN-10,由美国滨夕法尼亚大学Lu教授惠赠;对照菌(毒)株:鸡新城疫病毒(La Sota)、禽流感病毒H9(A/chicken/Guangxi/LF/2007,H9N2)、鸡传染性支气管炎病毒(Mass 41)、鸡传染性喉气管炎病毒(北京株)、禽脑脊髓炎病毒(AE Van)、鸡毒支原体(MG)均由本实验室保存;禽呼肠病毒(Reo S1133)、禽巴氏杆菌(C48-1)和禽大肠埃希菌(E.coliO2)购自中国兽药监察所;鸡马立克病(MD)疫苗毒,南京梅里亚动物保健品公司提供。
1.1.2 仪器和主要试剂 Lightcycler 2.0荧光定量PCR 仪,罗氏公司(Roche)产品;10 mmol/L dNTPs Mix(产品目录号:D4030RA)、5×RT buffer(含25mmol/L Mg2+,产品目录号:D2620)、反转录随机引物(50μmol/μL,产品目录号:D3802)、AMV反转录酶(5U/μL,产品目录号:D2620)、RNA 酶抑制剂(40U/μL,产品目录号:D2313A)、2×PremixTaqTMmix(产品目录 号:RR003A,含10μmol/L dNTPs,Mg2+,5UTaq酶)、2×One step SYBR Prime Script Plus RT-PCR bufferⅣ(产品目录号:RR096A,内含10 mmol/L dNTPs,Mg2+,SYBR-Green Ⅰ等)、TaKaRa ExTaqHS(产品号:RR096A,5 U/μL)、Preme Script RT Enzyme Mix(产品目录号:RR096A,内含Inhibitor)、2×SYBR Premix ExTaqⅡ(产品号RR820A,内含5 U/μL TaKaRa ExTaqHS,10 mmol/L dNTP Mixture,Mg2+,SYBRGreen Ⅰ等)、PMD-18T,购自宝 生 物生物工程(大连)有限公司;小量质粒提取试剂盒、胶回收纯化试剂盒,购自北京博大泰克生物技术有限责任公司;其他试剂均为进口或国产分析纯试剂。
1.1.3 SPF 鸡胚 SPF 种蛋为北京梅里亚种禽有限公司产品,经本研究室孵化至7d。
1.1.4 临床样品采集 临床样品采自广西南宁市和玉林市不同地方的5个养鸡场,收集有肿头或呼吸道症状的20d~60d肉鸡的肺及气管共54份,保存于-70 ℃。
1.2 方法
1.2.1 引物设计与合成 根据基因库中已发表的禽肺炎病毒F基因(基因库中基因序列号,A 亚型No.DM25622,B 亚 型№Y14292,B 亚 型 №Y14293,C 亚型№AF187154),应用MegAlign 软件进行ClustaV Method分析保守序列,然后根据C亚型禽肺炎病毒F 基因(基因库中基因序列号№AF187154)保守序列进行设计,采用Primer Express 2.0软件,设计一对用于SYBR GreenⅠ特异性扩增的引物,另设计一对用于序列测定的引物。设计的引物序列通过GenBank 进行Blast比对分析,分析的引物由宝生物工程(大连)有限公司合成,引物序列见表1。
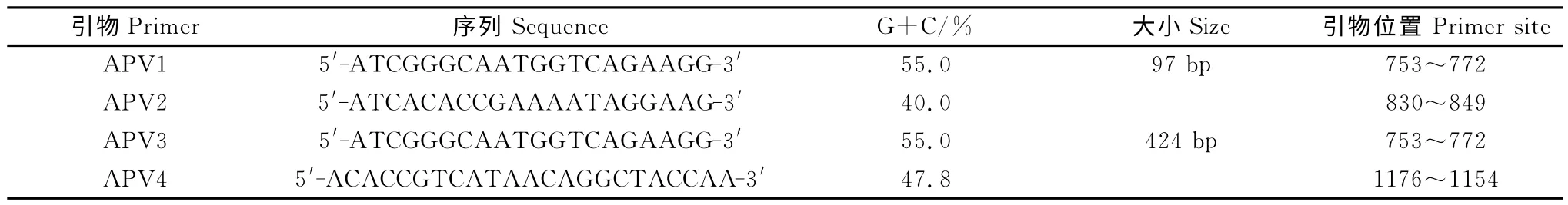
表1 所用引物序列Table 1 The sequences of the primers used in this study
1.2.2 禽肺炎病毒的RT-PCR 扩增
1.2.2.1 禽肺炎病毒的增殖及处理 用灭菌的PBS溶液按1∶100倍稀释APV/MN 毒株,然后经卵黄囊接种7d 的SPF 鸡胚,每胚0.2 mL,收集24h~120h死亡鸡胚的尿囊液和尿囊膜,尿囊膜经研磨后与尿囊液混合,冻融3 次,8 000r/min离心5min,取上清进行RNA提取或保存于-70℃备用。
1.2.2.2 临床样品的处理 用灭菌的PBS溶液按1∶5将肺及气管混合进行研磨,-70 ℃冻融3次,8 000r/min离心5min,取上清进行RNA 提取或保存于-70 ℃备用。
1.2.2.3 RNA 抽提 参照已报道的方法[24],对已处理的样品进行RNA 提取。
1.2.2.4 RT-PCR 扩增 反转录(RT)采用10μL反应体系,5×RT buffer(含10μmol/L dNTPs、Mg2+)2 μL,Random 9 mer(50μmol/L)0.5μL,反转录酶(AMV)0.5μL,RNA inhibitor 0.5μL,模板RNA 2 μL,DEPC水补足10μL,RT 程序为42 ℃60mim,85℃5mim;PCR采用50μL反应体系:在PCR反应管中分别加入2×PremixTaqTM mix 25μL,cDNA 4 μL,50pmol/μL的APV3、APV4引物各0.5μL,灭菌超纯水加至50μL。反应程序为:94℃5min;94℃1min,55℃1min,72℃1min,共进行35个循环;72℃10min,4℃终止反应。
1.2.3 标准阳性模板的制备 APV RT-PCR 扩增产物经15g/L脂糖凝胶电泳,染色后将含有目的片段的凝胶切下,应用凝胶回收试剂盒回收并纯化目的片段,回收的片段与PMD18-T 载体进行连接,再转染到大肠埃希菌中。提取转染后大肠埃希菌中的质粒DNA,经PCR 和双酶切鉴定APV 阳性质粒DNA,阳性菌送深圳华大基因科技服务有限公司进行序列测定和供制作标准曲线用。阳性质粒DNA OD 260nm/OD 280nm 值的测定,根据OD 260nm值计算质粒浓度,按公式换算成拷贝数,拷贝数=(浓度×阿伏加德罗常数)/(一个碱基对的平均分子量×总长度)。
1.2.4 标准曲线的确定和熔解曲线分析 SYBR Green Ⅰ实时荧光定量PCR 标准曲线的确定,对质粒PMD-APV DNA 进行定量,然后按10倍进行稀释至100~107拷贝数/μL,将稀释的拷贝数作为模板进行SYBR Green Ⅰ实时荧光定量PCR 扩增,实时荧光定量PCR 扩增采用2×SYBR Premix ExTaqⅡ试剂盒进行扩增,建立标准曲线;对扩增的标准曲线进行熔解曲线分析,分析扩增的曲线是否为单一的峰。
1.2.5 SYBR Green Ⅰ实时荧光定量RT-PCR 扩增条件的优化 对SYBR Green Ⅰ实时荧光定量RT-PCR 扩增的各条件进行优化,扩增反应体系为20μL,2×One step SYBR PrimeScript Plus RTPCR bufferⅣ10μL,TaKaRa ExTaqHS 0.5μL,Preme Script RT Enzyme Mix 1μL,RNA 模板2 μL,分别加入不同浓度的APV 上游引物和下游引物,RNase Free dH2O 补足20μL;通过优化不同的退火温度建立优化的反应程序,筛选出能够检测APV 且Ct值和扩增效率影响不大的引物浓度以及反应程序,建立SYBR Green Ⅰ实时荧光定量RTPCR 扩增方法。
1.2.6 特异性试验 用建立的SYBR Green Ⅰ实时荧光定量RT-PCR 条件,对APV/MN RNA 以及对照的ND La Sota、AIVH9、IBV Mass41、AEVan、ReoS1133 的RNA 以及MDV、ILTV、PM C48-1、MG、E.coliO2血清型的DNA 进行扩增,检验本方法的特异性。
1.2.7 敏感性试验 测定APV 阳性质粒浓度,然后进行10倍系列稀释至100拷贝数/μL~107拷贝数/μL,各稀释度取1μL作为模板,用建立的SYBR Green Ⅰ实时荧光定量RT-PCR程序测定本技术的敏感性。
1.2.8 重复性试验 选取2个不同浓度的阳性质粒DNA 作为模板,每个模板浓度做2个重复,然后用建立的SYBR Green Ⅰ实时荧光定量PCR 程序进行扩增,计算两个重复Ct值的变异系数,验证荧光定量PCR 的批内重复性;另选取1个浓度的阳性质粒DNA 作为模板,进行荧光定量PCR 扩增,间隔7d重复一次,共进行3次重复,然后计算Ct值的变异系数,验证荧光定量PCR 的批间重复性。
1.2.9 临床样品的检测 对保存的54份广西南宁市和玉林市不同地方5个养鸡场收集的头肿或有呼吸道症状的病鸡肺和气管样品RNA 进行检测,如有阳性样品出现,则按1.2.3方法制备阳性菌送深圳华大基因科技服务有限公司进行序列测定。
2 结果
2.1 RT-PCR 扩增
用设计的实时荧光PCR引物进行APV RT-PCR扩增,结果能扩增出大小为97bp的片段(图1)。
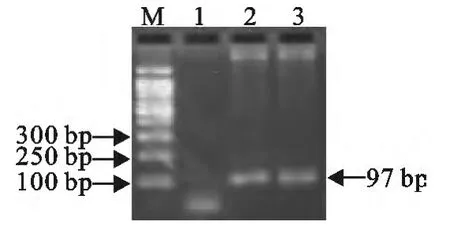
图1 禽肺炎病毒RT-PCR 扩增产物的电泳结果Fig.1 Electrophoresis of RT-PCR amplification products of avian pneumovirus
2.2 标准曲线的确定和熔解曲线分析
通过对荧光定量PCR 扩增标准曲线条件的优化,获得最佳扩增反应条件为:反应体系为20μL,2×SYBR Premix ExTaqⅡ10μL,质粒PMD-APV DNA 1μL,10pmol/μL APV1和APV2引物各0.4 μL,RNase Free dH2O 补足20μL,然后进行标准曲线的扩增,扩增的程序为:95 ℃15s;95 ℃20s、60 ℃20s,共40个循环;然后95 ℃0s,20℃/s,65℃20s,20℃/s,95 ℃0s,0.1℃/s进行熔解曲线分析。最后进入40 ℃10s 结束,标准样品表现为单一的峰,产物的Tm 值均一。通过熔解曲线分析,其扩增只出现单一的峰(图2和图3)。
2.3 SYBR GreenⅠ实时荧光定量RT-PCR的优化
通过SYBR GreenⅠ实时荧光定量RT-PCR扩增条件的优化,获得最佳的反应条件为:2×One step SYBR PrimeScript Plus RT-PCR buffer 10μL,TaKaRa ExTaqHS 0.5μL,PremeScript RT Enzyme Mix 1μL,10pmol/L 浓度的APV1和APV2引物各0.4μL,终浓度各为0.2pmol/L,模板2.0μL,灭菌超纯水补足20μL。反转录程序:42℃15min,95 ℃2min;PCR 程序:95 ℃15s,60 ℃20s,40个循环;最后以40 ℃10s结束。样品表现为单一的峰,产物的Tm 值均一。
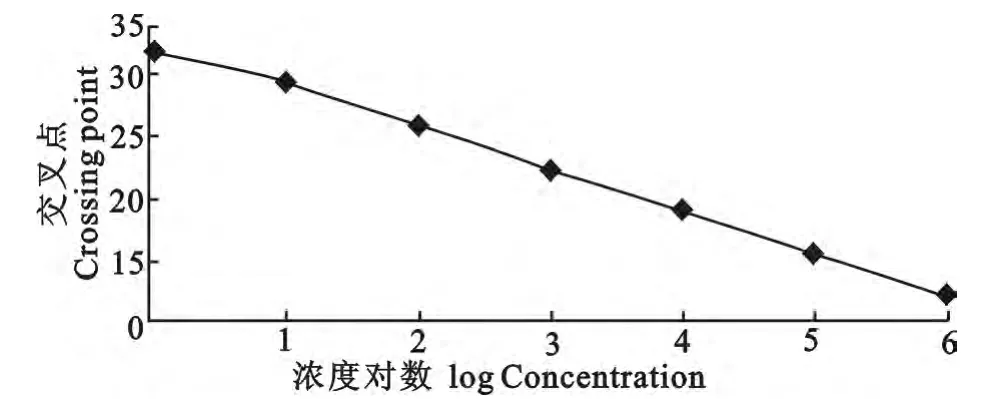
图2 在530nm 吸光度下SYBR Green Ⅰ实时荧光RT-PCR标准曲线图Fig.2 The standard curve of SYBR Green Ⅰreal-time RT-PCR at 530nm
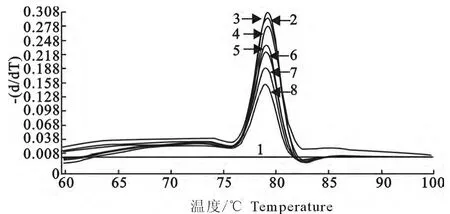
图3 在530nm 吸光度下SYBR Green Ⅰ实时荧光RT-PCR熔解曲线图Fig.3 The melting curves of SYBR Green Ⅰreal-time RT-PCR at 530nm
2.4 特异性试验
用优化的SYBR Green Ⅰ实时荧光定量RTPCR反应条件对参试病原株的核酸进行特异性反应检测,检测结果显示在530nm 吸光度下,只有APV毒株的核酸出现特异的曲线,为阳性,其他对照病原株的核酸均没有曲线出现,为阴性(图4)。
2.5 敏感性试验
用优化的SYBR Green Ⅰ实时荧光定量PCR反应条件对10倍稀释至100拷贝数/μL~107拷贝数/μL 的各稀释度进行敏感性检测,同时也进行PCR检测,检测结果显示,本研究建立的SYBR Green Ⅰ荧光定量PCR反应最低检出限量为10个拷贝的APV,常规PCR 为100个拷贝,结果见图5和图6。
2.6 重复性试验
选取1.0×104拷贝/μL 和1.0×102拷贝/μL 2个浓度的阳性质粒作重复试验,其所得的Ct值分别为15.75、15.88和19.03、19.29,其Ct值变异系数均小于5%;选取1.0×104/μL 的阳性质粒,每间隔7天共3次进行SYBR GreenⅠ实时荧光PCR 测定,其Ct值的变异系数也小于5%。其重复性好,结果见图7。
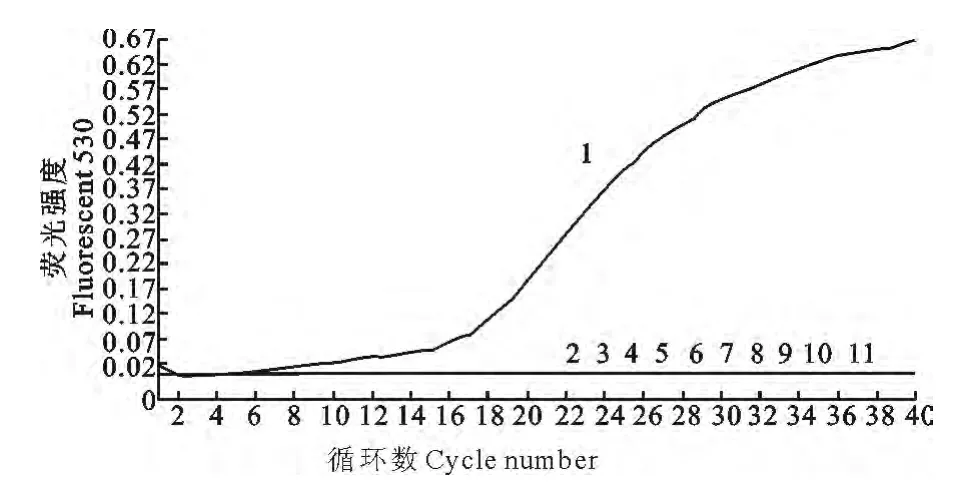
图4 在530nm 吸光度下SYBR Green Ⅰ实时荧光RT-PCR特异性试验结果Fig.4 The specificity test results of SYBR Green Ⅰreal-time RT-PCR at 530nm
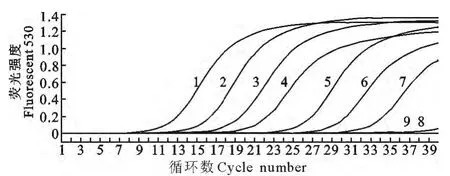
图5 在530nm 吸光度下SYBR Green Ⅰ实时荧光RT-PCR敏感性试验结果Fig.5 The sensitivity test results of SYBR Green Ⅰreal-time RT-PCR at 530nm
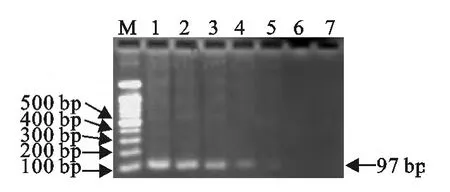
图6 禽肺炎病毒RT-PCR敏感性试验电泳结果Fig.6 Electrophoresis of sensitivity RT-PCR amplification products of avian pneumovirus
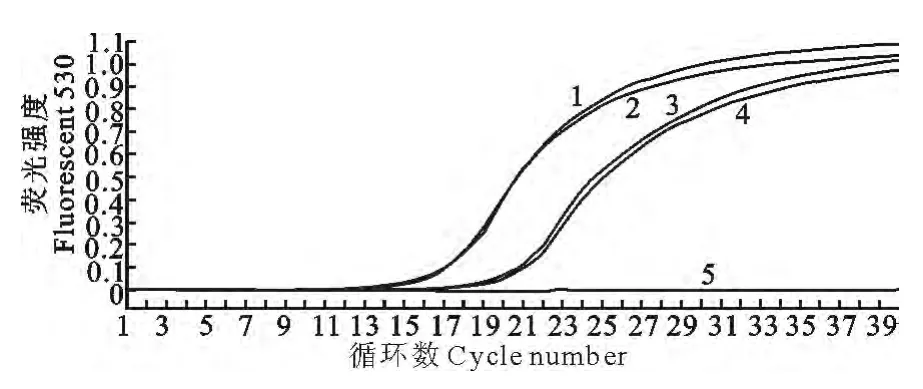
图7 SYBR Green Ⅰ实时荧光RT-PCR重复性试验结果Fig.7 Repeatability test results of SYBR GreenⅠreal-time RT-PCR
2.7 临床样品的检测
对保存的广西不同地方养鸡场收集的头肿或有呼吸道症状的病鸡肺和气管组织样品RNA 进行检测,结果52份样品中没有APV 阳性的样品。
3 讨论
近几年来,在商品肉鸡中出现肿头和上呼吸道症状的现象日渐增多,蛋鸡产蛋下降也时有发生,引起这些症状的病原有多种,其中由禽肺炎病毒引起的症状与鸡新城疫病、禽流感等病原引起的症状很相似,根据临床症状很难作出正确的判断,必须通过实验室方法进行检测区分。目前常规检测禽肺炎病毒的方法耗时较长,工作繁琐,不利于病毒的快速检测,而本试验建立的方法,要比RT-PCR检测方法更节省时间,无需电泳即可以分析出结果,可以满足临床快速、准确地诊断禽肺炎病毒的需要。
实时荧光定量PCR 技术在禽病的诊断中已有很多应用[21-23],它不仅可以对检测的样品做出准确、快速的诊断,还可以对检测样品进行定量分析,而SYBR Green Ⅰ实时荧光RT-PCR检测方法,是利用SYBR Green Ⅰ染料实时对PCR 扩增时产生的DNA 双链进行检测。在建立本方法时,首先要排除引物二聚体的产生而造成的干扰,通过优化引物浓度、反应介质和反应条件来降低引物二聚体的产生。本试验从熔解曲线分析结果可以知道,引物的终浓度为0.2pmol/μL 时,扩增的熔解曲线只有单一的峰出现,表明本试验建立的方法没有二聚体的产生,所扩增出现的曲线均为阳性曲线。
本研究建立的方法经特异性、敏感性和重复性试验,特异性结果只有禽肺炎病毒扩增出现阳性曲线,而其他参试病原株检则没有阳性扩增曲线出现,说明本试验建立的方法特异性好。敏感性试验可以检测到10拷贝的禽肺炎病毒质粒DNA,检测禽肺炎病毒敏感。重复试验的Ct值变异系数均小于5%,说明其重复性较好。因此,本研究建立的方法可以用于禽肺炎病毒的检测,为鉴别诊断由禽肺炎病毒引起的疾病提供了快速、准确有效的方法。
我国于1998年在鸡群中分离到禽肺炎病毒,到2012年证实我国存在有A 亚型和B 亚型禽肺炎病毒,且已证实这两种亚型在鸡群中普遍存在,对我国养鸡业造成了很大的危害。我国是养禽大国,目前我国还没见对C 亚型禽肺炎病毒开展调查的报道。应用本试验建立的方法,对保存的来自广西不同地方的临床样品进行检测,结果没有检测到C 亚型禽肺炎病毒阳性样品。这一结果说明检测的鸡群中没有C亚型禽肺炎病毒存在。由于本试验采集的临床样品数量、品种有限,如要获得更准确的检测结果,需要进行更大范围样品的检测调查。
[1]Pringle C R.Virus taxonomy.A bulletin from the Xth international congress of virology in Jerusalem[J].Arch Virol,1996,141:2251-2256.
[2]Jing L,Cook J K A,Brown T D K,et al.Detection of turkey rhinotracheitis virus in turkeys using the polymerase chain reaction[J].Avian Pathol,1993,22(4):771-783.
[3]Shin H J,Njenga M K,McComb B,et al.Avian pneumovirus(APV)RNA from wild and sentinel birds in the United States has genetic homology with RNA from APV isolates from domestic turkeys[J].J Clin Micobiol,2000,11:4282-4284.
[4]Shin H J,Cameron K T,Jacobs J A,et al.Molecular epidemiology of subgroup C avian pneumoviruses isolated in the United States and comparison with subgroup A and B viruses[J].J Clin Micobiol,2002,5:1687-1693.
[5]Bayon Auboyer M H,Arnauld C,Toquin D,et al.Nucleotide sequences of the F,L and G protein genes of two non-A/non-B avian pneumoviruses(APV)reveal a novel APV subgroup[J].J Gen Virol,2000,81:2723-2733.
[6]Naylor C J,Brown P A,Edworthy N,et al.Development of a reverse-genetics system for avian pneumovirus demonstrates that the small hydrophobic(SH)and attachment(G)genes are not essential for virus viablity[J].J Gen Virol,2004,85:3219-3227.
[7]Luo L Z,Sabara M I,Li Y.Expression of recombinant small hydrophobic protein for serospecific detection of avian pneumovirus subgroup[J].Clin Diag Lab Immu Jan,2005,1:187-191.
[8]Seal B S.Matrix protein gene nucleotide and predicted aminoacid sequence demonstrate that the first US avian pneumovirus isolate is distinct from European strains[J].Virus Res,1998,58:45-52.
[9]Lee E,Song M S,Shin J Y,et al.Genetic characterization of avian metapneumovirus subtype C isolated from pheasants in a live bird market[J].Virus Res,2007,128:18-25.
[10]沈瑞忠,曲立新,于康震,等.禽肺病毒的分离鉴定[J].中国预防兽医学报,1999,21(1):76-77.
[11]Owoade A A,Ducatez M F,Hubschen J M,et al.Avian metapneumovirus subtype A in China and subtypes A and B in Nigeria[J].Avian Dis,2008,52:502-506.
[12]郭龙宗,曲立新.种鸡禽肺病毒感染的血清学调查[J].中国畜牧兽医,2009,36(4):149-150.
[13]陈 琳,刁有祥,邹金峰.禽偏肺病毒RT-PCR检测方法的建立及应用[J].中国兽医学报,2012,37(7):971-974,996.
[14]罗思思,谢芝勋,刘加波,等.H7N9亚型AIV 双重实时荧光定量RT-PCR检测方法的建立[J].动物医学进展,2013,34(12):1-5.
[15]郭 捷,谢芝勋,罗思思,等.H1亚型禽流感病毒实时荧光定量PCR检测方法的建立[J].动物医学进展,2013,34(7):29-34.
[16]谢芝勋,谢丽基,刘加波,等.禽流感和新城疫病毒二重荧光定量RT-PCR检测方法的建立[J].生物技术通讯,2008,19(3):410-413.
[17]谢志勤,谢芝勋,刘加波,等.结核分支杆菌和牛分支杆菌二重实时PCR检测[J].中国兽医科学,2010,40(8):827-834.
[18]罗思思,谢芝勋,邓显文,等.鸡毒支原体弱毒F株与强毒株二重荧光定量PCR鉴别检测方法的建立[J].中国家禽,2012(18):20-24.
[19]Goyal S M,Chiang S J,Dar A M,et al.Isolation of avian pneumovirus from an outbreak of respiratory illness in Minnesota turkeys[J].J Vet Diagn Invest,2000,12(2):166-168.
[20]Shin H J,Rajashekara G,Jirjis F F,et al.Specific detection of avian pneumovirus(APV)U.S.isolates by RT-PCR[J].Arch Virol,2000,145:1239-1246.
[21]Gulati B R,Cameron K T,Seal B S,et al.Development of a highly sensitive and specific enzyme-linked immunosorbent assay based on recombinant matrix protein for detection of avian pneumovirus antibodies[J].J Clin Microbiol,2000,38(11):4010-4014.
[22]Gulati B R,Munir S,Patnaya k,et al.Detection of antibodies to U.S.isolates of avian pneumovirus by a recombinant nucleocapsid protein-based sandwich enzyme-linked immunosorbent assay[J].J Clin Microbiol,2001,39(8):2967-2970.
[23]Kwon J S,Lee H J,Jeong S H.Isolation and characterization of avian metapneumovirus from chickens in Korea[J].J Vet Sci,2010,11(1):59-66.
[24]Xie Z Q,Khan M I,Girshic k,et al.Reverse transcriptase polymerase chain reaction to detect avian encephalomyelitis virus[J].Avian Dis,2005,49(2):227-230.

