空肠弯曲菌和沙门菌双重实时荧光定量PCR检测方法的建立
高瑞娟,张 凯,吕嘉敏,黄永兴,罗开健
(华南农业大学兽医学院,广东广州510642)
空肠弯曲菌和沙门菌是引起细菌性食物中毒的常见致病菌,常污染肉、乳和禽等动物性食品。污染的食品引起腹泻、呕吐等急性肠胃炎症状,严重的可引起死亡[1]。据我国和世界各国的统计资料证明,沙门菌引发的食物中毒在细菌性食物中毒中占据首位[2-3],现已成为食品公共卫生方面的重要问题。据报道,流行病学调查表明,空肠弯曲菌作为肠炎的病因仅次于沙门菌和志贺菌,在很多地区甚至有超过沙门菌而居首位的趋势,因而有研究报道称空肠弯曲菌是“下一个沙门菌”[4]。此外,空肠弯曲菌的感染与人的格林-巴利综合征等具有自身免疫特性的疾病有关[5-6]。世界卫生组织(WHO)已将该病列为最常见的食源性传染病之一。
空肠弯曲菌和沙门菌感染的初期症状非常类似,这对区分两种疾病造成了一定的困难。对空肠弯曲菌和沙门菌的检测,传统的鉴定方法包括增菌、生理生化鉴定、血清学鉴定等,但是所需检验时间长,而且病原菌在食品样品中存在的数量相对较少,使用常规选择性平板上挑取可疑菌落的方法也可能会造成阳性菌株的漏检。空肠弯曲菌属于微需氧菌,对培养基及培养气体环境要求都比较严格,而且细菌的分离培养费时费力,当感染或污染的量较少时,从样品中分离出空肠弯曲菌就更加困难[7-9]。据报道,空肠弯曲菌的致病剂量很小,400个~500个菌体就可引发肠道感染[10]。因此,建立高灵敏度和高特异度的检测方法是提高空肠弯曲菌检测水平的重要措施。并且在一些特定条件下,空肠弯曲菌还存在着一种“存在但不可培养”的状态[11-12],这更是传统分离培养检测方法无法克服的难题。因此,在检验检疫工作中急需一种灵敏的快速检测方法。一些检测方法如PCR、ELISA 都有较高的假阳性结果出现,所以,PCR 和ELISA 得出的结果都不能作为最终的检测依据。随着分子生物学技术快速发展,荧光定量PCR 技术广泛应用于病原微生物检测[13]。本研究采用荧光定量PCR 技术,建立了同时检测空肠弯曲菌和沙门菌的双重实时荧光定量PCR 方法。
1 材料与方法
1.1 材料
1.1.1 菌种空肠弯曲菌(ATCC33291、NCTC11168)、金黄色葡萄球ATCC25923、大肠埃希菌ATCC25922,美国菌种保藏中心提供;鹅源结肠弯曲 菌 SCCC005、沙门菌(SCSE034、SCSE011、SCSE079)、志贺菌、单核细胞增生性李斯特菌、普通变形杆菌、奇异变形杆菌,均为本实验室分离并保存。
1.1.2 主要试剂和仪器 哥伦比亚血琼脂培养基,布氏肉汤,LB营养琼脂培养基,LB 营养肉汤,青岛海博有限责任公司产品;新鲜脱纤维绵羊血,广州蕊特生物技术公司产品;Real Master Mix试剂盒,北京天根公司产品;荧光定量PCR 八连管平盖,美国AXYGEN 公司产品;ABI7500荧光定量PCR 仪,美国应用生物系统公司产品。
1.2 方法
1.2.1 细菌DNA 模板的制备 将1.1.1中所列12种菌株活化后接种于增菌液中,37 ℃(空肠弯曲菌42 ℃微需氧条件下培养)培养24h,无菌操作吸取1mL 培养液,参考黄金林等[14]报道的方法利用水煮法提取细菌基因组DNA,置-20 ℃保存备用。
1.2.2 引物和探针的设计与合成 根据NCBI公布的空肠弯曲菌的保守基因hipO 和沙门菌的保守基因invA 序列,利用Primer Premier 5.0和DNA Star软件设计引物和TaqMan探针,分别使用FAM、JOE作为探针报告基团,TAMRA 作为探针淬灭基团。引物和探针序列见表1,由上海英潍捷基生物技术有限公司合成。

表1 引物和探针序列Table 1 Sequences of primes and probes
1.2.3 双重实时荧光定量PCR 体系的建立 先对每种病原菌做单体系定性反应,在此基础上对双重荧光定量PCR反应的引物、探针浓度和Tm 值进行优化,建立最佳反应体系。
1.2.4 特异性试验 取1.2.1的12种标准菌株及分离菌株细菌的DNA,应用以上建立的双重实时荧光定量PCR反应验证方法的特异性。
1.2.5 灵敏度试验 取沙门菌LB 增菌液按10倍梯度稀释菌液,涂板,37 ℃培养24h后进行平板计数,重复2次,取平均值推算出原液中含的细菌数,计数原始菌液浓度。取空肠弯曲菌布氏肉汤培养液,按上述沙门菌稀释的方法稀释后涂哥伦比亚血平板,42 ℃微需氧条件下培养24h后,进行菌落计数,重复2次。将已经测定浓度的沙门菌、空肠弯曲菌分别进行10倍梯度稀释,取相应细菌浓度区间为100mol/L~106mol/L稀释的DNA 模板,做3个重复的双重实时荧光定量PCR反应。
1.2.6 实际样品检测 采用双重实时荧光定量PCR 方法和国家标准方法同时对随机采集的40份冷冻鸡肉类样品进行检测,并对检测结果进行比较。
2 结果
2.1 双重实时荧光定量PCR反应体系及条件的优化
对引物和探针浓度及反应条件进行优化,最佳扩增条件确定为:95 ℃2 min;95 ℃20s,60 ℃1 min,进行45个循环。最佳反应体系20μL:2.5×Real Master Mix(含内参染料)8μL,上、下游引物:10μmol/L 各为1μL,探针10μmol/L 分别为0.3 μL(空肠弯曲菌)、0.7μL(沙门菌),20×probe enhancer solution 1μL,模板DNA 2μL,加超纯水补足至20μL。
2.2 特异性试验结果
双重实时荧光定量PCR 特异性试验结果见图1。对2份空肠弯曲菌、3份沙门菌均产生明显的扩增曲线,显示阳性结果;同时对其他7种菌株及去离子水空白对照均不能产生扩增曲线,显示阴性结果。
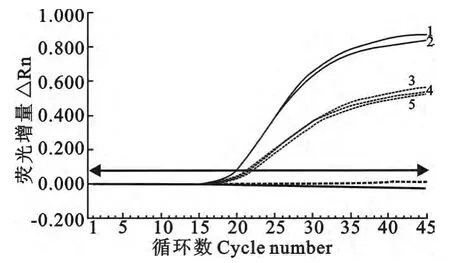
图1 双重实时荧光定量PCR 特异性扩增曲线Fig.1 Specificity amplification curves of the duplex real-time PCR
2.3 灵敏度试验结果
最终测定的空肠弯曲菌、沙门菌原液浓度分别为1.0×107CFU/mL、2.3×106CFU/mL。灵敏度试验结果如图2、图3 所示。双重实时荧光定量PCR 灵敏度试验结果显示,空肠弯曲菌检测限可达10CFU/mL,沙门菌检测限达230CFU/mL。
2.4 实际样品检测结果
采用双重实时荧光定量PCR 方法和国家标准方法对随机采集的40份冷冻鸡肉类样品进行同时检测,结果显示8份阳性,其余32份全部阴性。采用双重实时荧光定量PCR 方法检出3 份样品为空肠弯曲菌阳性,5份样品为沙门菌阳性;采用国家标准方法检出3份样品为空肠弯曲菌阳性,5份样品为沙门菌阳性。两种检测方法检测结果一致,检测结果如表2所示。
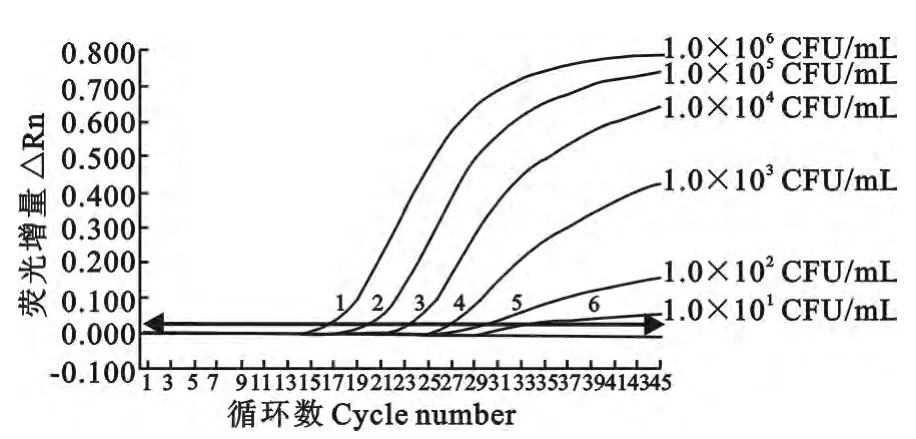
图2 双重实时荧光定量PCR检测空肠弯曲菌灵敏性结果Fig.2 The sensitivity results of the duplex real-time PCR for detecting Campylobacter jejunum
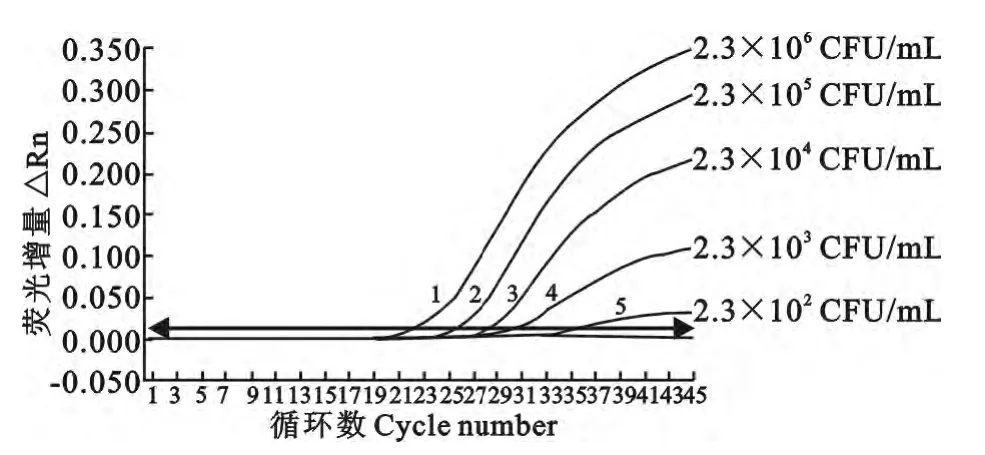
图3 双重实时荧光定量PCR检测沙门菌灵敏性结果Fig.3 The sensitivity results of the duplex real-time PCR for detecting Salmonella
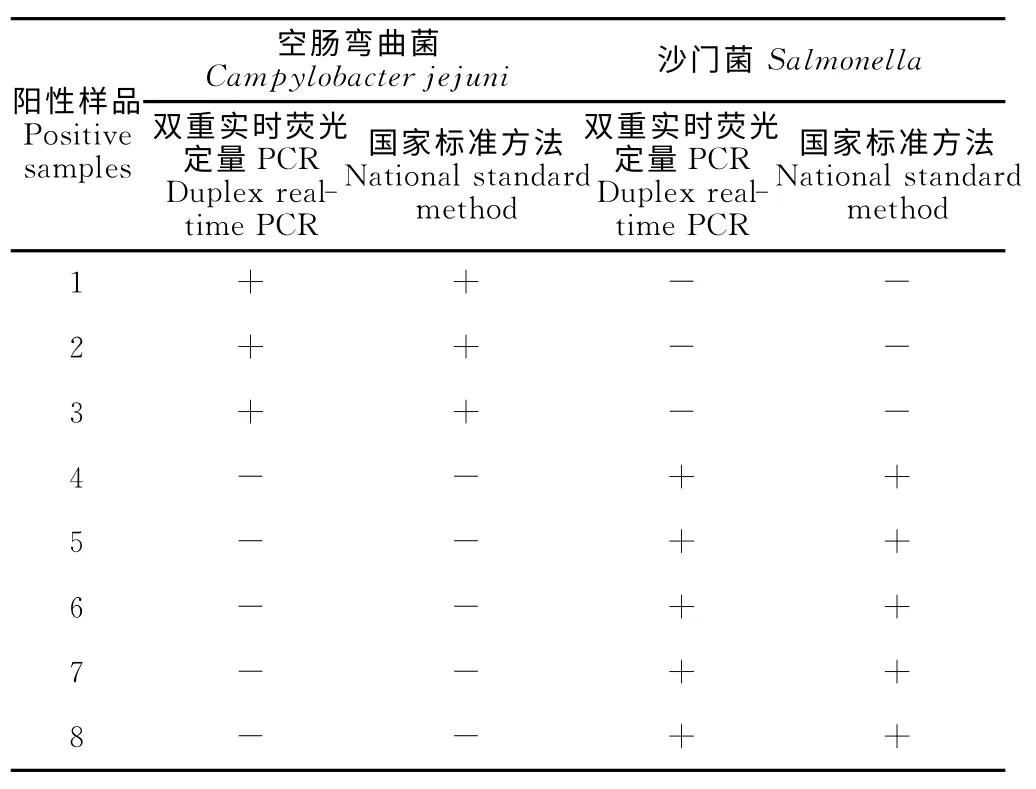
表2 样品检测结果Table 2 Sample test results
3 讨论
随着食品安全要求的不断提高,快速检测食品微生物在食品安全中的重要性愈加明显。空肠弯曲菌和沙门菌是世界范围内食品污染的主要病原菌之一[15]。如何快速检测食品中空肠弯曲菌和沙门菌,缩短检测时间,提高检测灵敏度,减少错检、漏检是食品病原微生物检测的重点。
实时荧光定量PCR 融合了PCR 的灵敏性和光谱技术定量精确的优点,特异性强,灵敏度高,操作简单快速,整个扩增和产物分析过程均在密封单管内完成,不需电泳和紫外或染色观察,并通过微机控制,实现了对PCR 扩增产物进行实时动态检测和自动分析结果。该技术从根本上解决了PCR 扩增产物污染的问题,提高了检测的准确性。虽然采用SYBR 染料法也可达到双重荧光定量的目的,但SYBR Green染料会与非特异性双链DNA 结合,产生假阳性,干扰实验的准确性,特别是分析表达量不高的基因时,这类情况尤其突出。而探针法除了引物序列的特异性之外,还有探针序列的特异性,可从两个方面保证所扩增基因的特异性。故本研究建立了基于TaqMan探针的空肠弯曲菌和沙门菌双重实时荧光定量PCR检测方法。
本研究结果显示该方法特异性强、灵敏度高。实际样品检测中,我们发现本研究建立的检测方法与国家标准方法的检测结果一致。本研究建立的空肠弯曲菌和沙门菌TaqMan探针双重实时荧光定量PCR检测方法,具有操作简单、特异性强和灵敏度高等优点,有较强的实际应用价值和良好的应用前景,值得在进一步研究完善后建立标准化检测流程以利于推广应用。
[1]何国庆,贾英民,丁立孝.食品微生物学[M].北京:中国农业出版社,2002:224-229.
[2]Ogunsanya T,Uzoma K,Odugbemi T,et al.Observation on distribution ofShigellaspecies in Lagos:a report for the period 1985-1988[J].EurJ Epidemiol,1990,6(2):227-228.
[3]Singer S,Cook L,Maddox W,et al.Use of pooled samples for the detection ofSalmonellain feces by polymerase chain reaction[J].J Vet Diagn Invest,2006,18(4):319-325.
[4]Georgios K,Dang D B,Marianne L,et al.Development of a sensitive DNA microarray suitable for rapid detection ofCampylobacterspp[J].Molecul Cell Prob,2003,17:187-196.
[5]McCarthy N,Giesecke J,Weinberg E D,et al.Incidence of Guillain Barre syndrome following infection withCampylobacter jejuni[J].Am J Epidemiol,2001,153(6):610-614.
[6]翟海华,王 娟,王君伟,等.空肠弯曲菌的致病性及致病机制研究进展[J].动物医学进展,2013,34(12):164-169.
[7]Fukushima H,Katsube K,Hata Y,et al.Rapid separation and concentration of food-borne pathogens in food samples prior to quantification by viable-cell counting and real-time PCR[J].Appl Environ Microbiol,2007,73(1):92-100.
[8]Cheng B Y,Yuan J,Ke H H,et al.A real-time PCR assay for the detection and quantitation ofCampylobacter jejuniusing SYBR green and the light cycle[J].Yale J Biol Med,2004,77(5-6):125-132.
[9]Rudi K,Hoidal H K,Katla T,et al.Direct real-time PCR quantification ofCampylobacter jejuniin chicken fecal and cecal samples by integrated cell concentration and DNA purification[J].Appl Environ Microbiol,2004,70(2):790-797.
[10]Mandell C L,Douglas R G,Bennett J E.Principles and practice of infectious diseases[M].4th edition.New York:Churchill Livingstone,1995:2053-2060.
[11]Mckay A M.Viable but non-culturable forms of potentially pathogenic bacteria in water[J].Lett Appl Microbiol,1992,14:129-135.
[12]Medema G J,Schets F M,Van de Giessen A W,et al.Lack of colonization of 1day old chicks by viable,non-culturableCampylobacter jejuni[J].J Appl Bacteriol,1992,75:512-516.
[13]卢亦愚,严菊英,冯 燕,等.TaqMan荧光定量逆转录聚合酶链反应快速检测麻疹病毒核酸[J].中国计划免疫,2005,11(1):1-4.
[14]黄金林,焦新安,文其乙,等.应用聚合酶链反应快速检测沙门菌[J].扬州大学学报:农业与生命科学版,2002,23(3):4-7.
[15]胡 哲,王振国,刘金华,等.利用PCR 技术检测鸡肉产品中的空肠弯曲杆菌[J].吉林农业大学学报,2005,27(6):671-674.

