先天免疫系统中肽聚糖识别蛋白研究进展
徐 鑫,刘忠渊
(新疆大学生命科学与技术学院新疆生物资源基因工程重点实验室,新疆乌鲁木齐830046)
先天免疫系统是脊椎动物与无脊椎动物自我防御,抵抗“非己”物质感染的第一道防线。从昆虫到哺乳动物,先天免疫系统通过一些保守的模式识别受体(pattern recognition receptors,PRRs)结合病原相关模式分子(pathogen associated molecular patterns,PAMPs),识别入侵的外源微生物。病原相关模式分子是外源微生物产生的一类特殊的物质,宿主体内没有该物质,它们代表的是一种分子模式,而不是特定结构,通常位于病原体生存所必需的的保守结构中,逐步进化,成为一类或几类微生物所共有的模式分子[1];先天免疫系统的模式识别蛋白向着识别病原体保守结构域进化,病原模式分子便成了模式识别受体的靶标。目前已知的病原相关模式分子包括脂多糖、脂磷壁酸、肽聚糖、葡聚糖、甘露聚糖、鞭毛蛋白以及非甲基化的CpG 序列[2]。不同结构功能的模式识别受体能够识别并结合不同的病原相关模式分子,目前已鉴定的模式识别受体包括肽聚糖识别蛋白(peptidoglycan recognition protein,PGRP),β-1,3-葡聚糖识别蛋白(β-1,3-glycan recognition protein,βGRP)[3],革兰阴性菌结合蛋白(Gram-negative bacteria binding protein,GNBP),类免疫球蛋白(hemolin),C 型凝集素(C-type lectins),整联蛋白(integrins)[4],TLR2[5],NODs[6]等。
1 肽聚糖是先天免疫识别的理想靶标
能够激活先天免疫反应的刺激物很多,包括革兰阴性菌细胞壁中的脂多糖(lipopolysaccharides,LPS),革兰阳性菌细胞壁中的脂磷壁酸(lipoteichoic acids,)真菌细胞壁中的β-1,3-葡聚糖(β-1,3-glucans),以及普遍存在于革兰阳性菌与革兰阴性菌细胞壁中的肽聚糖(peptidoglycan,PGN)。虽然LPS对于脊椎动物与非脊椎动物的免疫反应是很好的刺激物,却不能激活果蝇(Drosophila melanogaster)的免疫反应,而到目前为止,果蝇仍是研究先天免疫反应机理的最佳模式生物。与LPS不同,PGN 能够刺激果蝇产生多种免疫反应,PGN 因此成为了果蝇识别外源微生物的理想靶标[7]。PGN 是由N-乙酰氨基葡萄糖(N-GlcNAc)与N-乙酰胞壁酸(N-Nur-NAc)经β(1~4)糖苷键聚合成链,通过由L-或D-型氨基酸组成的短肽交叉连接而成。根据组成短肽的第3 位氨基酸的不同,PGN 主要分为赖氨酸型(Lys-type)PGN 与二氨基庚二酸型(Dap-type)PGN两大类。通常情况下,Dap type PGN 的短肽之间是直接交联的,而Lys-type PGN 的短肽间往往需要肽桥进行连接,组成肽桥的氨基酸的种类及长度因细菌种类不同而不同(图1)[8]。
2 肽聚糖识别蛋白的研究现状
2.1 肽聚糖识别蛋白的结构
肽聚糖识别蛋白是一类存在于大多数动物体内(在线虫与植物中没有发现[9])的模式识别蛋白,从昆虫到哺乳动物高度保守,通过识别细菌细胞壁中的肽聚糖(PGN)帮助宿主抵御病原微生物。昆虫的PGRPs主要分为2 种类型,即短型PGRP(PGRPS)与长型PGRP(PGRP-L),PGRP-S的分子质量约18ku~20ku,PGRP-L 的分子质量可以达到90 ku。哺乳动物PGRP最初的命名类似昆虫,分别为PGRP-S,PGRP-L,PGRP-Iα 与PGRP-Iβ(其中S,L,I分别表示短型,长型以及中等长度),之后人类基因组组织基因命名委员会将其分别改为PGLYRP-1,PGLYRP-2,PGLYRP-3,PGLYRP-4。大多数的PGRPs具有1个C端2型酰胺酶区域,称为PGRP域(有 些PGRP 有2 个PGRP 域,如 果 蝇PGRP-LF以及人PRLYGP-3与PGLYRP-4),长约165个氨基酸,在结构上与噬菌体及2 型酰胺酶同源。大多数的长型及中等长度PGRPs(如无脊椎动物PGRP-L与脊椎动物PGLYRP-2)不仅有1个C端PGRP域,还有一段长度可变的N 端序列,不同的PGRP,其N 端序列不同。几乎所有的PGRPs的PGRP域中都有2 个隔开的保守的半胱氨酸,这2个半胱氨酸形成的二硫键是PGRPs发挥活性必需的。大部分脊椎动物的PGLYRPs和少数无脊椎动物的PGRPs有2个额外保守的Cys能够形成第2个二硫键;此外,哺乳动物的PGLYRPs(如PGLYRP-1 以 及PGLYRP-3 与PGLYRP-4 的C 端PGPP域)拥有另外一对保守的Cys会形成第3 个二硫键。
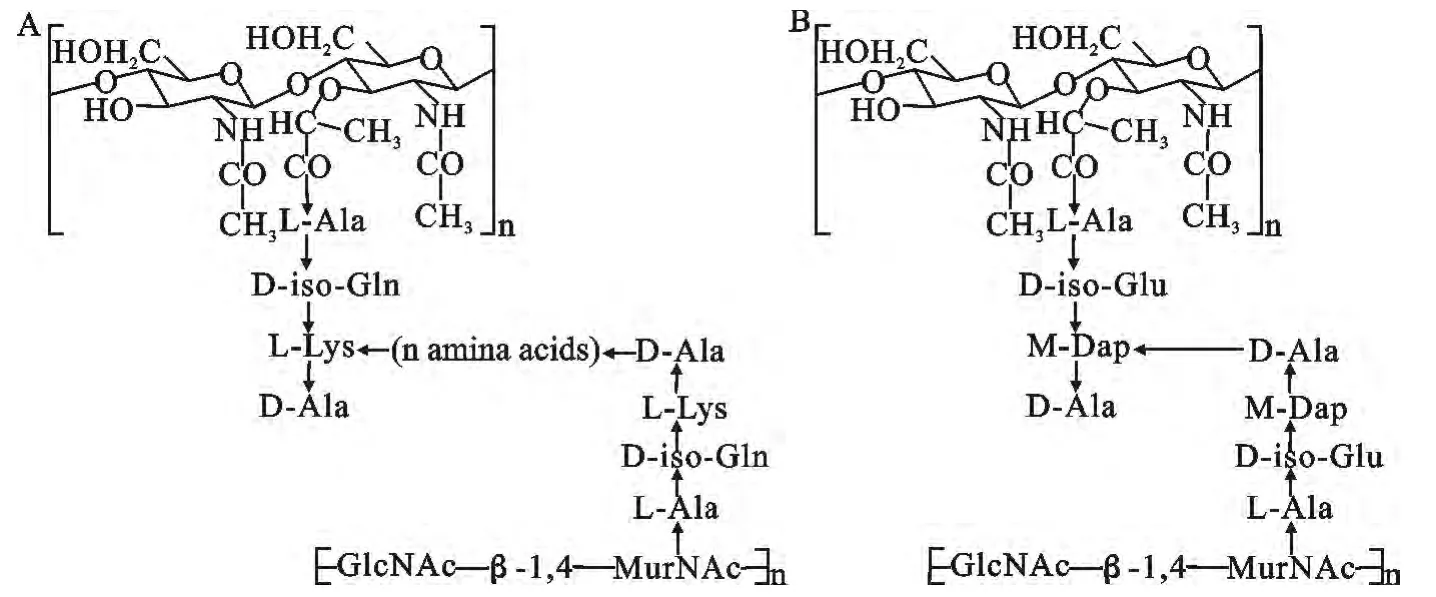
图1 肽聚糖结构Fig.1 The structure of peptidoglycan
晶体结构显示,PGRPs与2型噬菌体酰胺酶有着相似的结构,它们在外围都有3个α螺旋,中间有几个β折叠和转角[10]。每一个PGRP都有1个PGN结合域(如果是长的PGRPs在C 末端),但是哺乳动物的PGLYRP-3与PGLYRP-4以及果蝇的PGRP-LF的结构中有2 个串联的PGN 结合域。PGN 结合域会形成一个保守的L 型一端深一端浅的PGN 结合大沟。所有PGRPs的PGN 结合域都包含一段有30个~50个残基的N 末端,被认为是PGRPs特有的片段,这一段与α螺旋在PGN 结合位点的背面会形成一个宽广的疏水性大沟,大沟很可能是不同的效应分子或信号肽的结合位点[11]。果蝇PGRP-SA能够与GNBP1或PGRP-SD相互作用激活Toll受体信号通路[12],这种相互作用可能是受PGRP-SA的N末端特有片段的调节。
2.2 肽聚糖识别蛋白与肽聚糖的相互作用
不论是接触式的PGRPs 还是非接触式的PGRPs,在结合来自于革兰阳性菌或革兰阴性菌的PGN 时都表现出明显的特异性。大多数革兰阳性菌细胞壁的PGN是Lys-type PGN,而大多数革兰阴性菌和一些革兰阳性菌(如芽胞杆菌属)细胞壁的PGN 是DAP-type PGN,例如果蝇的IMD 信号通路被DAP-type PGN 激活,而Toll信号通路则是由Lys-type PGN 激活[13]。人的PGRP-IαC 表现出对Lys-type PGN严格的识别依赖性,而PGRP-S则优先结合Dap-type PGN。
PGRPs-PGN 晶体结构提供了PGRPs与PGN相互作用结合位点的最直观的信息。PGPR-IαC 与PGN 结合的晶体结构PGRP-IαC-PGN 向我们展示了结合位点处PGPR 与PGN 的相互作用,其晶体结构显示PGRP-IαC的肽段部分深埋在PGN 结合大沟较深的一端,而N-MurNAc则定位于大沟中部,呋喃糖环垂直插向大沟底部。PGRPs 的Asn236和Phe237与L-Lys之间产生范德华力,帮助PGRPs识别Lys-type PGN。试验证明,氨基酸序列中有Asn236 和Phe237(或者是Asp236-Phe237,Asn236-Tyr237)的PGRPs能够识别Lystype PGN,却不能识别Dap-type PGN(如果蝇PGRP-SA);而序列中有Gly236-Trp237的PGRPs则会优先与Dap-type PGN(如果蝇PGRP-LCX,-LCB,-LE与人PGRP-S)结合。若是利用基因突变的方法改变PGRP 中这两个氨基酸(将Asn236-Phe237突变为Gly236-Try237),将会改变PGRP对PGN 的选择性[14]。PGRP-IαC-MPP(MPP为人工合成的胞壁酰五肽:MurNAc-L-Ala-D-isoGln-LLys-D-Ala-D-Ala)的晶体结构显示,Asn236之所以能够与L-Lys结合却不能与DAP 结合,是因为与Lys相比,DAP 的侧链上多了一个羧酸基团,这个羧酸基团能与Asn 的侧链形成空间阻碍,降低了PGRP与DAP之间亲和性。若PGRP 氨基酸序列的236位是一个Gly,与Asn相比少了一个侧链,所以不会影响其与DAP的结合。
果蝇PGRP-LCX,PGRP-LE与TCT结合的晶体结构进一步证明了PGRP对不同PGN 识别的分子基础[15],TCT是PGN的衍生物,在肽段上有一个DAP。在PGRP-LE-TCT的晶体结构中,DAP 侧链的羧酸基团能与PGRP-LE Arg254上的胍基形成一个双配位的盐桥。值得注意的是,在几乎所有包含Gly-Trp 基序的PGRP中都有一个相应的Arg,暗示它有稳定PGRP与Dap-type PGN结合的作用。
2.3 肽聚糖识别蛋白的功能
2.3.1 肽聚糖识别蛋白能够水解PGN 有些PGRPs与T7溶菌酶相似,具有酰胺酶活性,被称作接触式PGRPs,通过切割MurNAc与L-Ala之间的氢键水解PGN。但大部分PGRPs属于非接触式PGRPs,因缺少一个关键位点的Cys,失去了结合Zn2+的能力,所以不能水解PGN[16]。晶体结构显示,在所有接触式的PGRP 的PGN 结合大沟内都有一个Zn2+结合位点。果蝇PGRP-LB结构中[13],PGN 结合大沟内的Zn2+与His42,His152,Cys160 3个残基相互协调发挥作用,这3个氨基酸在所有接触式的PGRPs中严格保守。大多数非接触式的PGRPs虽然有与PGRP-LB相同的His42 和His152,但因为缺少Cys160,所以不能与Zn2+结合,不具有水解PGN 的能力。目前普遍认为PGRPs水解PGN 的机理是Zn2+作为亲电子催化剂,帮助切割MurNAc与L-Ala之间的氢键。
2.3.2 肽聚糖识别蛋白参与了昆虫先天免疫系统中的重要信号通路 果蝇的2个肽聚糖识别蛋白,PGRP-SA 与PGRP-SD 通过识别细菌细胞壁的PGN 能够激活Toll受体,从而起始Toll信号通路。Toll信号通路的激活使得昆虫体内的drosomycin基因与其他一些抗菌肽基因表达,产生的抗菌肽在对抗革兰阳性菌及真菌感染中发挥着重要作用[17]。Toll信号通路主要被来自于革兰阳性菌细胞壁的Lys-type PGN 激活,但对于来自于革兰阴性菌细胞壁的DAP-type PGN 的刺激也有弱的响应。
Immune Deficiency(IMD)信号通路是PGRPs参与的昆虫体内的第2 条信号通路。果蝇体内的IMD信号通路主要调节diptericin和其他一些抗菌肽的表达,diptericin能够帮助宿主抵御革兰阴性菌的感染。IMD信号通路的激活依赖于相互作用的PGRP-LC和PGRP-LE 与来自革兰阴性菌细胞壁的DAP-type PGN 的结合[18]。果蝇体内具有酰胺酶活性的PGRPs通过降解PGN,控制免疫反应的强度,如PGRP-LB、PGRP-SC1与PGRP-SC2对果蝇的IMD 信号通路有负调控作用,这种负调控作用可以调整对革兰阴性菌感染的免疫反应。PGRPLF作为IMD 信号通路的负调控因子[19],若没有PGRP-LF参与,果蝇的正常发育会受到伤害,这一表型受JNK 信号通路调节。
酚氧化酶原反应的信号通路是PRGPs参与的昆虫体内的第3条信号通路,PGRPs与PGN 结合激活酚氧化酶原反应,促使伤口愈合以及黑色素的产生。PGRPs能与PGN 结合激活此信号通路。此外,金龟子(Holotrichia diomphalia)体内的PGRP-1还能够通过识别β-1,3-D-glucan 激活此信号通路,而β-1,3-D-glucan是真菌细胞壁的组分之一。
Toll与IMD 信号途径以及酚氧化酶原反应的激活有赖于PGRPs对胞外细菌的识别,在果蝇体内,PGRP-LE 参与了对胞内细菌的识别。PGRPLE是目前已鉴别出的唯一一种胞内模式识别分子。在细胞培养中,PGRP-LE 通过识别入侵胞内的细菌激活JAK-STAT 信号途径,诱导产生抗菌肽Listericin[20]。
2.3.3 肽聚糖识别蛋白具有杀菌作用 哺乳动物的PGRP只在体内的个别组织或细胞中表达,如中性粒细胞(PGLYRP-1)、皮肤、黏膜、唾液(PGLYRP-3和PGLYRP-4)及肝脏(PGLYRP-2)。最初认为,哺乳动物的PGLYRP 和昆虫的PGRP 一样,具有激活信号通路的作用;然而最近的试验表明,哺乳动物的PGLYRP有直接杀菌(PGLYRP-1,PGLYRP-3,PGLYRP-4)及清道夫(PGLYRP-2)作用,小鼠的PGLYRP-1对单增李斯特菌(L.monocytogenes)及其他革兰阳性菌表现出明显的抗菌活性[21]。有关哺乳动物PGRP 的杀菌机制一直存在争议,有学者认为哺乳动物PGRP是通过水解PGN达到杀菌目的;还有的学者提出PGRP因为与细菌细胞壁相互作用,抑制了PGN 的合成,进而杀死细菌;最新研究认为,对于正在进行分裂的革兰阳性菌(枯草芽胞杆菌,Bacillus subtilis),PGRPs能够从由LytE和LytF 水解酶水解产生的细胞分裂点进入子代细菌的细胞壁内,与细胞膜周围肽聚糖结合,激活细菌中的CssR-CssS双部件系统,从而诱导细胞膜去极化并在胞内产生大量[OH]自由基,最终引起细菌死亡。与革兰阳性菌相似,PGRPs能够结合革兰阴性菌的外膜并激活CpxA-CpxR 双部件系统来发挥杀菌功能[22]。
3 肽聚糖识别蛋白参与先天免疫系统的免疫耐受反应
果蝇的基因组编码六种接触式的PGRP,缺少这6种PGRP的果蝇仍能存活,但是会对无害的肠道感染产生有害的免疫反应[23],这暗示机体免疫系统能够利用PGRPs区分外源菌与肠道共生菌。果蝇肠道免疫反应高度区域化,果蝇中肠沿前后轴分为4个区域:Pv,Ventriculus(Vtr),Copper cell(Cc)与Posterior midgut(Pmg),不同的区域产生的免疫反应受不同的PGRPs调节,如果蝇PGRPLC主要调节Pv区域的免疫反应,而PGRP-LE 主要调节Cc与Pmg区域的免疫反应。PGRP-LE 是果蝇肠道最主要的一种感应器,控制着对外源菌的免疫反应以及对肠道共生菌的免疫耐受。果蝇摄食胡萝卜软腐欧文菌(Erwinia carotovora carotovora,ECC),细菌细胞壁PGN 组分会跨越肠道上皮屏障,到达脂肪体中引起全身过度免疫反应,PGRPLE可以阻止发生此反应[24]。基于对缺失了所有接触式PGRP及IMD 调控因子Pirk的果蝇免疫表型的研究发现,IMD 调控的免疫反应受多种负反馈调节。
哺乳动物的PGRPs不仅能够直接杀菌和水解细菌细胞壁PGN,还参与了机体的炎症反应。肠道共生菌与宿主是互利的,PGRPs能够帮助机体维持健康的肠道菌群,保护宿主免受结肠炎的危害[25]。所有的PGN 都能诱导产生包括IL-12p35,IL-8,TNF-α以及PGLYRP3 在内的炎症因子,PGN 诱导的炎症反应受Toll like receptor 2(TLR2)途径调节。PGN 能够刺激肠道表皮细胞,通过TLR2途径产生炎症反应,PGLYRP3也受PGN 的刺激参与炎症反应中,不过作用刚好相反,它能够减弱炎症反应。分泌到皮肤的PGRPs保护皮肤免受化学物质或过敏原引起的过度炎症反应。有试验证明,PGRPs不仅能够调节局部组织的炎症反应(如关节炎),而且还参与了一些与炎症有关的疾病,如牛皮癣等[26]。
4 结语
过去几年中,有关PGRP的研究取得了很大的进展,使我们进一步认识到PGRPs在宿主防御病原体侵染中发挥的重要作用,初步了解了PGRP的结构,对PGRP的功能有了更深层次的认识。但有关PGRP,仍然有许多问题等着我们解决。比如,目前有一定研究基础的PGRP 都来自于一些模式生物,如果蝇、人、小鼠等,要想对PGRP有更全面、深入的了解,就需要从不同物种中获得更多有关PGRP的信息。由于不均一组分的物质不容易结晶化,所以已经得到的PGRP 与PGN 相互作用的晶体结构中,PGN 大部分都是人工合成的单体,而自然存在于细菌细胞壁的PGN 都是多聚体,所以这些晶体结构并不能真实的反应自然状态下PGRP与PGN 的相互作用。目前有关信号通路的研究都是以果蝇为研究对象,而且只对Toll信号通路有了一定的了解,对于IMD 信号通路还知之甚少。PGRP是通过怎样的分子机制参与这两个信号通路的,需要进一步研究。不论是昆虫还是人,体内都存在着多过细胞数目的细菌,这些细菌与机体免疫系统和平相处,但是一旦有外源病原菌入侵机体就会引起机体强烈的免疫反应,免疫系统是如何精确的识别“自己”与“非己”的,特别是对一些只有先天免疫系统的低等生物来说,PGRP 以怎样的方式参与了这种精确调控中,对此还需要更深入的研究。
[1]许平震,张美蓉,钱 平,等.昆虫先天免疫的肽聚糖识别蛋白的研究进展[J].安徽农业科学,2012,39(23):13962-13964.
[2]Yao F,Li Z,Zhang Y,et al.A novel short peptidoglycan recognition protein in amphioxus:identification,expression and bioactivity[J].Develop & Comp Immunol,2012,38(2):332-341.
[3]Dai H E,Yasuaki H,Daisuke T,et al.An initial event in the insect innate immune response:Structural and biological studies of interaction s betweenβ-1,3-glucan and the N -terminal domain ofβ-1,3-glucan recognition protein[J].Biochemistry,2013,52:161-170.
[4]张明明,初 源,赵章武,等.昆虫天然免疫反应分子机制研究进展[J].昆虫学报,2012,55(10):1221-1229.
[5]Zenhom M,Hyder A,de Vrese M,et al.Peptidoglycan recognition protein 3(PglyRP3)has an anti-inflammatory role in intestinal epithelial cells[J].Immunobiology,2012,217(4):412-419.
[6]Stefan H O,Maria V F,Chris J H,et al.The inflammatory bowel disease(IBD)susceptibility genes NOD1and NOD2 have conserved anti-bacterial roles in zebrafish[J].Dis Mod Mechan,2011,4(6):832-841.
[7]Kurata S.Peptidoglycan recognition proteins inDrosophilaimmunity[J].Devel Comp Immunol,2014,42(1):36-41.
[8]Guan R,Mariuzza R A.Peptidoglycan recognition proteins of the innate immune system[J].Trends Microbiol,2007,15(3):127-134.
[9]Royet J,Gupta D,Dziarski R.Peptidoglycan recognition proteins:Modulators of the microbiome and inflammation[J].Nat Rev Immunol,2011,11(12):837-851.
[10]Pradeep S,Divya D,Mau S,et al.Structral basis of heparin bingding to camel peptidoglycan recognition protein-S[J].Int J Biochem Mol Biol,2012,3(1):86-94.
[11]Guan R,Malchiodi M L,Wang Q,et al.Crystal structure of the C-terminal peptidoglycan-binding domain of human peptidoglycan recognition protein Iα[J].J Biol Chem,2004,279:31873-31882.
[12]Nadine T N,Jessica Q,Ju H C,et al.Relative roles of the cellular and humoral responses in theDrosophilahost defense against three Gram-positive bacterial infections[J].PLoS One,2011,6(3):1-10.
[13]Susanna V,Wang J H,Mika R.TheDosophilaToll signaling pathway[J].J Immunol,2011,186:649-656.
[14]David L,Wendy T,Janet D,et al.Peptidoglycan recognition protein expression in mouse Peyer's patch follicle associated epithelium suggests functional specialization[J].Cell Immunol,2003,224(1):8-16.
[15]Chang C I,Yogarany C,Dominika B,et al.Structure of tracheal cytotoxin in complex with a heterodimeric pattern-recognition receptor[J].Science,2006,311(5768):1761-1764.
[16]Julient R,Dipika G,Roman D.Peptidoglycan recognition proteins:modulators of the microbiome and inflammation[J].Nat Rev Immunol,2011,11:837-851.
[17]刘 诚,黎满香,卢 帅,等.抗菌肽研究进展[J].动物医学进展,2011,32(3):94-99.
[18]Shoichiro K.Extracellular and intracellular pathogen recognition byDrosophilaPGRP-LE and PGRP-LC[J].Int Immunol,2010,22(3):143-148.
[19]Nada B,Franck C,Philippe L,et al.The Drosophila peptidoglycan-recognition protein LF interacts with peptidoglycanrecognition protein LC to downregulate the Imd pathway[J].EMBO Rep,2011,12(4):327-333.
[20]Akira G,Tamaki Y,Jun T,et al.Cooperative regulation of the induction of the novel antibacterial listericin by peptidoglycan recognition protein LE and the JAK-STAT pathway[J].J Biolog Chem,2010,285(21):15731-15738.
[21]Arihiro O,Hiroshi S,Krisana A,et al.Mouse peptidoglycan recognition protein PGLYRP-1plays a role in the host innate immune response againstListeria monocytogenesinfection[J].Infect Immunity,2011,79(2):858-866.
[22]Kashyap D R,Wang M,Liu L H,et al.Peptidoglycan recognition proteins kill bacteria by activating protein-sensing two-component systems[J].Nat Med,2011,17(6):676-683.
[23]Juan C P,David P W,Mickael P,et al.Negative regulation by amidase PGRPs shaps the drosohpila antibacterial response and protects the fly from innocuous infection[J].Immunity,2011,35(5):770-779.
[24]Virginie B D,Mickael P,Ivo G B,et al.Peptidoglycan sensing by the receptor PGRP-LE in theDrosophilagut induces immune responses to infectious bacteria and tolerance to microbiota[J].Cell Host and Microbe,2012,12(2):153-165.
[25]Roman D,Des R K,Dipika G.Mammalian peptidoglycan recognition proteins kill bacteria by activating two-component systems and modulate microbiome and inflammation[J].Microbial Drug Resist,2012,18(3):280-285.
[26]Roman D,Dipika G.Review:Mammalian peptidoglycan recognition proteins(PGRPs)in innate immunity[J].Innate Immunity,2010,16(3):168-174.

