实时荧光聚合酶链式反应检测转基因小麦B73-6-1、B72-8-11b和B102-1-2品系
曹际娟,徐君怡,曹冬梅,张丕桥,2,栾凤侠,刘 洋
(1.辽宁出入境检验检疫局,辽宁 大连 116001;2.辽宁师范大学生命科学学院,辽宁 大连 116029;3.黑龙江出入境检验检疫局,黑龙江 哈尔滨 150001)
随着转基因作物的不断商业化,转基因食品的安全性问题已逐渐成为公众关注的焦点。世界各国都在努力制定相应的法律和法规,以加强对进出口转基因植物及其产品的管理。转基因生物检测技术是安全评价的关键之一[1]。转基因检测已成为市场准入的重要检测指标。目前,应用最为广泛的是基于核酸水平的聚合酶链式反应(polymerase chain reaction,PCR)和实时PCR检测技术,可以实现对转基因产品通用元件的筛查检测[2],对目的基因的特异性检测[3],对转化载体构建的特异性检测[4],以及对转基因产品转化事件侧翼序列的特异性检测(即品系鉴定)[5]。随着进出口贸易的发展,仅仅确定是否含有转基因成分已无法满足需要,还要确定转基因产品是否被输入国所批准,即进行转化事件的品系鉴定,特别是在进出口贸易中新出现的转基因产品低水平混杂(low level presence,LLP)问题[6],更需要精准的检测方法作技术保障,这成为国际上转基因产品检测技术的发展趋势[7]。小麦作为世界主要粮食来源,其种植面积、总产量和总贸易额均居各类作物之首,其转基因遗传改良受到广泛关注[8]。从1992年第一株转基因小麦在美国问世至今20多年来,国内外应用转基因技术对小麦进行了大量研究,并在抗虫、抗旱、抗病毒、雄性不育、品质改良等方面取得了很多成绩[9-13]。转基因小麦B73-6-1和B72-8-11b是由基因枪将p1Dx5、pAHC25两个质粒通过共转化转入普通小麦品种中得到的[10]。B73-6-1的p1Dx5质粒携带高分子质量麦谷蛋白亚基HMW-GS基因、B72-8-11b的p1Dx5质粒携带高分子质量麦谷蛋白亚基1Dx5基因均可提高面筋含量、改良小麦品质,由自身胚乳特异启动子驱动;pAHC25质粒携带标记基因uidA和抗除草剂基因bar,上游连接广谱ubiquitin启动子。转基因小麦B102-1-2品系则是利用基因枪法将pAHc25和pHMW lAxl转化到小麦L88-31上而获得lAxl基因超表达的转基因品系,改善了面粉烘烤品质[10]。
本研究的目的是建立转基因小麦B73-6-1、B72-8-11b和B102-1-2品系特异性鉴定的实时PCR方法,以辨别具有相同外源基因的不同转基因作物品系,并为进出口贸易中转基因产品LLP问题的出现和解决方案做好技术储备。
1 材料与方法
1.1 材料与试剂
转基因小麦B73-6-1、B72-8-11b、B102-1-2粉末样品由黑龙江出入境检验检疫局提供;对照样品转基因玉米Bt176、转基因玉米MON88017、转基因玉米MIR604、转基因大豆89788、转基因稻米LLRice62购于美国油类化学家学会(AOCS);非转基因小麦京冬小麦6号、鄂麦18、川麦107非转基因小麦分别购于四川省种子公司、湖北省种子公司、江西省种子公司;GMO DNA提取试剂盒(TaKaRa Code No.D9093)、实时PCR Buffer、Taq DNA聚合酶、dNTP 宝生物工程(大连)有限公司。
1.2 仪器与设备
7500型实时PCR扩增仪 美国ABI公司;Mupid型核酸电泳仪 日本Advance-Bio公司;ND-1000型超微量紫外-可见分光光度计 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 基因组DNA提取
样品粉末分别在液氮中研成细末,提取基因组DNA。提取的DNA溶于100 L TE缓冲液中,采用超微量分光光度计对基因组DNA进行纯度、浓度测定,且OD260nm/OD280nm在1.7~2.0较合适。
1.3.2 引物和探针的设计
在文献[14-16]基础上,采用Beacon Designer 7.91软件,分别在跨边界序列的前端或后端设计该3种小麦品系鉴定的引物和探针(表1)。引物和探针由宝生物工程(大连)有限公司合成。探针的5’端标记羧基荧光素(FAM),3’端标记非荧光染料淬灭报告基团(Eclipse)。

表 1 小麦内源基因及3种转基因小麦品系鉴定的引物和探针序列Table 1 Primers and probes targeting wheat endogenous genes and event specific detection of transgenic wheat strains
1.3.3 实时PCR反应体系及反应程序
25 L的反应体系:在0.2 mL的PCR反应管中,加入正向引物(10 μmol/L)0.8 μL、反向引物(10 μmol/L)0.8 μL、探针(10 μmol/L)1 μL、2×PCR预混合缓冲液(含Mg2+和dNTPs 0.4 mmol/L,Ex Taq HS 1.25 U/25 μL)12.5 μL、模板DNA(0.1~2 μg)2 μL,水补足至25 μL。实时PCR反应程序为:预变性95 ℃,3 min;95 ℃,15 s;60 ℃,1 min;40 个循环。
1.3.4 灵敏度检测
以实时荧光PCR鉴定B73-6-1品系为例进行灵敏性实验。研磨B73-6-1品系样品并过80 目筛处理后,以不同质量分别添加到非转基因小麦粉基质中,制备成转基因含量为10%、1%、0.5%、0.1%、0.05%、0.01%、0.007%、0.005%、0.003%、0.001%(m/m)的共10 个梯度添加样品,分别进行检测。
2 结果与分析
2.1 模板gDNA的定量检测和小麦内源基因的扩增
各取转基因小麦B73-6-1、B72-8-11b、B102-1-2和京冬小麦6号等基因组DNA 1 L,进行1%琼脂糖凝胶电泳,检测基因组DNA纯度。此外,各取1 μL基因组DNA,使用超微量分光光度计进行纯度、浓度鉴定。由图1、表2可见,基因组DNA纯度和浓度均符合实时PCR检测要求。

图 1 部分模板gDNA的1%琼脂糖凝胶电泳图Fig.1 One percent agarose gel of electrophoresis the template gDNA

表 2 3 种转基因小麦基因组DNA纯度和浓度Table 2 Purities and concentrations of the genomic DNAs isolated from three transgenic wheat strains
为进一步验证小麦模板gDNA的提取效果,采用Wx012F/Wx012R引物和Wx012P探针,经实时PCR扩增小麦种内源的Wx012基因。每个样品进行2次重复,结果如图2所示。转基因小麦B73-6-1、B72-8-11b、B102-1-2以及对照的非转基因小麦(京冬小麦6号、鄂麦18、川麦107)均检测出荧光增幅曲线,而对照样品非小麦样品(转基因玉米Bt176、转基因玉米MON88017、转基因玉米MIR604、转基因大豆89788、转基因稻米LLRice62等)均未出现荧光增幅现象,表明Wx012F/Wx012R引物和Wx012P探针具有检测小麦内源基因的特异性,可用于转基因小麦检测中的内源质控。

图 2 小麦内源基因的实时荧光PCR扩增图谱Fig.2 Real-time PCR amplification plot of wheat endogenous genes
2.2 品系特异性检测结果
2.2.1 实时PCR特异性鉴定B73-6-1品系
使用B73F/B73R引物和B73P探针进行实时PCR扩增转基因小麦B73-6-1、B72-8-11b、B102-1-2品系及对照样品和非转基因小麦的基因组DNA,每个样品进行6次重复。由图3A可见,B73F/B73R引物和B73P探针仅检测出转基因小麦B73-6-1品系的荧光增幅曲线,而其他样品均未出现荧光增幅现象,表明B73F/B73R引物和B73P探针具有检测转基因小麦B73-6-1品系的特异性。

图 3 转基因小麦B73-6-1(A)、B72-8-11b(B)、B102-1-2(C)品系特异性的实时荧光PCR扩增图谱Fig.3 Amplification plots of event-specific real-time PCR for transgenic wheat strain B73-6-1 (A)、B72-8-11b (B)、B102-1-2 (C)
2.2.2 实时PCR特异性鉴定B72-8-11b品系
使用B72F/B72R引物和B72P探针进行实时PCR扩增检测转基因小麦B73-6-1、B72-8-11b、B102-1-2品系及对照样品和非转基因小麦的基因组DNA。每个样品进行6 次重复。由图3B结果可见,B72F/B72R引物和B72P探针仅检测出转基因小麦B72-8-11b品系的荧光增幅曲线,而其他样品均未出现荧光增幅现象,表明B72F/B72R引物和B72P探针具有检测转基因小麦B72-8-11b品系的特异性。
2.2.3 实时PCR特异性鉴定B102-1-2品系
使用B102F/B102R引物和B102P探针进行实时PCR扩增转基因小麦B73-6-1、B72-8-11b、B102-1-2品系及对照样品和非转基因小麦的基因组DNA。每个样品进行6 次重复性实验。实时PCR扩增曲线见图3C。由图3C可见,B102F/B102R引物和B102P探针仅检测出转基因小麦B102-1-2品系的荧光增幅曲线,而其他样品均未出现荧光增幅现象,表明B102F/B102R引物和B102P探针具有检测转基因小麦B102-1-2品系的特异性。
2.3 实时PCR检测灵敏度结果
以B73-6-1品系为例,测定本方法的检测限,结果如图4所示。本方法对B73-6-1品系样品的检测限可以达到0.01%(m/m),而0.007%含量以下的样品则荧光信号在基线以下,属于阴性结果。DNA提取和实时荧光PCR的过程均重复了6 次,结果都一致。
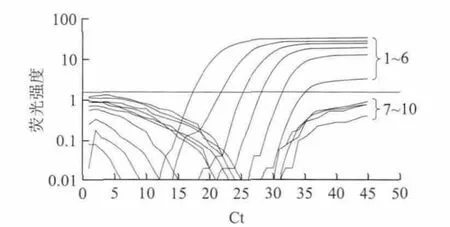
图 4 B73-6-1品系的实时荧光PCR灵敏度检测图谱Fig.4 Real-time PCR amplification plots for its sensitivity for detection of transgenic wheat strain B73-6-1
3 讨 论
由于小麦是异源六倍体作物,基因组中含有A、B、D 3组染色体,其中3组染色体中An、Bn、Dn同源基因之间具有很强的互补性,使得小麦的遗传机理更复杂[18-20],所以转基因小麦的研究比其他转基因作物更加困难。品系鉴定的转化事件特异检测是通过扩增侧翼序列(受体基因组和插入DNA的连接区域)来鉴定含有相同外源DNA的不同转基因生物[5]。转基因小麦B73-6-1、B72-8-11b和B102-1-2是由Barro等[10]于1997年构建成功,其结构复杂,已有筛选检测方法的文献[21]报道,也有通过染色体步移测序技术获取了此3种转基因小麦的侧翼序列,并建立了PCR鉴定方法的报道[14-16]。然而PCR方法中扩增产物需要电泳检测,操作繁琐,易引发污染和假性结果。而实时荧光PCR具有快捷、准确的优势,已有广泛应用该技术鉴定转基因产品的文献报道[23-25]。为此,本研究在前期研究的基础上,分别在跨边界序列的前端或后端重新设计该3种小麦品系鉴定的引物和探针,经过特异性实验和灵敏度实验,建立了简便、快捷、准确的转基因小麦品系特异性鉴定的实时荧光PCR方法,为特异性鉴定转基因小麦B73-6-1、B72-8-11b和B102-1-2品系提供了更为有效的方法。这将为准确、快速、高效地检测转基因作物及其产品的标准制定和试剂盒的开发提供技术支持,具有较大的应用价值。
[1]Organization for Economic Cooperation and Development (OECD).OECD safety evaluation of foods derived by modern biotechnology:concepts and principles[R]. Paris: OECD, 1993.
[2]ANKLAM E, GADANI F, HEINZE P, et al. Analytical methods fordetection and determination of genetically modified organisms in agri-cultural crops and plant-derived food products[J]. European Food Research and Technology, 2002, 214(1): 3-26.
[3]YANG Rong, XU Wentao, LUO Yunbo, et al. Event-specific qualitativeand quantitative polymerase chain reaction detection of roundup readyevent GT73 based on the 3’-transgene integration sequence[J]. PlantCell Reports, 2007, 26(10): 1821-1831.
[4]XU Wentao, BAI Weibin, LUO Yunbo, et al. Research progress indetection technique for genetically modified organisms[J]. Chinese Journal of Agricultural Biotechnology, 2009, 6(1): 1-9.
[5]张亚炜, 姜美丽, 于绍山. 关于转基因食品的安全性评价[J]. 农业工程技术: 农产品加工业, 2009(8): 50-53.
[6]许文涛, 白卫滨, 罗云波, 等. 转基因产品检测技术研究进展[J]. 农业生物技术学报, 2008, 16(4): 714-722.
[7]徐丽丽, 李宁, 田志宏. 转基因产品低水平混杂问题研究[J]. 中国农业大学学报: 社会科学版, 2012, 29(2): 125-132.
[8]VASIL I K, ANDERSON O D. Genetic engineering of wheat gluten[J]. Trends in Plant Science, 1997, 2(8): 292-297.
[9]ALTPETER F, VASIL V, SRIVASTAVA V, et al. Expression of a novel high-molecular-weight glutenin subunit 1Ax1 gene into wheat[J]. Nature Biotechnology, 1996, 14(9): 1155-1159.
[10]BARRO F, ROOK E L, BEKES F. Transformation of wheat with high molecular weight subunit genes results in improved functional properties[J]. Nature Biotechnology, 1997, 15(12): 1295-1299.
[11]REGINA A, BIRD A, TOPPING D, et al. High-amylose wheat generated by RNA interference improves indices of large-bowel health in rats[J]. Proceedings of the National Academy of Sciences, 2006,103(10): 3546-3551.
[12]FIELD J.M, BHANDARI D, BONET A, et al. Introgression of transgenes into a commercial cultivar confirms differential effects of HMW subunits 1Ax1 and 1Dx5 on gluten properties[J]. Journal of Cereal Science, 2008, 48(2): 457-463.
[13]SUN C X, ZHANG G T, LIANG R Q, et al. Progress on improvement of wheat quality by transgenic technology[J]. Molecular Plant Breeding, 2009, 7(2): 398-406.
[14]ZHANG Piqiao, XU Junyi, ZHENG Qiuyue, et al. Flanking sequence determination and event specific detection of transgenic wheat B72-8-11b strain[J]. Applied Biochemistry and Biotechnology, 2013, 169(1):1523-1530.
[15]XU Junyi, CAO Jijuan, CAO Dongmei, et al. Flanking sequence determination and event-specific detection of genetically modified wheat B73-6-1[J]. Acta Biochimica et Biophysica Sinica, 2013, 45(5): 416-421.
[16]CAO Jijuan, XU Junyi, ZHAO Tongtong, et al. Flanking sequence determination and specific PCR identification of transgenic wheat B102-1-2[J]. Preparative Biochemistry and Biotechnology, 2014,44(3): 257-267.
[17]国家认证认可监督管理委员会. SN/T 1943—2007 小麦中转基因成分PCR和实时荧光PCR定性检测方法[S]. 北京: 中国标准出版社, 2007.
[18]王广金. 葡聚糖酶基因、高分子量谷蛋白优质亚基基因转化小麦的研究[D]. 哈尔滨: 东北农业大学, 2002: 21-25.
[19]BARRO F, MART IN A, CABRERA A. Transgene integration and chromosome alterations in two transgenic lines of tritordeum[J].Chromosome Research, 2003, 11(6): 565-572.
[20]LEONIE R, STEELE S H, BARCELO P. Transgene inheritance,segregation and expression in bread wheat[J]. Euphytica, 2003, 129(3):301-309.
[21]栾凤侠, 张洪祥, 白月. 转基因小麦的定性PCR筛选检测技术[J]. 麦类作物学报, 2007, 27(3): 378-381.
[22]陈明洁, 刘勇, 涂知明, 等. 多重PCR法快速鉴定转基因小麦植株及后代[J]. 华中科技大学学报: 自然科学版, 2004, 32(9): 105-107.
[23]曹际娟, 覃文, 朱水芳, 等. 用实时荧光PCR方法鉴定转基因玉米T14/25[J]. 遗传, 2004, 26(5): 689-694.
[24]白卫滨, 孙建霞, 程国灵, 等. 实时荧光PCR技术定量检测转基因豆粉的研究[J]. 食品科学, 2009, 30(6): 238-242.
[25]黄新, 张琰, 侯立华, 等. 转基因水稻"科丰6号"实时荧光PCR定性定量检测方法研究[J]. 生物技术通报, 2010(2): 90-93.

