应用PE N3型电子鼻传感器快速检测食源性致病菌
陈丽萍,徐茂琴,何红萍,李 晔,*
(1.宁波大学海洋学院,浙江 宁波 315211;2.宁波城市职业技术学院,浙江 宁波 315100)
随着经济全球化进程的加快,由食源性致病菌导致的食品安全问题不断出现。据报道,全球每年发生40~60亿例食源性疾病[1]。细菌污染是影响食品质量和安全的主要因素,由其引起的食源性疾病的暴发严重损害人体健康。随着现代食品安全控制技术如危害分析关键控制点(hazard analysis critical control point,HACCP)、微生物危险性评估(microbio 1ogical risk assessment,MRA)的发展等,建立和完善一套微生物快速定量检测技术,显得尤为重要[2]。
目前常用的细 菌检测方法大致包括目前常用的细菌检测方法大致包括分离培养鉴定法、生化鉴定法、免疫学方法、DNA杂交和定量聚合酶链式反应(quantitative polymerase chain reaction,QPCR)等方法[3-4]。传统的细菌检验方法灵敏度高、费用低,但检测所需时间较长且工作量庞大。现代免疫学和分子生物学特异性好效率高,但一般样品预处理过程比较复杂,且较难达到实时检测的目的[5]。
PEN3型便携式电子鼻传感器是一种新颖的分析、识别和检测手段。其根据对不同样品的气味信息进行简单的比对分析,通过采集标样信息建立数据库,再利用化学计量学的统计分析方法对未知样品进行定性和定量分析,具有快 速、便捷的特点,其工作原理类似人的鼻子,也称之为“电子鼻”[6]。应用电子鼻检测,样品处理方便,操作简单快捷、有望实现实时检测。邓高燕等[7]利用电子鼻技术对两种细菌在菌株水平上挥发性代谢产物进行研究,表明利用电子鼻进行区 分和鉴定具有一定的可行性。胥勋涛等[8]利用自己开发的气味浓缩电子鼻提高了两株病原菌的区分能力,表明电子鼻技术在微生物快速检测上具有应用潜力。喻勇新等[9]利用电子鼻技术检测普通过 夜培养后的3 种细菌培养液,Concina等[10]将其应用到加工番茄中的微生物污染检测。目前化学传感器的在食品中的应用主要集中在果蔬成熟度和贮藏期的检验[11-12]、奶制品的掺假检验[13-14]、油脂的检测[15-16]、以及谷物的贮藏检验等[17]。
金黄色葡萄球菌(Staphyloccocus aureus)、大肠杆菌(Escherich coli)、粪链球菌(Fecal streptococcus)、单增李斯特菌(Listeria monocytogenes)是4 种常见的食源性致病菌。从生物分类学角度上看,这4 种致病菌归于4 种不同的属,依次分别为葡萄球菌属、肠杆菌属、链球菌属和李斯特菌属,4 者在基因序列以及代谢表型上均有差别,不同菌株对培养液的利用也存在差异性,从而其挥发性代谢产物也必然是不同的[18]。本实验依据PEN3型电子鼻传感器对不同食源性致病菌代谢挥发物质的差异响应,研究应用PEN3型电子鼻传感器快速检测区分不同食源性致病菌的可行性。
1 材料与方法
1.1 菌株与培养基
金黄色葡萄球菌(Staphyloccocus aureus)ATCC 29213、大肠杆菌(Escherich coli)ATCC 25922、粪链球菌(Streptococcus fecal)ATCC 29212、单增李斯特菌(Listeria monocytogenes)ATCC 19111 青岛高科园海博生物技术有限公司。
LB液体培养基:5 g/L酵母提取物、10 g/L 胰蛋白胨、5 g/L氯化钠,培养基配制好后经过121 ℃高压湿热灭菌20 min。
1.2 仪器与设备
PEN3型便携式电子鼻传感器 德国Airsense公司;QYC-200型恒温摇床 上海比朗仪器有限公司;BYY-300型培养箱 宁波江南仪器厂;732N可见分光光度计上海精密科学仪器有限公司;SW-CJ-1F单人双面超净工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 样品菌液的制备
将各菌种活化后分别挑取单菌落,接种于装有100 mL LB培养液的250 mL三角瓶中,置于37 ℃,120 r/min摇床培养过夜作为原始菌液,菌落数约为108CFU/mL,保存备用。
采用梯度稀释法,用无菌培养液分别将原始菌液稀释103、105倍和107倍得到样品菌液(对应菌落数分别为105、103CFU/mL和10 CFU/mL),各取0.5 mL分装到10 mL的传感器样品瓶中,进行传感器检测。
吸取1 mL原始菌液加入25 mL培养液中,于37 ℃,120 r/min恒温摇床上培养,分别于0、2、4、6、8、10 h准确吸取0.5 mL培养后的菌液进行PEN3型电子鼻传感器检测。
1.3.2 电子鼻传感器原理及检测
PEN3型电子鼻传感器是由10 种金属氧化物半导体型(metal oxide semiconductor,MOS)化学传感元件组成,每型传感元件所对应的主要敏感物质类型有一定的区别(表1)。PEN3主要通过运行一个改进过的解吸单元,具有自动调整、自动校准及系统自动富集的功能,其主要原理是利用传感器和气体相互作用,发生氧化还原反应,从而使传感器活性材料的导电性发生变化,以电路中电阻的变化值进行信号输出[6]。传感器的响应信号即为传感器接触到样品挥发性物质后的电导率G与传感器在经过标准活性炭过滤气体后的电导率G0的比值。不同菌液在不同条件下有不同的代谢产物,在传感器上呈现不同的气味感应信号。

表 1 化学传感器及其对应的敏感物质类型Table 1 Chemical sensors corresponding to different types of volatile substances
准确吸取样品菌液0.5 mL于样品瓶中,25 ℃恒温环境中运用PEN3型便携式电子鼻传感器对样品菌液进行检测。传感器信号在90 s后基本稳定,选定信号采集时间为100 s。每组样品菌液分别做3 次平行重复。
1.4 数据分析
选取化学传感器检测第100秒的测量数据进行统计分析。运用R For Windows对传感器的响应信号进行传感器响应聚类分析,PEN3型传感器配套的 Winmuster软件对数据进行主成分分析(principal component analysis,PCA)及线性判别分析( linear discriminant analysis,LAD)。
2 结果与分析
2.1 传感器的信号响应
PEN3型电子鼻传感器中10 种金属 氧化物半导体型化学传感元件对不同细菌样品的检测反应可得到响应曲线和雷达图(图1)。从检测样品的传感器响应曲线中可以得到各个菌株样品传感器信号随时间的变化趋势。各菌株不同培养时间,不同浓度的挥 发性物质各不相同,故10 种化学传感元件对不同气味有不同的响应,信号的相对强弱可通过雷达图形状的差异可反映出来。

图 1 10 个传感元件对大肠杆菌培养2 h后样品的响应曲线(A)和 雷达图(B)F ig.1 Response curves (A) and radar chart (B) of ten sensors for E. coli cultured for 2 h
2.2 传感器响应的聚类分析

图 2 10 种传感元件响应值的聚类区分Fig.2 Cluster analysis of the response values from ten sensors
由图2可知,化学传感器的10 型传感元件(M1、M2、M3、M4、M5、M6、M7、M8、M9、M10)对不同菌株的各自响应之间存在明显差异,表明不同样本之间的挥发物质存在较大差异。
根据响应 值判断,M4型传感元件(主要对氢气有选择性)在不同菌株与培养基之间的响应值较为接近,M2型传感元件(灵敏度大,对氮氧化合物很灵敏)的各个响应值之间区别较大。根据响应值的不同,PEN3的10 种传感器元件在金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌等4 种菌和空白培养基的响应可聚为3 类:M2一类,M1、M7、M9一类,M3、M4、M5、M6、M8、M10这6个传感器元件为一类。说明不同传感 元件对菌株 和培养基的代谢产物气味之间存在一定程度的关联度。
金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌和空白培养基在不同传感器元件上的响应值存在差异,根据响应值可聚为3 类:单增李斯特菌和大肠杆菌聚一类,空白培养基一类,粪链球菌和金黄色葡萄球菌为一类。表明细菌与培养基之间的区别可用传感器表征,但是不同菌株之间存在一定的聚类性,需要进一步进行区别验证。
2.3 不同菌株稳定时期的响应区分

图 3 不同细菌稳定期时的PCA分析(A)和LDA分析(B)Fig.3 PCA analysis (A) and LDA analysis (B) of different bacteria at the stationary growth stage
PCA是将提取的传感器响应信号进行数据转换和降维,并对降维后的特征向量进行线性分类,PC1和PC2上包含了在PCA转换中得到的第1主成分和第2成分的方差贡献率。方差贡献率越大,说明此主要成分可以较好的反映原来多指标的信息。一般情况下,总贡献率超过70%~85%的方法即可使用[14]。LDA将样品信号数据通过运算法则投影到某一方向,注重样品在空间中的分布状态及彼此间的距离分析,可以使组间变异与组内变异的比率最大。
基于Winmuster软件将传感器采集到的金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌4株菌信号采用PCA和LDA法建立细 菌稳定期时的响应模型,如图3所示。大肠杆菌、粪链球菌、金黄色葡萄球菌、单增李斯特菌4 株样本的分析数据点均分布于各自区域,没有重叠, 并且它们之间的距离较大。PC1、PC2的方差贡献率分别为86.66%和10.79%,PC1、PC2的总贡献率为97.45%,LD1、LD2的方差贡献率分别为62.61%和29.64%,LD1、LD2的总贡献率为92.25%,这说明这4 株细菌与空白培养基之间的挥发性气味有较大差异,PEN3型电子鼻传感器能够准确地识别出不同细菌的特征气味,采用PCA和LDA方法能对其进行较好的区分。
2.4 不同培养时间下菌株的传感器响应

表 2 不同培养时间4 种菌株PCA和LDA分析的方差贡献率Table 2 Variance contribution of four bacteria cultured for different times by PCA analysis and LDA analysis

图 4 不同 培养时间金黄色葡萄球菌的PCA区分(A)和LDA区分(B)Fig.4 PCA analysis (A) and LDA analysis (B) of Staphylococcus aureus at different culture times


图 5 不同培养时间下大肠杆菌的PCA区分(A)和LDA区分(B)Fig.5 PCA analysis (A) and LDA analysis (B) of E. coli at different culture times

图 6 不同培养时间粪链球菌的PCA区分(A)和LDA区分(B)Fig.6 PCA analysis (A) and LDA analysis (B) of Streptococcus fecal at different culture times

图 7 不同培养时间下单增李斯特菌的PCA区分(A)和LDA区分(B)Fig.7 PCA analysis (A) and LDA analysis (B) of Listeria monocytogenes at different culture times
将接种摇床培养2、4、6、8、10 h后的金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌进行PCA和LDA分析,如图4~7所示,各菌株的方差贡献率如表2所示。不同培养时间细菌的数据点的方差总贡献率均大于85%。在PCA和LDA区分度下,经过不同培养时间的金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌各自位于一定的区域范围,不同菌株区分度明显,没有出现重叠且贡献率较高。
不同种类的细菌菌体所含的酶系统不同,其分解能力不同,从而其代谢产物不同。同时,由于细菌生长要经历迟缓期、对数期、稳定期、衰退期4 个阶段,所以对同一细菌的不同生长阶段,挥发物的浓度也有差异[5]。也就是说在同样的培养基中培养一定时间后,对营养基质的利用情况和所产生的产物就会不同。检测表明使用PEN3型电子鼻传感器可以根据气体成分的差异而将不同时期的细菌进行区分。
2.5 传 感器对不同浓度细菌的响应区分

图 8 不同稀释浓度金黄色葡萄球菌的PCA(A)和LDA(B)区分Fig.8 PCA analysis (A) and LDA analysis (B) of Staphylococcus aureus at different concentrations
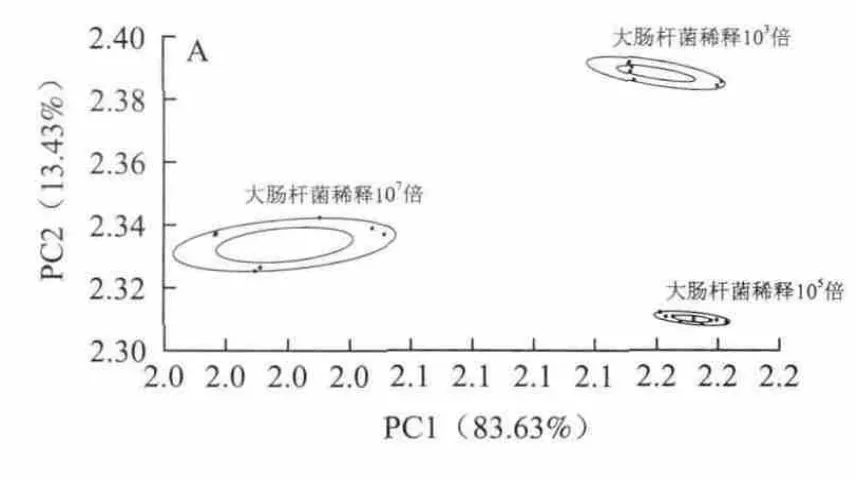

图 9 不同稀释浓度大肠杆菌的PCA(A)和LDA(B)区分Fig.9 PCA analysis (A) and LDA analysis (B) of E. coli at different concentrations

图 10 不同稀释浓度粪链球菌的PCA(A)和LDA(B)区分Fig.10 PCA analysis (A) and LDA analysis (B) of Streptococcus fecal at different concentrations

图 11 不同稀释浓度单增李斯特菌的PCA(A)和LDA(B)区分Fig.11 PCA analysis (A) and LDA analysis (B) of Listeria monocytogenes at different concentrations
将处于生长稳定期的金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌4 种菌的原始菌液分别稀释103、105、107倍(对应菌落数为105、103、10 CFU/mL)后进行PEN3型电子鼻传感器检测,并进行PCA和LDA分析,结果如图8~11所示。在所建的模型中,不同浓度的金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌各自分析数据点均分布于各自区域,没有重叠。金黄色葡萄球菌、大肠杆菌、粪链球菌、李斯特菌4 种菌的各自不同浓度的菌液在PCA图上都能够很好的区分开,区分度较为集中,主要在PC1和LD1上,这表明传感器对细菌的响应较为灵敏,主成分分析和线性判别分析的区分度较强。根据稳定时期不同浓度细菌产生的代谢挥发性物质的浓度不同,基于PEN3型电子鼻传感器的灵敏性,在建立不同细菌的指纹图谱基础上,可进一步研究了其对低浓度细菌的识别能力。
3 结 论
基于金属氧化物的PEN3型电子鼻传感器技术对金黄色葡萄球菌、大肠杆菌、粪链球菌、单增李斯特菌4 种食源性致病菌培养液的挥发性代谢产物进行检测,PCA、LDA均可建立4种菌的指纹图谱,并将4 种致病菌株明显区分开,在原始菌液稀释107倍后(对应菌落数约10 CFU/mL)的较低浓度下仍能区分开。这说明基于气味指纹的PEN3型电子鼻传感器技术具有区分不同微生物的潜在能力,有望在致病菌快 速检测和鉴定方面进一步得到应用。但具体的特征性挥发性成分组成可进一步结合仪器如GC-MS、GC-O等进行检测[19-22]。
相对于传统的微生物检测方法[23-25],PEN3型电子鼻传感器检测主要针对于微生物的挥发性代谢产物,对样品没有特殊的要求,操作简单,费时短灵敏度高,最重要的是在操作过程中不需要对样品进行任何破坏处理,这在微生物快速检测中是一项非常有发展前景的无损伤快速检测方法,有望在食源性致病菌的低浓度快速检测和鉴定方面进一步得到利用。
[1]王大勇, 方振东, 谢朝新, 等. 食源性致病菌快速检测技术研究进展[J].微生物学杂志, 2009, 29(5): 67-72.
[2]金少华, 徐粒子. 食源性疾病(致病菌)监测与调查处置研究进展[J].安徽预防医学杂志, 2010, 16(6): 458-461.
[3]焦振泉, 郭云昌, 裴晓燕, 等. 食源性致病菌检测方法研究进展:Ⅰ.传统检测方法[J]. 中国食品卫生杂志, 2007, 19(1): 58-62.
[4]焦振泉, 郭云昌, 裴晓燕, 等. 食源性致病菌检测方法研究进展:Ⅱ.分子生物学检测方法[J]. 中国食品卫生杂志, 2007, 19(2): 153-157.
[5]许一平, 成炜, 陈福生. 多重 PCR 技术在食源性病原细菌检测中的应用[J]. 食品科学, 2007, 28(2): 355-359.
[6]聂雪梅, 刘仲明, 张水华, 等. 电子鼻及其在食品领域的应用[J]. 传感器技术, 2004, 23(10): 1-3.
[7]邓高燕, 喻勇新, 潘迎捷, 等. 电子鼻对两种食源性致病菌在菌株水平上区分的研究[J]. 食品工业科技, 2011, 32(12): 142-145.
[8]胥勋涛, 田逢春, 闫嘉, 等. 结合气体浓缩的电子鼻伤口病原菌快速检测[J]. 传感技术学报, 2009, 22(3): 303-306.
[9]喻勇新, 刘源, 孙晓红, 等. 基于电子鼻区分三种致病菌的研究[J].传感技术学报, 2010, 23(1): 10-13.
[10]CONCINA I, FALASCONI M, GOBBI, et al. Early detection of microbial contamination in processed tomatoes by electronic nose[J].Food Control, 2009, 20(10): 873-880.
[11]GOMEZ A H, HU G, WANG J, et al. Evaluation of tomato maturity by electronic nose[J]. Computers and Electronics in Agriculture, 2006,54(1): 44-52.
[12]SAEVELS S, LAMMERTYN J, BEMA A Z, et al. An electronic nose and a mass spectrometry based electronic nose for assessing apple quality during shelf life[J]. Postharvest Biology and Technology, 2004,31(1): 9-19.
[13]高晓霞, 宋娟娟, 董亚飞, 等. 应用电子鼻对奶粉掺假快速检测的研究[J]. 食品工业科技, 2012, 33(18): 79-83.
[14]徐亚丹, 王俊, 赵国军. 基于电子鼻的对掺假的伊利牛奶的检测[J].中国食品学报, 2006, 6(5) : 111-118.
[15]孙静, 黄沁怡, 李芳, 等. 应用化学传感器和GC-MS研究加热温度与大豆油挥发物质的关系[J]. 中国粮油学报, 2013, 28(1): 122-128.
[16]BENEDETTI S, DRUSCH S, MANNINO S. Monitoring of autoxidation in LCPUFA-enriched lipid microparticles by ele ctronic nose and SPME-GCMS[J]. Talanta, 2009, 78(4/5): 1266-1271.
[17]HAI Z, WANG J. Detection of adulteration in camellia seed oil and sesame oil using an electronic nose[J]. European Journal of Lipid Science and Technology, 2006, 108(2): 116-124.
[18]王智文, 马向辉, 陈洵, 等. 微生物代谢组学的研究方法与进展[J].化学进展, 2010, 22(1): 163-172.
[19]王 霞, 黄健, 侯云丹, 等. 电子鼻结合气相色谱-质谱联用技术分析黄鳍金枪鱼肉的挥发性成分[J]. 食品科学, 2012, 33(12): 268-272.
[20]禹海文, 苏秀榕, 张丽媛, 等. 气-质联用和电子鼻 对浒苔苦味的研究[J].中国食品学报, 2012, 12(7): 212-215.
[21]秦早, 杨冉, 高桂园, 等. 顶空固相微萃取结合气质联用分析芝麻油和芝麻香精的挥发性成分[J]. 食品科学, 2012, 33(24): 263-268.
[22]黄健, 王霞, 侯云丹, 等. 加热温度对牡蛎挥发性风味成分的影响[J].核农学报, 2012, 26(2): 311-317.
[23]商颖, 许文涛, 元延芳, 等. 通用引物多重PCR技术检测3 种病原微生物[J]. 食品科学, 2011, 32(10): 103-106.
[24]王大鹏, 史贤明. 贝类中致病微生物的检测技术及其组织分布[J].微生物学报, 2011, 51(10): 1304-1309.
[25]李晓蓓, 欧杰, 王婧. 食品中微生物源毒素检测方法研究进展[J]. 食品科学, 2011, 32(11): 334-339.

