流体剪切应力对人骨肉瘤MG-63细胞周期相关基因表达的影响
张连昌,李东韬,,赵学武,,曹新生,张 舒第四军医大学航空航天生物动力学教研室,航空航天医学教育部重点实验室,陕西西安 700;海军总医院心脏中心,北京 00048;975部队医院,吉林长春 005
流体剪切应力对人骨肉瘤MG-63细胞周期相关基因表达的影响
张连昌1,李东韬1,2,赵学武1,3,曹新生1,张 舒1
1第四军医大学航空航天生物动力学教研室,航空航天医学教育部重点实验室,陕西西安 710032;2海军总医院心脏中心,北京 100048;393175部队医院,吉林长春 130051
目的观察人骨肉瘤MG-63细胞在流体剪切应力作用后,MG-63细胞中细胞周期相关基因表达谱的变化特点。方法MG-63细胞常规培养72 h,随机分成剪切应力作用组和无剪切应力作用对照组。将剪切应力作用组的细胞载玻片置于流体剪切系统中进行实验,流体剪切应力设为1.5 Pa,作用时间为60 min。无剪切应力作用组的细胞静置相同时间。之后分别提取两组的RNA,用Affymetrix公司的全人类基因组芯片进行杂交,并对获得的数据进行分析。结果MG-63细胞中细胞周期相关基因表达谱发生改变,247个与细胞周期相关的基因出现差异表达,130个基因表达上调(Fold Change>2,P<0.05),117个基因表达下调(Fold Change<-2,P<0.05)。差异基因主要参与细胞周期多个生物学过程的调控,包括对细胞周期进程、周期阻滞、有丝分裂调控、G1/S转变、有丝分裂间期等生物学过程的调控。结论流体剪切应力可以通过改变成骨细胞中细胞周期相关基因的表达,进而调控成骨细胞的增殖和分化等功能。
剪切应力;基因芯片;MG-63;细胞周期
当人进行日常活动和体育锻炼时,在体质量和肌肉收缩的作用下,骨骼会发生形变,导致骨骼细胞周围组织液发生位移,对骨骼细胞产生流体剪切应力刺激[1-2]。已有研究表明,这种流体剪切应力刺激可对骨骼细胞的细胞周期产生重要影响[3-5]。细胞周期是生命活动的基本过程,细胞伴随着周期的变迁进入增殖、分化、衰老和死亡等生理状态。成骨细胞是骨组织修复过程中的主要功能细胞,是力学刺激因素的最终感受和效应细胞,其增殖活性和功能状态直接反应了骨生长重建的状态[6-7]。因此,细胞周期的调控在骨的形成和吸收这一动态过程中起十分重要的作用。然而,在成骨细胞的周期调控中,流体剪切应力的作用及其特点尚不明确。本实验旨在观察人骨肉瘤MG-63细胞在流体剪切应力作用后,MG-63细胞中细胞周期相关基因表达谱的变化特点,探索流体剪切应力对细胞周期的调控特点及其机制。
材料和方法
1 材料和仪器 人骨肉瘤MG-63细胞系购买于ATCC。DMEM/F12混合培养液(Hyclone,美国),新生牛血清(四季青,中国),胰蛋白酶(Gibco,美国),流体剪切系统为本实验室自行研制。
2 流体剪切应力刺激实验 MG-63细胞用含10% FBS的DMEM/F12培养液,在37℃、5% CO2的恒温培养箱中常规培养。将MG-63细胞以1×105个/孔的密度接种于预置2.55 cm×2.15 cm载玻片的六孔板中,培养72 h。随机分为剪切应力作用组和无剪切应力作用对照组。剪切应力作用组置于流体剪切系统中给予剪切应力刺激,流体剪切应力设为1.5 Pa,作用时间为60 min。无剪切应力作用组的细胞在六孔板中静置相同时间以作为对照。
3 总RNA提取与检测 用Trizol分别提取剪切应力作用组和对照组的总RNA,用分光光度计检测RNA样本浓度和纯度,经过检测样品的浓度和纯度符合基因芯片的实验要求,样品于-80℃冰箱冻存。4 基因芯片杂交和扫描分析 基因芯片采用Affymetrix公司的Affymetrix Human U133plus 2.0芯片。实验步骤如下:1)进行RNA抽提和纯化。采用TRIZOL Reagent进行样品的总RNA抽提,所得总RNA经电泳质检合格后使用RNeasy micro kit和RNase-Free DNase Set纯化。2)进行样品RNA的放大和标记。样品RNA采用Affymetrix表达谱芯片配套试剂盒对样品总RNA中的mRNA进行放大、标记和纯化,获得带有生物素标记的cRNA。3)进行芯片杂交。在滚动杂交炉中45℃,16 h滚动杂交,杂交完成后在洗涤工作站进行芯片洗涤。4)进行芯片扫描。芯片结果采用GeneChip®Scanner 3000 (Cat#00-00212,Affymetrix,Santa Clara,CA,US)进行扫描,Command Console Software 3.1 (Affymetrix,Santa Clara,CA,US)读取原始数据,质控合格的数据采用Gene Spring Software 11.0 (Agilent technologies,Santa Clara,CA,US)进行归一化处理,所用的算法为MAS5。
5 数据分析 用One-Step Tukey's Biweight Algorithm对获得的获得的数据进行分析,Fold Change (linear)<-2或者Fold Change(linear)>2,P<0.05的基因认为其表达差异是有统计学意义的。通过美国国家生物技术信息中心(NCBI)公共数据库查询基因功能,用Gene Ontology功能分类标注对差异基因进行功能分类和生物信息学分析。
结 果
流体剪切应力作用后,MG-63细胞中有247个与细胞周期相关基因的表达发生改变,其中130个基因表达上调,117个基因表达下调(图1)。12个表达显著下调的基因(Fold Change<-4)(表1)。13个表达显著上调的基因(Fold Change>5)(表2)。通过GO分析,差异基因主要参与细胞周期多个生物学过程的调控,包括对细胞周期进程、周期阻滞、有丝分裂调控、G1/S转变、有丝分裂间期等生物学过程的调控(表3)。
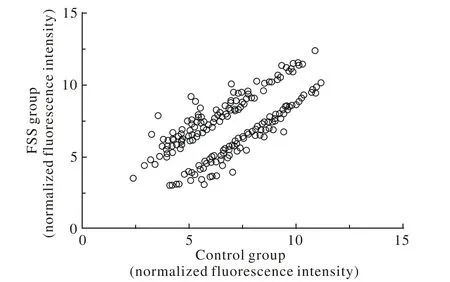
图 1 剪切应力作用组与对照组的细胞周期相关基因差异表达散点图Fig. 1 Scatter plots of differentially expressed genes related to cell cycle in FSS group and control group
讨 论
流体剪切应力在骨的生长和维持骨正常功能状态中起着重要作用[8-10]。骨骼细胞特别是成骨细胞可感受流体剪切应力,并通过多种信号通路对流体剪切应力发生响应,表现为细胞的增殖、分化和凋亡等改变[11-12]。适当增加力学刺激可引起骨形成增多、重吸收减少和骨量增加[13]。
细胞周期蛋白和细胞周期蛋白依赖性激酶在细胞的周期调控中发挥着重要的作用[14]。本研究中发现,流体剪切应力作用之后,MG-63细胞中的细胞周期蛋白和细胞周期蛋白依赖性激酶的表达也发生了显著性变化,细胞周期蛋白(Cyclin D1,Cyclin E1,Cyclin E2,Cyclin T2)、细胞周期蛋白依赖性激酶CDK6、细胞转录激活因子E2F2和E2F3的基因表达均显著下降,细胞周期蛋白(Cyclin B1,Cyclin G1,Cyclin G2)和细胞周期蛋白依赖性激酶(CDK2,CDK3,CDK4,CDK10)的基因表达均显著上升。以往研究已证明Cyclin D1主要在G1早期表达,并与CDK2/CDK4结合成为始动细胞周期的
启动子。Cyclin E主要在G1晚期和S早期表达增加,细胞进入S期后Cyclin D1和Cyclin E将会被降解,S期晚期和G2早期Cyclin A和Cyclin B表达,促进细胞进入M期。细胞增殖能力增加一个重要的表现即为S期细胞比例增加,本实验中Cyclin D1、Cyclin E表达下降,Cyclin B1表达上升,与此符合。由此证明,流体剪切应力可以通过这些基因调控成骨细胞周期,对成骨细胞的增殖产生影响。

表1 与细胞周期相关的表达下调部分基因Tab. 1 Down-regulated genes related to cell cycle

表2 与细胞周期相关的表达上调部分基因Tab. 2 Up-regulated genes related to cell cycle
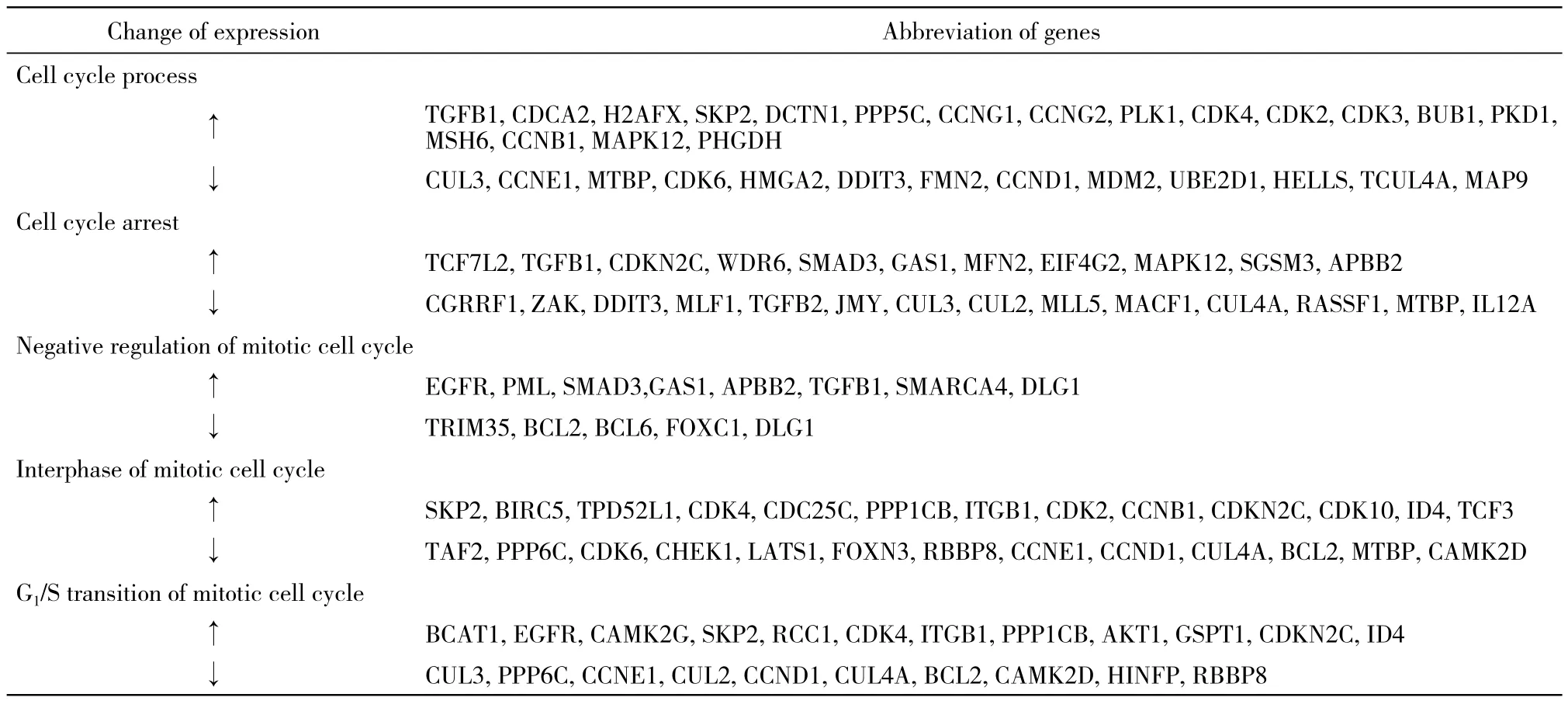
表3 差异表达基因的GO分析部分结果Tab. 3 GO analysis results of differentially expressed genes
除了传统与细胞周期调控有关的基因表达会发生变化之外,我们还发现了其他一些与细胞周期相关基因的表达也出现显著性变化,这些基因包括核自身抗原精子蛋白(nuclear autoantigenic sperm protein,NASP)、MDM2结合蛋白(MDM2 binding protein,MTBP)和S激酶相关蛋白2(S-phase kinaseassociated protein 2,SKP2)等,这些基因主要参与了对细胞周期的精细调控。Richardson等[15]研究表明,在体外培养的细胞中,NASP的蛋白表达水平在S期显著增加,但是在G2期却又下降,其变化的同时还伴随mRNA表达的变化。NASP是组蛋白连接蛋白,在细胞分裂周期中具有重要的作用,参与组蛋白的核膜转运功能,将组蛋白快速有效地运至细胞核内,加快细胞有丝分裂进程。本研究发现,剪切应力作用60 min后,MG-63细胞内NASP的基因表达水平下调,这种变化的生物学意义值得我们在下一步的实验中进行深入研究。
Agarwal等[16]的研究表明,MTBP在细胞有丝分裂和染色体分离过程中有着十分重要的作用,其过表达可延缓细胞有丝分裂过程,明显延长细胞核膜分解的过程,滞留在有丝分裂前中期和中期相的细胞增多。他们还发现在有丝分裂后期MTBP表达增多还可能导致染色体分离异常,如形成染色体桥、多极染色体等。我们的研究证实,流体剪切应力作用后MTBP的表达显著降低,这有助于细胞的增殖。Hu等[17]在胆囊癌细胞上的研究表明,沉默了SKP2的表达之后,细胞增殖受到了明显的抑制,被阻滞在S期的细胞增多,G2期和M期细胞减少。由此可见SKP2在细胞有丝分裂过程中起着重要作用。本研究发现,流体剪切应力作用后SKP2表达显著增加,其表达增强是否可以促进S期细胞进入G2期还有待进一步的研究。
综上,细胞周期蛋白和细胞周期蛋白依赖性激酶在细胞周期中的作用已有较多的研究,本次实验发现的细胞调控相关基因如NASP、MTBP、SKP2等在力学刺激导致的细胞周期改变中所起作用还有待进一步研究。适当的流体剪切应力可以促进成骨细胞的增殖、分化和矿化[18]。航天飞行所导致的失重性骨质丢失和临床上常见的废用性骨质丢失,其发生发展都与骨骼的力学刺激减弱和力学信号调控机制的变化相关。通过本研究,我们观察到流体剪切应力作用后,与细胞周期相关的基因表达谱发生了改变,这为我们开展成骨细胞力学信号的调控机制研究提供了参考靶点,进一步的研究将为开发适当的力学相关骨质丢失防护措施提供参考依据。
1 张兵兵,潘君,王远亮,等.流体剪切力在骨生长、重建中的重要作用[J].医用生物力学,2005,20(2):123-126.
2 Grellier M, Bareille R, Bourget C, et al. Responsiveness of human bone marrow stromal cells to shear stress[J]. J Tissue Eng Regen Med, 2009, 3 (4): 302-309.
3 Kapur S, Baylink DJ, Lau KH. Fluid flow shear stress stimulates human osteoblast proliferation and differentiation through multiple interacting and competing signal transduction pathways[J]. Bone,2003, 32(3): 241-251.
4 李洪鹏,许建中,周强,等.流体剪切应力对人骨髓间充质干细胞增殖及细胞周期的影响[J].第三军医大学学报,2005,27(16):1637-1639.
5 王常德,夏亚一.流体剪切力对成骨细胞影响的研究进展[J].临床骨科杂志,2009,12(3):339-342.
6 张成俊,夏亚一,王常德,等.流体切应力促成骨细胞通过细胞周期G1/S调控点机制的研究[J].中国矫形外科杂志,2009,17(17):1338-1343.
7 孙晓江,戴尅戎,汤亭亭.流体剪切应力对骨细胞分子活动的影响[J].医用生物力学,2007,22(1):109-114.
8 续惠云,瓮媛媛,安龙,等.流体剪切力对骨组织细胞作用的研究进展[J].北京生物医学工程,2010,29(3):318-322.
9 董海涛,盛晓赟,李鹏,等.周期性流体剪切力对成骨细胞增殖影响机制的实验研究[J].中国矫形外科杂志,2012,20(3):255-258.
10 杜挺媛,张舒,曹新生,等.流体剪切应力对模拟微重力下MG-63细胞骨架系统的影响[J].航天医学与医学工程,2012,25(4):235-238.
11 Kang KS, Lee SJ, Lee HS, et al. Effects of combined mechanical stimulation on the proliferation and differentiation of pre-osteoblasts[J]. Exp Mol Med, 2011, 43(6): 367-373.
12 Li Y, Ge C, Long JP, et al. Biomechanical stimulation of osteoblast gene expression requires phosphorylation of the RUNX2 transcription factor[J]. J Bone Miner Res, 2012, 27(6): 1263-1274.
13 Li Y, Luo Y, Huang K, et al. The responses of osteoblasts to fluid shear stress depend on substrate chemistries[J]. Arch Biochem Biophys, 2013, 539(1): 38-50.
14 易静,汤雪明.医学细胞生物学[M]. 1版. 上海:上海科技出版社,2009:348-360.
15 Richardson RT, Batova IN, Widgren EE, et al. Characterization of the histone H1-binding protein, NASP, as a cell cycle-regulated somatic protein[J]. J Biol Chem, 2000, 275(39): 30378-30386.
16 Agarwal N, Tochigi Y, Adhikari AS, et al. MTBP plays a crucial role in mitotic progression and chromosome segregation[J]. Cell Death Differ, 2011, 18(7): 1208-1219.
17 Hu R, Aplin AE. Skp2 regulates G2/M progression in a p53-dependent manner[J]. Mol Biol Cell, 2008, 19(11): 4602-4610.
18 张超,夏亚一.流体剪切力对骨形成及修复的作用[J].国际骨科学杂志,2009,30(5):328-330.
Effect of flow shear stress on the expression of genes related to cell cycle in human osteosarcoma MG-63 cells
ZHANG Lian-chang1, LI Dong-tao1,2, ZHAO Xue-wu1,3, CAO Xin-sheng1, ZHANG Shu1
1Department of Aerospace Biodynamics, The Key Laboratory of Aerospace Medicine, Chinese Ministry of Education, Xi'an 710032, Shaanxi Province, China;2Center of Cardiology, Navy General Hospital, Beijing 100048, China;3Chinese PLA 93175 Hospital, Changchun 130051, Jilin Province, China
ZHANG Shu. Email: shuzhang@fmmu.edu.cn
ObjectiveTo observe the expression changes of genes related to cell cycle after exposing to fluid shear stress (FSS) in human osteosarcoma MG-63 cells.MethodsMG-63 cells were cultured for 72 h, and then they were randomly divided into the fluid shear stress group and the control group. The fluid shear stress group was exposed to 1.5 Pa FSS for 60 min, while the control group was treated with no FSS. Then RNA was extracted from the two groups, and the chip was scanned with Affymetrix gene chip and analyzed for differentially expressed genes.ResultsThe expression of genes related to cell cycle in MG-63 cells was changed. Compared with the control group, 247 genes related to cell cycle showed different expression in the FSS group. Of the 247 genes, 130 genes showed up-regulated (Fold Change>2, P<0.05), while the rest of them showed down-regulated (Fold Change<-2, P<0.05). These differential genes participated in many cell biological progresses, such as cell cycle process, cell cycle arrest, negative regulation of mitotic cell cycle, G1/S transition of mitotic cell cycle, interphase of mitotic cell cycle.ConclusionFSS can stimulate the proliferation and differentiation of MG-63 cells via regulating the expression of genes related to cell cycle.
shear stress; gene chip; MG-63; cell cycle
R 852.22
A
2095-5227(2014)11-1137-04
10.3969/j.issn.2095-5227.2014.11.016
时间:2014-08-08 09:32 网络出版地址:http://www.cnki.net/kcms/detail/11.3275.R.20140808.0932.002.html
2014-05-08
国家自然科学基金项目(31170889;30870595);教育部留学回国启动基金(HG4406)
Supported by the National Natural Science Foundation of China(31170889; 30870595); The Project-sponsored by SRF for ROCS, SEM(HG4406)
张连昌,男,在读硕士。研究方向:航空航天医学。Email: zhanglian_chang@163.com
张舒,男,博士,教授,博士生导师。Email: shuzhang @fmmu.edu.cn

