硝态氮对Nannochloropsis oculata生长及合成胞内组分的影响
巩 波,袁 军,陈金花,李昌灵,夏小乐,杨海麟
(江南大学教育部工业微生物技术重点实验室,江苏无锡 214122)
微绿球藻属(Nannochloropsis)是一种海洋单细胞微藻,属于褐藻门真眼点藻纲,藻细胞呈球形或卵圆形,直径2~4μm[1]。微绿球藻最突出的特点是生长快、耐受性好、富含不饱和脂肪酸特别是二十碳五烯酸(EPA),具有很高的营养价值和保健功能。此外,由于微绿球藻具有较高的光合效率,能够吸收CO2生成油脂和高附加值EPA等优良特性,逐渐成为可持续生物质资源开发的热点[2]。藻细胞的生长、油脂含量及脂肪酸组成与外界营养条件密切相关,并且在营养限制条件下油脂蛋白等胞内组分的合成差异显著[3]。其中氮源是构成生物体的蛋白质、核酸及其他氮素化合物的材料,与细胞生长、胞内组分合成密切相关[4]。Illman 等[5]报道在氮限制条件下,C.emersonii、C.minutissima、C.vulgaris及C.pyrenoidosa能够积累的最高油脂量分别达到细胞干重的63%、57%、40%和23%。梁英等认为不同的氮源和不同的氮浓度对微藻的脂肪酸组成影响显著[6]。Recht等[7]研究结果表明H.Pluvialis油脂积累过程中碳水化合物含量逐渐升高至63%,之后开始下降,而Nannochloropsissp.在此过程中碳水化合物始终稳定在18%左右。本文以硝酸钠为氮源,通过考察不同氮浓度下Nannochloropsis oculataC170生长、氮消耗及油脂含量变化,并在此基础上结合透射电子显微镜等技术手段,分析氮限制条件下油脂、总糖、蛋白等胞内组分合成差异,以探索硝态氮对细胞生长及胞内组分合成的影响,为微绿球藻生物质资源的开发与利用提供理论依据。
1 材料与方法
1.1 材料与仪器
微绿球藻藻株Nannochloropsis oculataC170 购于中国海洋大学微藻种质库(MACC);培养基 f/2海水培养基[8](单位 mg/L):NaNO375,NaH2PO4·2H2O 5.65;微量元素:Na2EDTA 4.16,FeCl3·6H2O 3.15,ZnSO4·7H2O 0.022,CuSO4·5H2O 0.01,MnCl2·4H2O 0.18,Na2MoO4·2H2O 0.006,CoCl2·6H2O 0.01;维生素浓缩液:Vitamin B120.0005,Vitamin B10.1,Biotin 0.0005;Nile red Sigma-Aldrich 公司;环氧树脂Epon812、锇酸 美国Ted Pella公司;其余分析用药品为分析纯 上海国药集团。
YXQ-LS-50S1型立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;ZHWY200B型摇床 上海智城分析仪器制造有限公司;DHP-2000型电热恒温培养箱 天津市华北实验有限公司;分析天平 梅特勒-托利多仪器有限公司;U3900紫外分光光度计 日立公司;F-4600荧光分光光度计 日立公司;GC-2010气象色谱仪 日本岛津;JEM-2100透射电子显微镜 日本JEOL公司。
1.2 实验方法
1.2.1 氮浓度实验 取适量活化藻种接种于含有f/2培养基的100mL三角瓶中,置于恒温光照摇床中振荡培养,培养条件为:光照周期为16∶8(光照∶黑暗,h/h),温度为(25 ± 1)℃,pH 为 8.0,光照强度4000lux的培养条件下培养6d。取上述处于对数生长期的微绿球藻种子液,接种于装有400mL新鲜f/2培养基的500mL反应瓶中,以NaNO3作为氮源分别调整其氮浓度为 12.5、22.5、32.5、42.5mg/L,初始接种浓度为(0.072 ± 0.001)g/L,连续通气(气流量为0.1vvm,由底部通入),其余培养条件不变。
1.2.2 氮限制处理 氮浓度设置为2mg/L,初始接种浓度为(0.274 ±0.006)g/L,其余培养条件同 1.2.1。
1.2.3 生物量和生长速率测定 生物量的测定参考Li等[9]方法,用紫外-可见分光光度仪测定688nm波长处各稀释样品的吸光值,同时将对应样品离心洗涤,干燥至恒重后测定藻体干重,建立回归方程:生物量(g/L)=0.1828X-0.009(R2=0.9927)。培养液用灭菌双蒸水进行10倍浓度梯度稀释测定,并根据回归方程计算生物量。生物量产率及比生长速率(μ)根据下式计算:生物量产率(mg/(L·d))=(X2-X1)/(t2-t1),μ =(1nX2-lnX1)/(t2-t1),其中:X1是第一次取样时(t1)的生物量,X2是第二次取样时(t2)的生物量。
1.2.4 氮含量检测 微绿球藻培养液于10000r/min离心5min后,收集上清液用于氮含量测定,氮含量测定采用碱性过硫酸钾消解紫外分光光度法(GB 11894-89,水质总氮的测定)。氮消耗速率和氮利用率根据下式计算:氮消耗速率(mg/(L·d))=(Co-Ct)/t,氮利用率(%)=(Co-Ct)/Co× 100,其中:Co为初始氮浓度,Ct为t时培养液中氮浓度,t为培养时间。
1.2.5 生理参数的测定 叶绿素a含量的测定采用甲醇提取法[10]。蛋白质含量的测定采用凯氏定氮法[11],蛋白质含量(mg/L)= 氮含量(mg/L)× 6.38。总糖含量的测定采用苯酚-硫酸比色法[12]。油脂含量的测定采用修改的 Nile red法[13],油脂含量(μg/mL)=0.0713X+5.9027(r2=0.9923)。
1.2.6 油体及叶绿体透射电镜观察 培养液离心去上清,用 PB 缓冲液(pH7.5)洗涤两次,2.5%(w/v)戊二醛4℃固定2d,充分漂洗后用1%(w/v)锇酸4℃固定2h,用系列酒精、丙酮梯度脱水各30min,然后用Epon812 包埋聚合(35℃ 16h,48℃ 24h,65℃ 48h)。金刚石刀超薄切片后用200目铜网收集。经醋酸铀和柠檬酸铅双重染色后,JEM-2100透射电子显微镜观察[14-15]。
1.2.7 脂肪酸组成分析 总脂的提取按照Bligh和Dyer[16]的方法,将总脂转移到玻璃瓶中,加入 0.5mol/L的NaOH甲醇溶液2mL,充N2后密封于65℃反应1h。冷却后加入25%三氟化硼甲醇溶液2mL,65℃酯化 20min,正己烷萃取后进样分析。色谱柱:CP-WAX(30m × 0.32mm × 0.5um),FID 检测器。程序升温:100℃恒温3min,10℃/min的升温速率升高到180℃,之后3℃/min升高到240℃并保持9min。进样口温度为250℃,检测器温度为250℃。载气N2流速为3mL/min,H2流速为47mL/min,空气流速为400mL/min,分流比为1∶10,进样量 1μL。
1.2.8 数据分析方法 采用origin软件进行统计分析,每个实验重复3次,实验所得值为平均值加上标准偏差。
2 结果与讨论
2.1 硝态氮浓度对微绿球藻生长的影响
以NaNO3为氮源,不同氮浓度下N.oculataC170生长情况如图1和图2所示。在42.5mg/L氮浓度培养基中藻细胞生长最佳,第5d开始生物量快速上升并明显高于其他实验组。培养至11d,其生物量、比生长速率及产率均最高,分别为 0.59g/L、0.275d-1和50.98mg/(L·d)。图1 同时显示在 0~2d 内,藻细胞生长缓慢。第2d开始进入对数生长期,藻细胞快速增殖,生物量呈现快速上升趋势。随着氮浓度的升高,N.oculataC170最高生物量显著增加,高浓度硝态氮明显有利于细胞生长。

图1 不同氮浓度下N.oculata C170的生长曲线Fig.1 The growth curves of N.oculata C170 under different nitrogen concentrations
根据图2可知,N.oculataC170培养11d后,其生物量产率和比生长速率随着氮浓度的升高而增加,氮浓度为12.5mg/L时,藻细胞生长受限,其比生长速率和生物量产率最低,分别为0.244d-1和36.43mg/(L·d),显著低于其他实验组。此种现象主要是由于氮源不足时,光合相关色素及酶系合成受到抑制,光合作用严重受阻,藻细胞生长缓慢导致生物量和产率下降。氮源充足时,藻细胞可以合成大量叶绿素,PSⅡ处于高活性状态具有较高的光合效率,细胞生长迅速其生物量和产率显著增加[17-18]。

图2 不同氮浓度下N.oculata C170生物量产率和比生长速率Fig.2 Productivity and specific growth rate of N.oculata C170 under different nitrogen concentrations
2.2 硝态氮消耗与利用率
N.oculataC170培养在不同氮浓度条件下,硝态氮的消耗情况和利用效果显著不同,结果见图3和图4。在0~2d内,藻细胞仍处于迟缓期导致氮的利用较为缓慢,之后藻细胞进入快速增殖期,氮的利用速度逐渐加快。随着藻细胞浓度的升高,氮含量在不断的降低(图3)。
不同浓度下的N.oculataC170培养至11d时对氮的利用效果如图4所示。氮浓度为12.5mg/L时,氮源在第4d基本耗尽,至培养结束其氮利用率最好(接近100%),而氮消耗速率为各实验组最低,仅为2.07mg/(L·d)。氮浓度高于 22.5mg/L 时,藻细胞生长繁殖迅速,氮消耗速率不断升高,同时培养液中残留氮浓度不断升高,导致藻细胞对氮的利用率不断降低。在42.5mg/L氮浓度下,其氮消耗速率最高,为2.71mg/(L·d),但此时氮含量远远超过了藻细胞生长所需量,氮利用率为各实验组最低,仅为69.95%。
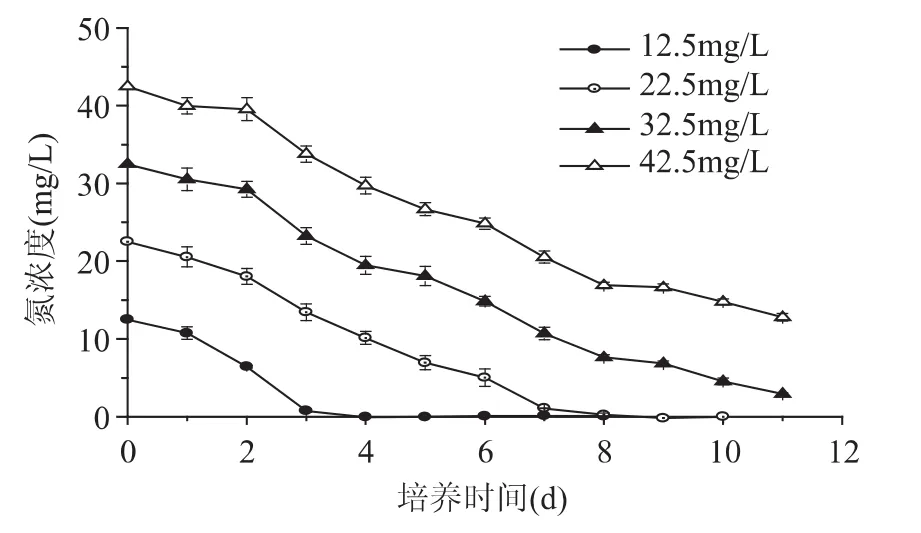
图3 不同氮浓度下N.oculata C170氮消耗曲线Fig.3 Nitrogen consumption curves of N.oculata C170 under different nitrogen concentrations

图4 不同氮浓度下N.oculata C170对氮的利用效果Fig.4 Results of consumption of nitrogen by N.oculata C170 under different nitrogen concentrations
2.3 硝态氮浓度对胞内油脂含量的影响
在不同硝态氮浓度下,N.oculataC170经培养11d后,其油脂合成差异显著(图5)。在12.5mg/L氮浓度时,胞内油脂含量和产率明显最高,分别为29.17%和 11.40mg/(L·d)。随着氮浓度的升高,油脂含量迅速下降,在32.5mg/L氮浓度时,油脂含量仅为 8.74%,其油脂产率则下降到 4.29mg/(L·d)。氮浓度进一步增大到42.5mg/L时,油脂含量及产率基本与32.5mg/L处理组一致。对比发现,12.5mg/L氮浓度下藻细胞油脂含量是42.5mg/L处理组的3.4倍,原因可能是在12.5mg/L氮浓度时,培养液中氮含量无法满足细胞生长所需,氮源耗尽后导致藻细胞的增殖能力下降,促使细胞调整代谢流向合成含氮较少的脂类化合物作为储藏能源物质,从而具有较高的油脂含量[19-20]。

图5 不同氮浓度下N.oculata C170油脂含量和油脂产率Fig.5 Content and productivity of lipid of N.oculata C170 under different nitrogen concentrations
2.4 硝态氮浓度对脂肪酸组成的影响
考察了不同硝态氮浓度下N.oculataC170脂肪酸组成差异,培养11d后各实验组脂肪酸组成如表1所示。结果表明,棕榈酸(C16∶0)、棕榈油酸(C16∶1)、油酸(C18∶1)及 EPA(C20∶5)始终是N.oculataC170的主要脂肪酸。随着培养基中氮浓度的增加,棕榈油酸、油酸的比例显著下降,分别下降了25%和74%左右。相反多不饱和脂肪酸(PUFA)的比例显著增加,由 14.07%升高至 28.43%,其中EPA 含量由 8.06% 升高到 18.76%,为最初的 2.32倍。氮浓度为42.5mg/L时,藻细胞EPA和PUFA含量最高。这很可能是由于氮浓度的增加导致合成多不饱和脂肪酸所需的蛋白酶系浓度上升,进而提高了多不饱和脂肪酸的比例。

表1 不同氮浓度下N.oculata C170脂肪酸组成(%总脂肪酸)Table 1 The fatty acid composition of N.oculata C170 under different nitrogen concentrations(%total fatty acid)
2.5 氮限制处理与胞内组分合成
为进一步研究硝态氮对N.oculataC170胞内组分合成的影响,以2mg/L氮浓度作为氮限制处理,考察了生物量、pH、叶绿素a含量以及油脂、总糖等细胞组分的变化规律,结果如图6和图7。培养6d时,藻细胞生物量缓慢增加,由0.27g/L逐渐升高到0.34g/L,表明细胞分裂仍可以缓慢进行。在此过程中,pH首先呈现上升趋势,第4d达到最高值9.59,之后略有下降。而叶绿素a含量从10.4mg/g快速升高到 21.34mg/g,随后下降到 7.29mg/g,下降了 29% 左右,表明在培养后期胞内色素合成严重受阻。Li等[21]推测在低氮浓度下,氮源被藻细胞快速耗尽,结果是光源穿透性较好细胞被暴露于大量的光源下,腺苷一磷酸(AMP)脱氨酶活性增加,AMP脱氨酶将AMP大量转化为肌苷一磷酸(IMP)和氨。细胞利用此种内源性氮源维持色素供给、细胞分裂增殖等生命活动。随着氮的持续消耗,PSⅡ氧化端受到损失,抑制了光合作用原初反应的进行,细胞色素含量下降,分裂增殖逐渐停滞[22-23]。
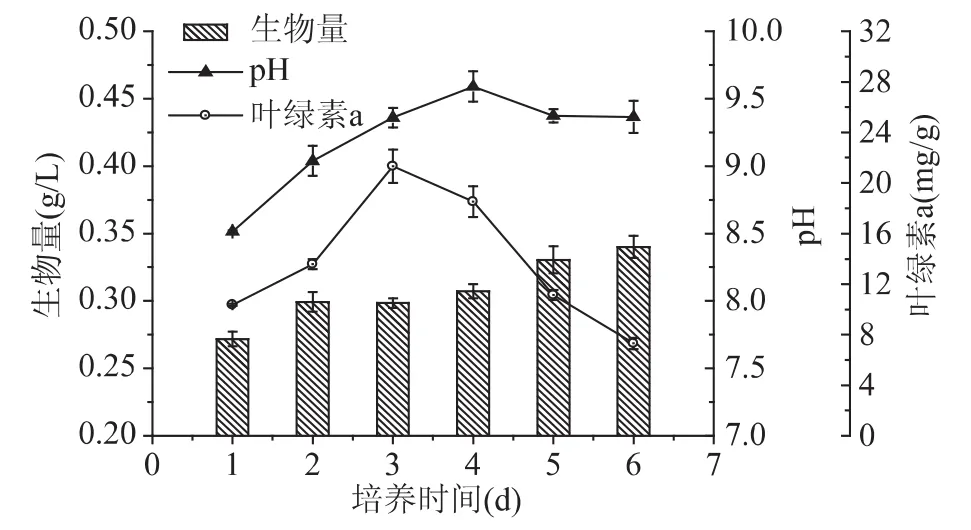
图6 N.oculata C170氮限制下生物量、pH及叶绿素a变化Fig.6 Variation of growth,pH and chl a of N.oculata C170 under nitrogen-limiting conditions

图7 微绿球藻C170缺氮条件下的细胞组分变化Fig.7 Variation of cellular compositions of N.oculata C170 under nitrogen-limiting conditions
另一方面,氮限制条件下胞内组分随着培养时间的延长差异显著(图6)。在培养6d过程中,油脂与总糖含量都呈现上升趋势,油脂含量最高达到23.07%,为最初含量的 2.8 倍。总糖则从 12.45% 逐渐升高至22.01%,含量升高了76%左右。而胞内蛋白含量与油脂变化趋势相反,在1~3d内基本稳定在41%左右,之后明显下降,第6d时蛋白含量下降至31.31%,下降了 24% 左右。Kawata 等[24]认为微藻光合作用所固定的碳进入磷酸已糖库后,一方面以淀粉形式储存在叶绿体内,另一方面,还可通过糖酵解途径生成丙酮酸作为合成脂肪酸的前体。由于氮源不足时,蛋白质和叶绿素等含氮元素较多的物质合成受到限制,导致藻细胞蛋白与氨基酸严重下降,而二氧化碳的同化作用仍部分进行,导致碳代谢流向碳水化合物或者脂质,积累大量糖类或油脂[25-26]。
2.6 氮限制条件下藻细胞油体与叶绿体变化
N.oculataC170在氮限制培养时,其胞内油体与叶绿体结构变化如图8所示,接种第2d时,藻细胞仍可以利用培养液中微量氮源生长繁殖,胞内叶绿体占细胞比例较大且类囊体片层结构紧密相连(图8A)。培养到第4d时,藻细胞开始衰败,叶绿体明显松散,类囊体片状结构清晰可见,叶绿体所占比例明显下降(图8B),这与上述叶绿素含量降低的结果相一致。培养到第6d时,由于细胞液及液泡的变化,叶绿体被压缩到较小区域,并且此时藻细胞内可见明显脂肪体(图8C)。

图8 氮限制处理对N.oculata C170油体和叶绿体的影响(25000倍)Fig.8 TEM photos of cellular lipid body and chloroplast from N.oculata C170 under nitrogen-limiting conditions(25000×)
3 结论
N.oculataC170 在 42.5mg/L 氮浓度培养基中生长最佳,其生物量、比生长速率及产率均最高,分别为 0.59g/L、0.275d-1和 50.98mg/(L·d),此时氮消耗速率高达 2.71mg/(L·d),而氮利用率最低,仅为69.95%。氮浓度为12.5mg/L时,藻细胞内油脂含量和产率明显最高,分别为 29.17% 和 11.40mg/(L·d)。随着氮浓度的升高,多不饱和脂肪酸比例显著增加,氮浓度为42.5mg/L时,藻细胞EPA和PUFA含量最高,分别为 18.76%和 28.43%,EPA 含量为最初的 2.32 倍。
在限氮处理时,藻细胞生物量缓慢增加,叶绿素a含量下降了29%左右。同时油脂含量逐渐升高至23.07%,为最初含量的2.8倍。总糖含量则逐渐升高至22.01%,提高了76%左右而蛋白含量下降了24%左右。透射电镜下藻细胞内可见叶绿体结构松散且比例下降,并可观察到明显油体积累。本研究表明,高浓度硝态氮有利于N.oculataC170细胞生长及胞内EPA积累,低浓度硝态氮诱导油脂积累并与糖类合成、色素和蛋白降解相关联。提高硝态氮浓度可用于N.oculataC170中EPA的生产,而通过氮限制或代谢工程等手段抑制糖类积累或控制蛋白微量分解则可以促进油脂积累。
[1]Hibberd DJ.Notes on taxonomy and nomenclature of the algal classes Eustigmatophyceae and Tribophyceae (synonym Xanthophyceae)[J].Bot J Linn Soc,1981,82:93-119.
[2]Rocha J,Garcia J E C,Henriques M H F.Growth aspects of the marine microalgaNannochloropsis gaditana[J].Biomolecular engineering,2003,20(4):237-242.
[3]Dunahay T,Benemann J,Roessler P.A look back at the US Department of Energy′s Aquatic Species Program:Biodiesel from algae[M].Golden:National Renewable Energy Laboratory,1998.
[4]Shifrin N S,Chisholm S W.Phytoplankton lipids:interspecific differences and effects of nitrate,silicate and light-dark cycles1[J].Journal of phycology,1981,17(4):374-384.
[5]Illman A M,Scragg A H,Shales S W.Increase in Chlorella strains calorific values when grown in low nitrogen medium[J].Enzyme and Microbial Technology,2000,27(8):631-635.
[6]梁英,麦康森,孙世春,等.不同培养基对筒柱藻Cylindrotheca fusiformis生长及脂肪酸组成的影响[J].海洋湖沼通报,2000,1:60-67.
[7]Recht L,Zarka A,Boussiba S.Patterns of carbohydrate and fatty acid changes under nitrogen starvation in the microalgaeHaematococcus pluvialisandNannochloropsissp.[J].Applied Microbiology and Biotechnology,2012,94(6):1495-1503.
[8]Guillard R R L,Ryther J H.Studies of marine planktonic diatoms:i.Cyclotella nanaHustedt,andDetonula confervacea(Cleve)Gran[J].Canadian Journal of Microbiology,1962,8(2):229-239.
[9]Li C,Yang H,Xia X,et al.High Efficient Treatment of Citric Acid EffluentbyChlorellavulgarisand PotentialBiomass Utilization[J].Bioresource Technology,2013,127:248-255.
[10]Ritchie R J.Consistent sets of spectrophotometric chlorophyll equations for acetone,methanol and ethanol solvents[J].Photosynthesis Research,2006,89(1):27-41.
[11]Lynch JM,Barbano DM.Kjeldahl nitrogen analysis as a reference method for protein determination in dairy products[J].Journal-aoac international,1999,82:1389-1398.
[12] Hodge J E.Determination ofreducing sugarsand carbohydrates[J].Methods in Carbohydrate Chemistry,1962,1:380-394.
[13]Doan T T Y,Obbard J P.Improved Nile Red staining ofNannochloropsissp.[J].Journal of Applied Phycology,2011,23(5):895-901.
[14]刘金丽,王俊峰,刘天中,等.缺氮条件对栅藻油脂积累与光合作用的影响[J].海洋科学,2013,37(7):13.
[15]Simionato D,Block M A,La Rocca N,et al.The Response ofNannochloropsis gaditanato Nitrogen Starvation Includes De Novo Biosynthesis ofTriacylglycerols,a Decrease ofChloroplast Galactolipids,and Reorganization of the Photosynthetic Apparatus[J].Eukaryotic cell,2013,12(5):665-676.
[16]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[17]Hak R,Rinderle- Zimmer U,Lichtenthaler H K,et al.Chlorophyll a fluorescence signatures of nitrogen deficient barley leaves[J].Photosynthetica,1993,28(1):151-159.
[18]Pruvost J,Van Vooren G,Le Gouic B,et al.Systematic investigation of biomass and lipid productivity by microalgae in photobioreactorsforbiodieselapplication[J].Bioresource Technology,2011,102(1):150-158.
[19]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.
[20]Guerrini F,Cangini M,Boni L,et al.Metabolic responses of the diatomAchnanthes brevipes(Bacillariophyceae)to nutrient limitation[J].Journal of Phycology,2000,36(5):882-890.
[21]Li Y,Horsman M,Wang B,et al.Effects of nitrogen sources on cell growth and lipid accumulation of green algaNeochlorisoleoabundans[J].Applied Microbiology and Biotechnology,2008,81(4):629-636.
[22]Latasa M,Berdalet E.Effect of nitrogen or phosphorus starvation on pigment composition of cultured Heterocapsa sp[J].Journal of Plankton Research,1994,16(1):83-94.
[23]Geider RG,Roche JL,Greene RM,et al.Response of the photosynthetic apparatus ofPhaeodactylum triconutumto nitrate,phosphate,oriron stavation[J].Journal of Phycology,1993,29(6):755-766.
[24]Kawata M,Nanba M,Matsukawa R,et al.Isolation and characterization of a green algaNeochlorissp.for CO2fixation[J].Studies in Surface Science and Catalysis,1998,114:637-640.
[25]胡章喜,安时,段舜山,等.不同氮源对布朗葡萄藻生长、总脂和总烃含量的影响[J].生态学报,2009,29(6):3288-3294.
[26]M S.Metabolic response of the halotolerant green algaDunaliella bardawilto nitrogen:Phosphorus ratios in batch culture[J].Folia Microbiologica,1997,42(4):357-360.

