华支睾吸虫膜抗原/排泄分泌抗原酸性磷酸酶的克隆、表达、生物学特征分析及组织定位*
郑明慧, 胡坤华, 张 彤, 刘 炜, 余新炳
(1中山大学孙逸仙纪念医院检验科,广东 广州 510120;中山大学中山医学院 2热带病防治重点实验室,病原生物学教研室, 3药理学教研室,广东 广州 510080; 4中山大学第三附属医院广东省肝病重点实验室,广东 广州 510630)
华支睾吸虫(Clonorchissinensis,C.sinensis,Cs)也称肝吸虫,广泛分布于亚洲地区,包括中国、韩国、朝鲜、日本及东南亚等,可引起宿主的胆石症、胆管炎、肝纤维化、肝硬化及肝胆管癌等,是一种重要的食源性寄生虫病[1]。
寄生虫的排泄分泌产物(excretory-secretory pro-ducts,ESP)参与寄生虫与宿主的相互作用[2], 具有重大的临床诊断意义和临床病理意义。 ESP 在华支睾吸虫幼虫移行至肝胆管致肝胆管癌方面起重要作用[3]。寄生虫的排泄分泌抗原(excretory-secretory antigens, ESA)是虫体与宿主密切接触的媒介之一,其释放到虫体外寄生部位与宿主细胞如肝星状细胞、胆管上皮细胞甚至肝细胞直接接触而引起一系列的生物效应,虫体及其分泌排泄成分可造成胆石症、肝胆管炎、肝纤维化、肝硬化及肝癌等[1]。
寄生虫的膜抗原:吸虫具有相同的皮层结构, 最外一层是没有细胞间隔的合胞体, 皮层表膜是合胞体细胞膜, 是虫体与外界环境进行物质交换的一个重要界面, 许多营养物质的摄取和胞内代谢终产物和其它有毒物质的排出需要通过表膜上的协助因子来完成[4]。
酸性磷酸酶(acid phosphatase, AP)分布很广, 从低等生物大肠杆菌、酵母到高等动植物组织、体液以及人类肝脏、前列腺都存在[5]。AP参与磷酸酯代谢、代谢调节、能量转换以及信号转导等[6]。
那么, 华支睾吸虫酸性磷酸酶具有哪些生物学特征,其在虫体代谢及致病中起什么作用,其是否为华支睾吸虫膜抗原/排泄分泌抗原,目前尚缺乏充分研究。
本研究目的是对华支睾吸虫膜抗原/排泄分泌抗原酸性磷酸酶基因进行克隆、表达、生物学特征分析及组织定位。
材 料 和 方 法
1 CsAP生物信息学分析
从华支睾吸虫成虫cDNA质粒文库中寻找C.sinensisESA酸性磷酸酶(CsAP)全长序列。以生物信息学进行全长分析(Vector NTI Suite 8.0)、理化性质分析、信号肽分析及跨膜结构预测。
2 CsAP克隆、表达和纯化
CsAP序列的编码区(不包含信号肽)以上游引物(5’-AAA GAT ATC GGG GCG ACC AAC GTT CT-3’)及下游引物(5’-GGG AAG CTT TTA AAA TGT GGG GTT CAG TTG-3’)进行PCR扩增,扩增条件为:95 ℃ 1 min, 58 ℃ 1 min, 72 ℃ 80 s, 35 个循环 (TaKaRa),以EcoR Ⅴ 及HindⅢ双酶切并纯化后,重组入带有6×His-tag的 pET-30a 表达载体 (Novagen),以1 mmol/L IPTG于37 ℃、4 h诱导表达 (包涵体形式表达)。8 000×g、4 ℃离心10 min,收集菌体,以SDS-PAGE分离并收集重组融合蛋白,以铜染试剂盒(Bio-Rad)染色,切割目的蛋白条带并进行电洗脱[7-8],亲和层析纯化后 (Novagen),PBS (pH 7.4)透析浓缩后Bradford定量分析[9],行SDS-PAGE及Western blotting分析其完整性。
3 C. sinensis 排泄分泌抗原、粗抗原及膜蛋白的制备及GST标签蛋白的纯化
将活动良好的、完整的华支睾吸虫成虫以DMEM (Gibco)于37 ℃、5% CO2无菌培养3 h,收集培养液上清为分泌排泄抗原,透析浓缩后-80 ℃保存备用[10]。C.sinensis成虫以PBS匀浆,10 000×g、4 ℃离心15 min, 收集上清为粗抗原,-80 ℃保存备用。以膜蛋白提取试剂盒(Calbiochem)提取C.sinensis成虫膜蛋白-80 ℃保存备用。
pGEX-4T-1质粒转化入感受态细胞DH5α并进行培养扩增其拷贝数, 提取质粒转化入BL21(DE3)以IPTG 诱导标签蛋白表达,以GST-bind纯化试剂盒 (Novagen)进行标签蛋白纯化, PBS中进行透析, 视情况进行浓缩,存于-20 ℃备用。
4 抗血清制备
CsAP (每只200 μg)与等体积福氏完全佐剂混匀,给SD大鼠皮下多点注射免疫,间隔2周进行第2次加强免疫(每只100 μg,加等体积不完全福氏佐剂);再间隔2周用上述方法进行1次加强免疫。末次免疫后2周大鼠眼球采血,分离血清,ELISA法测抗体效价后保存于-80 ℃备用。抗CsESA血清制备方法同上。
5 Western blotting分析
SDS-PAGE (15%)分析CsAP及CsESA, 电转移至PVDF膜(Qbiogene),以CsAP及CsESA抗血清、感染C.sinensis大鼠血清及正常大鼠血清分别进行免疫印迹识别;同上述方法,以CsAP抗血清、感染C.sinensis大鼠血清及正常大鼠血清分别进行免疫印迹识别C.sinensis膜蛋白;6×His单克隆抗体 (Boster Co.) 分别进行免疫印迹识别CsAP及含有pET30a 的BL21;然后,以HRP标记的兔抗大鼠或兔抗小鼠IgG (Boster Co.)作为Ⅱ抗,以二氨基联苯胺为底物显色。
6 CsAP于 C. sinensis 各发育阶段免疫组化定位
将从感染华支睾吸虫动物体内分离的成虫及囊蚴固定后制作石蜡切片,尾蚴、雷蚴活体以丙酮固定。脱蜡后的石蜡切片和活体玻片以自发荧光淬灭剂(Applygen)处理,PBS-T清洗后,以10% BSA 的PBS 4 ℃封闭过夜。PBS-T清洗后,以CsAP的抗血清孵育室温1h, 同样方法以大鼠免疫前血清为对照。PBS-T清洗后,以FITC标记的Ⅱ抗goat anti-rat IgG (1∶400) (Invitrogen)室温孵育30 min。PBS-T清洗后,荧光显微镜拍照(Olympus IX61)。
7 健康及C. sinensis感染、日本血吸虫(Schistosoma japonicum, S.japonicum, Sj)感染人血清
73份感染C.sinensis、50份感染S.japonicum病人血清及35份健康人血清检测诊断抗原特异性;以CsAP分别检测不同虫荷的C.sinensis病人血清(EPG<1 000 14份、EPG 1 001~5 000 50 份、EPG 5 001~10 000 18 份病人血清)和35份健康人血清检测诊断抗原敏感性。
8 明胶酶谱法分析CsAP降解胶原能力
(1)调整CsAP、CsMAP-2(作为重组蛋白对照)、牛血清白蛋白和GST (作为对照)蛋白浓度调整使所上蛋白总量一致。与4×上样缓冲液(4% SDS,0.25 mmol/L Tris-HCl,40% 甘油,0.1% 溴酚蓝)按照1∶3混合。(2)配制分离胶和浓缩胶,4 ℃进行SDS-PAGE 100 v 恒压跑至分离胶和浓缩胶交界处改为90 mA恒流,直至溴酚蓝跑出胶外。(3)凝胶置于洗脱液(2.5% Triton X-100,50 mmol/L Tris -HCl,5 mmol/L CaCl2,1 μmol/L ZnCl2,pH 7.6) 中振荡洗脱2次,每次45 min, 然后用漂洗液(除不含Triton X- 100 外其余同洗脱液) 漂洗2次,每次20 min, 接着,将凝胶置于孵育液(50 mmol/L Tris-HCl, 5 mmol/L CaCl2, 1 μmol/L ZnCl2, 0.02% Brij-35, pH 7.6) 中37 ℃ 孵育42 h。(4)染色液(0.05% 考马斯亮蓝、30%甲醇、10%乙酸) 染色3 h,及脱色液A、B、C(甲醇浓度分别为30%、20%和10%,乙酸浓度分别为10%、10%和5%) 分别脱色后,显示位于蓝色背景上的透亮带,用凝胶图像分析系统拍照分析。
9 ELISA
包被缓冲液(0.05 mol/L碳酸盐缓冲液, pH 9.6)将CsAP稀释至10 mg/L,0.1 mL/well于96孔酶标板,4 ℃过夜。次日用PBS-Tween 20(PBS溶液中含0.05% Tween 20,PBS-T)洗涤3次,每次5 min。5%脱脂奶粉37 ℃、2 h封闭,PBS-T洗涤后加1∶200稀释的待检样品0.1 mL于包被反应孔中,37 ℃孵育2 h。另设空白、阴性对照。PBS-T洗涤3次后,每孔加入1∶20 000 HRP标记的兔抗大鼠IgG,37 ℃孵育1 h。洗涤后,每孔加入TMB溶液(BD Biosciences),显色5~10 min。每孔0.05 mL中加入2 mol/L硫酸。全自动酶标仪检测仪(Labsystems Dragon, Multiskan MK3)于450 nm测A值。Cut-off 值=正常人血清A值均值+2倍标准差。
10 统计学处理
用SPSS 14.0软件进行统计分析。数据使用均数±标准差(mean±SD)表示,组间比较采用t检验方法,以P<0.05为差别有统计学意义。
结 果
1 CsAP生物信息学分析
CsAP全长1 816 bp,编码区为68~1 477,在5’端和3’端都有非翻译区,该基因为全长基因。CsAP的ORF共有1 410 bp,编码470个氨基酸,预测分子量为55.3 kD, 第1~27位氨基酸为分泌信号肽序列。其跨膜区包括第6~29位氨基酸由内向外的跨膜区和第426~450位氨基酸由外向内的跨膜区,见图1。
2 CsAP在大肠杆菌BL21 E. coli表达与纯化
成功构建于pET-30a原核质粒,于BL21E.coli表达,CsAP菌体沉淀中有目的条带表达,包涵体经洗涤后,以SDS-PAGE分离,以铜染试剂盒染色,切割目的蛋白条带并进行电洗脱,亲和层析纯化后得到分子量为55.3 kD的目的条带,见图2A。
3 CsAP重组蛋白Western blotting分析
CsAP蛋白分子量均与理论分子量相符,可被His单抗识别及其抗血清识别其单体及二聚体,并可被抗CsESA及抗CsAP的多克隆抗体分别识别其单体及二聚体;CsESA可被抗CsESA的多克隆抗体识别, 并可被抗CsAP的多克隆抗体识别其单体及二聚体[11],见图2B。
C.sinensis成虫膜蛋白可被C.sinensis感染大鼠血清识别,识别抗CsAP的多克隆抗体识别; 与跨膜结构预测结果一致,见图2C。

Figure 1. Bioinformatics analysis of CsAP. Nucleotide sequence and the deduced amino acid squence of the CsAP cDNA. The location of the N-terminal signal sequence was underlined. And the locations of transmembrane domains were framed.
4 免疫荧光分析CsAP重组蛋白在C. sinensis的组织定位和发育时期定位
免疫组织化学定位显示CsAP荧光显示于成虫的表皮层和肠支,在囊蚴也有显示,在雷蚴和尾蚴未显示荧光,CsMAP-2(作为重组蛋白对照)可定位于雷蚴,在尾蚴未显示定位,见图3。CsAP组织定位于成虫的表皮层,与生物信息学预测膜蛋白结果一致。

Figure 2. Cloning, expression and identification of recombinant CsAP. A: expression and purification of CsAP; B: identification and antigenicity of recombinant CsAP; C: transmembrane domains prediction by TMpred (left) and identification by Western blotting (right) for CsAP.
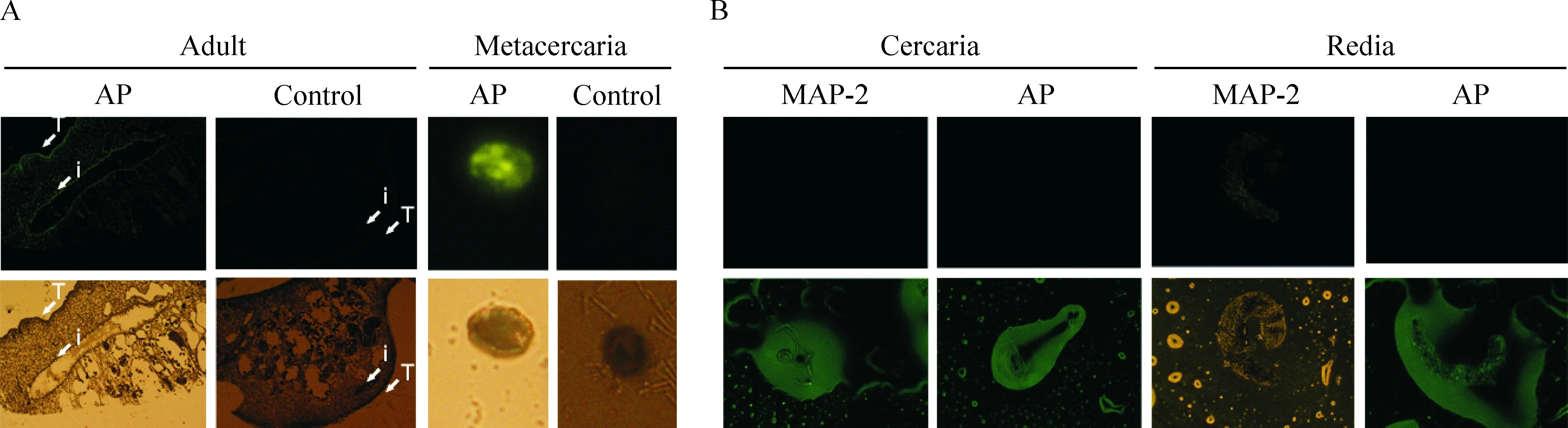
Figure 3. Immunohistochemistry staining of CsAP localization.A: immunofluorescence for CsAP localization in C. sinensis adult (×100) and metacercaria (×200). i: intestine; T: tegument and tegumentary cells. B: immunofluorescence for CsAP localization in C. sinensis cercaria and redia (×100).
5 CsAP对胶原的降解作用
CsAP 在其分子量相应位置显示清晰的胶原降解负染条带,而对照重组蛋白(包涵体复性)CsMAP-2未显示明显的胶原降解负染条带,表明CsAP包涵体复性较为成功,见图4。

Figure 4. Gelatin zymography assay of CsAP.A: SDS-PAGE identification of CsMAP-2(recombinant protein as control), CsAP and the controls (BSA and GST); B: collagen-containing native PAGE identification of the collagen degradation effect of CsMAP-2(recombinant protein control), CsAP and the controls (BSA and GST).
6 CsAP重组蛋白ELISA分析
ELISA分析表明CsAP识别华支睾吸虫病人和日本血吸虫病人存在交叉免疫识别(P>0.05);CsAP及粗抗原识别轻、中、重度感染程度的华支睾吸虫病人的差别不明显(P>0.05)。CsAP总IgG抗体滴度于3周达高峰,抗体效价均大于1∶25 600,见图5。

Figure 5. ELISA analysis of CsAP. A: immunoreactivity of the recombinant CsAP and the crude antigens against serum samples from patients infected with C.sinensis (Cs) and S.japonicum (Sj), and healthy persons (control); B: immunoreactivity of the recombinant CsAP against serum samples from different fluke burden patients infected with C.sinensis; C: antibody development curves of IgG antibody of CsAP.
讨 论
在本研究中,重组、表达、纯化了一个属于组氨酸酸性磷酸酶家族的CsAP,生物信息学预测其具有跨膜结构域及信号肽,故推测其为膜抗原及分泌排泄抗原。
生物信息学分析跨膜蛋白预测、膜蛋白免疫印迹分析表明,CsAP是虫体膜抗原及ESA的成分之一。其组织定位于虫体表膜及肠支,表膜是虫体与外界沟通的重要媒介,其交叉免疫反应广泛存在于蠕虫间,故不是华支睾吸虫病的特异性诊断抗原;而肠支是虫体分泌排泄的重要途径,可能参与华支睾吸虫致肝纤维化的过程[1]。同时,免疫组化分析表明,CsAP在囊蚴也有显示,在雷蚴和尾蚴未显示荧光,推测其可能选择性表达于成虫及囊蚴阶段,有利于其对宿主的免疫逃避[12]。
AP存在于细胞溶酶体中,其活性在正常情况下相当稳定,当受到不良因素影响时,其活性增强,一方面吞噬消化变性坏死结构, 另一方面水解正常细胞结构,加速细胞变性坏死过程[13],肝细胞受损时,此酶活性增高,可降解成纤维细胞产生的胶原[14-15]。本研究中的胶原降解实验也证实了CsAP的降解能力。
综上所述,本研究克隆、表达了华支睾吸虫的酸性磷酸酶基因,并对其分子生物学特征、组织定位进行了分析,为进一步探讨华支睾吸虫膜抗原/分泌排泄抗原酸性磷酸酶的功能及诊断价值奠定了基础。我们将通过体内、外实验进一步证实其与华支睾吸虫病肝纤维化之间的关系及其作用机制。
[参 考 文 献]
[1] Lun ZR, Gasser RB, Lai DH, et al. Clonorchiasis: a key foodborne zoonosis in China[J]. Lancet Infect Dis, 2005,5(1):31-41.
[2] Nagano I, Wu Z, Takahashi Y. Functional genes and proteins ofTrichinellaspp.[J]. Parasitol Res, 2009,104(2):197-207.
[3] Kim YJ, Choi MH, Hong ST, et al. Resistance of cholangiocarcinoma cells to parthenolide-induced apoptosis by the excretory-secretory products ofClonorchissinensis[J]. Parasitol Res, 2009,104(5):1011-1016.
[4] Liu F, Lu J, Hu W, et al. New perspectives on host-parasite interplay by comparative transcriptomic and proteomic analyses ofSchistosomajaponicum[J]. PLoS Pathog, 2006,2(4):e29.
[5] von Hofsten B, Porath J. Purification and some properties of an acid phosphatase fromEscherichiacoli[J]. Biochim Biophys Acta,1962,64(1):1-12.
[6] Thaller MC, Schippa S, Bonci A, et al. Identification of the gene (aphA) encoding the class B acid phosphatase/phosphotransferase ofEscherichiacoliMG1655 and characterization of its product[J]. FEMS Microbiol Lett,1997,146(2):191-198.
[7] Elizabeth J, Bhaskara RM, Radhakrishnan VV, et al. Melanotic differentiation in dysembryoplastic neuroepithe-lial tumor[J]. Clin Neuropathol,2000,19(1):38-40.
[8] Bernard M, Mouyna I, Dubreucq G, et al. Characterization of a cell-wall acid phosphatase (PhoAp) inAspergillusfumigatus[J]. Microbiology,2002,148(Pt 9):2819-2829.
[9] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem,1976,72(1-2):248-254.
[10] Zheng N, Xu J, Wu Z, et al.Clonorchissinensis: molecular cloning and functional expression of novel cytosolic malate dehydrogenase[J]. Exp Parasitol,2005,109(4):220-227.
[11] Kaida R, Hayashi T, Kaneko TS. Purple acid phosphatase in the walls of tobacco cells[J]. Phytochemistry,2008,69(14):2546-2551.
[12] Yang Y, Hu D, Wang L, et al. Comparison of two serpins ofClonorchissinensisby bioinformatics, expression, and localization in metacercaria[J]. Pathog Glob Health,2014,108(4):179-185.
[13] Yajima T. Acid phosphatase activity and intracellular collagen degradation by fibroblastsinvitro[J]. Cell Tissue Res, 1986, 245(2):253-260.
[14] 吕建新, 金丽琴, 陈国荣, 等. 免疫调节剂对大鼠巨噬细胞脂质过氧化物和酸性磷酸酶的影响[J]. 中国病理生理杂志, 1999, 15(2):131-133.
[15] 舒晓春, 张荣华, 朱晓峰, 等. 益骨胶囊含药血清对大鼠破骨细胞凋亡和分泌抗酒石酸酸性磷酸酶的影响[J]. 中国病理生理杂志, 2003, 19(9):1234-1237.

