脑缺血再灌注损伤后血脑屏障结构与功能的变化及丁苯酞预处理的干预作用*
纪海茹, 孔 维, 孔令伟, 赵淑敏△, 孔祥玉△, 王 伟
( 1承德医学院脊髓损伤与修复研究室,河北 承德 067000; 2南阳医学高等专科学校,河南 南阳 473000)
中风是目前导致死亡和神经功能障碍的主要原因,复杂的生化级联反应参与了脑缺血时神经元损伤的主要过程,其中细胞内、外环境的病理生理改变直接影响了神经组织的损伤程度[1]。神经血管单元的结构改变,如血脑屏障(blood brain barrier,BBB)通透性发生变化,会引起细胞内、外环境的剧变,导致血管源性脑水肿,加重脑损伤[2]。脑缺血时,基质金属蛋白酶类通过降解细胞外基质参与了BBB的破坏和血管源性脑水肿的过程,其中基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)居主导地位[3]。观察脑缺血再灌注损伤(cerebral ischemia-reperfusion injury, CIRI)后MMP-9表达水平的变化对评价BBB功能的变化具有重要意义[4]。
丁苯酞(3-n-butylphthalide,NBP)在临床主要应用于轻、中度急性缺血性脑卒中[5],对CIRI有肯定的治疗效果[6],但对CIRI防护作用研究较少,本实验将其预防性应用于CIRI大鼠,探讨其对脑保护的作用机制。
材 料 和 方 法
1 材料与试剂
丁苯酞软胶囊购自石药集团恩必普药业有限公司;伊文思蓝购自TCI;免疫组化试剂盒购自北京四正柏生物科技有限公司;MMP-9Ⅰ抗购自宜康生物技术有限公司;RNasio Plus实时荧光定量PCR试剂盒购自TaKaRa。
2 动物分组、给药方法及模型制备
成年SPF级雄性SD大鼠150只,体重260~280g,购于北京市维通利华实验动物技术有限公司[许可证号:SCXK(京)2012-0001]。
大鼠适应性饲养1周后,完全随机分为5组,分别为假手术组(sham组)、模型组(IR组)、NBP预处理低剂量组(NBPⅠ组)、NBP预处理中剂量组(NBPⅡ组)和NBP预处理高剂量组(NBP Ⅲ组),NBPⅠ、Ⅱ和Ⅲ组分别给予NBP 20、40和80 mg/kg,sham组和IR组给予等体积的生理盐水。全部大鼠于造模前7 d开始灌胃给药,每天1次。
末次灌胃24 h后,IR组和NBP各组参照Zea 等[7]的方法制备大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,假手术组仅分离右侧颈总、颈外及颈内动脉,不插入线栓。术后单笼饲养并注意保暖。缺血2 h后将栓线抽提至颈外动脉残端内行再灌注,再灌注24 h后作相应处理。
3 主要实验方法
3.1脑水肿程度测定 采用干湿重法。各组均取6只大鼠麻醉后迅速取脑,分离出右侧大脑,置于电子天平称其湿重后,放到100 ℃烤箱中烤至恒重。脑组织含水量(%)=(湿重-干重)/湿重×100%。
3.2BBB通透性测定 采用伊文思蓝(Evans blue,EB)作为示踪剂监测血脑屏障损伤程度的方法。每组取6只大鼠处死前1 h经尾静脉注入2%的EB(4 mL/kg),大鼠皮肤、球结膜等变蓝表示注入成功。1 h后经心脏灌注预冷的生理盐水直至右心房流出清亮液体,快速取缺血侧脑组织称湿重后放入5 mL甲酰胺溶液中,54 ℃恒温培养箱中孵育24 h,1 000 r/min离心5 min,酶标仪测定其630 nm处的A值。甲酰胺溶液作为空白比色。脑组织EB含量(μg/g)=待测样品EB含量(mg/L)×甲酰胺容量(mL)/脑湿重(g)。
3.3电镜观察血脑屏障结构的变化 大鼠麻醉后,经心脏快速灌注生理盐水200 mL,待右心耳流出清亮液体时,再用2%戊二醛和4%多聚甲醛混合液灌注固定。取缺血侧大脑皮质,常规透射电镜样品制备,半薄切片选区定位,超薄切片(片厚60 nm)铀、铅双染,透射电镜下观察并摄片。
3.4免疫组织化学法检测MMP-9蛋白的表达水平 采用SP法进行免疫组织化学染色。大鼠麻醉后,经左室快速灌注生理盐水200 mL,随后先快后慢地灌注4%多聚甲醛250 mL左右,快速断头取脑,常规脱水、透明、石蜡包埋,以5 mm厚度连续切片,切片经60 ℃烤片2 h后依次脱蜡、脱水,高压锅行抗原修复2 min后冷却至室温;PBS冲洗2次,每次5 min, 3% H2O2孵育10 min去除内源性过氧化物酶;PBS冲洗2次,每次5 min,滴加山羊封闭血清,室温孵育10 min后倾去;滴加1∶200的MMP-9Ⅰ抗,室温孵育2 h;PBS冲洗3次,每次5 min,擦干切片周围水分后,滴加Ⅱ抗,37 ℃温箱孵育20 min;PBS冲洗3次,每次5 min,擦干切片周围水分后,滴加SP复合物即链酶亲和素-生物素-过氧化物酶复合物,37 ℃温箱孵育20 min;PBS冲洗3次,每次5 min;DAB显色3~5 min,水洗终止显色,苏木素复染30 s,分化水洗,氨水返蓝,脱水透明后中性树胶封片。显微镜观察,MMP-9蛋白的阳性表达为包膜和胞质内的棕黄色颗粒。采用JD801形态学图像分析系统(Version 1.0)测定阳性细胞的平均灰度值,行半定量分析。平均灰度值与阳性细胞数呈反比。
3.5实时荧光定量PCR方法检测MMP-9 mRNA表达 根据GenBank中MMP-9 的基因序列,以β-actin为内参照,设计合成引物。各引物的序列分别为:MMP-9的上游引物为5′-CGCTGACAAGAAGTGGGGTTT-3′,下游引物为5′-TACAGATGGTGGATGCCTTTTATG-3′;β-actin的上游引物为5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游引物为5′ -GACTCATCGTACTCCTGCTTGCTG-3′。根据TaKaRa公司提供的实时荧光定量试剂盒采用SYBR Green法对MMP-9 的mRNA表达水平进行测定。总反应体系为25 μL,包括Premix Ex TaqⅡ 12.5 μL cDNA 2 μL,灭菌蒸馏水8.5 μL,上、下游引物各1 μL(10 μmol/L),放入实时定量PCR反应仪,反应条件:预变性95 ℃ 30 s,变性95 ℃ 5 s,退火51 ℃ 30 s,延伸72 ℃ 30 s,反应循环数为40,设置熔解曲线判断是否有非特异性的扩增和引物二聚体的出现。用2-ΔΔCt的方法进行数据处理。
4 统计学处理
采用SPSS 17.0软件进行统计学分析,数据均以均数±标准差(mean±SD)的表示,不同组间的均数比较用单因素方差检验,各组间的两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 NBP预处理对CIRI大鼠脑组织含水量的影响
与sham组比较,IR组大鼠脑组织含水量显著增加(P<0.01);与IR组比较,NBP预处理组大鼠脑组织含水量均显著减少(P<0.01),且NBPⅡ、Ⅲ组较Ⅰ组减少更明显(P<0.05),但Ⅱ、Ⅲ组之间无显著差异(P>0.05),见图1。

Figure 1. Water content alterations in the rats with different treatments. Mean±SD.n=6.**P<0.01 vs sham;## P<0.01 vs IR; △P<0.05 vs NBP I .
2 NBP预处理对CIRI大鼠BBB通透性的影响
IR组大鼠的BBB通透性较sham组显著增高(P<0.01);NBP各组大鼠的BBB通透性较IR组均显著降低(P<0.01),且NBPⅡ、Ⅲ组比Ⅰ组降低更为显著(P<0.05),但Ⅱ、Ⅲ组之间差异不明显(P>0.05),见图2。
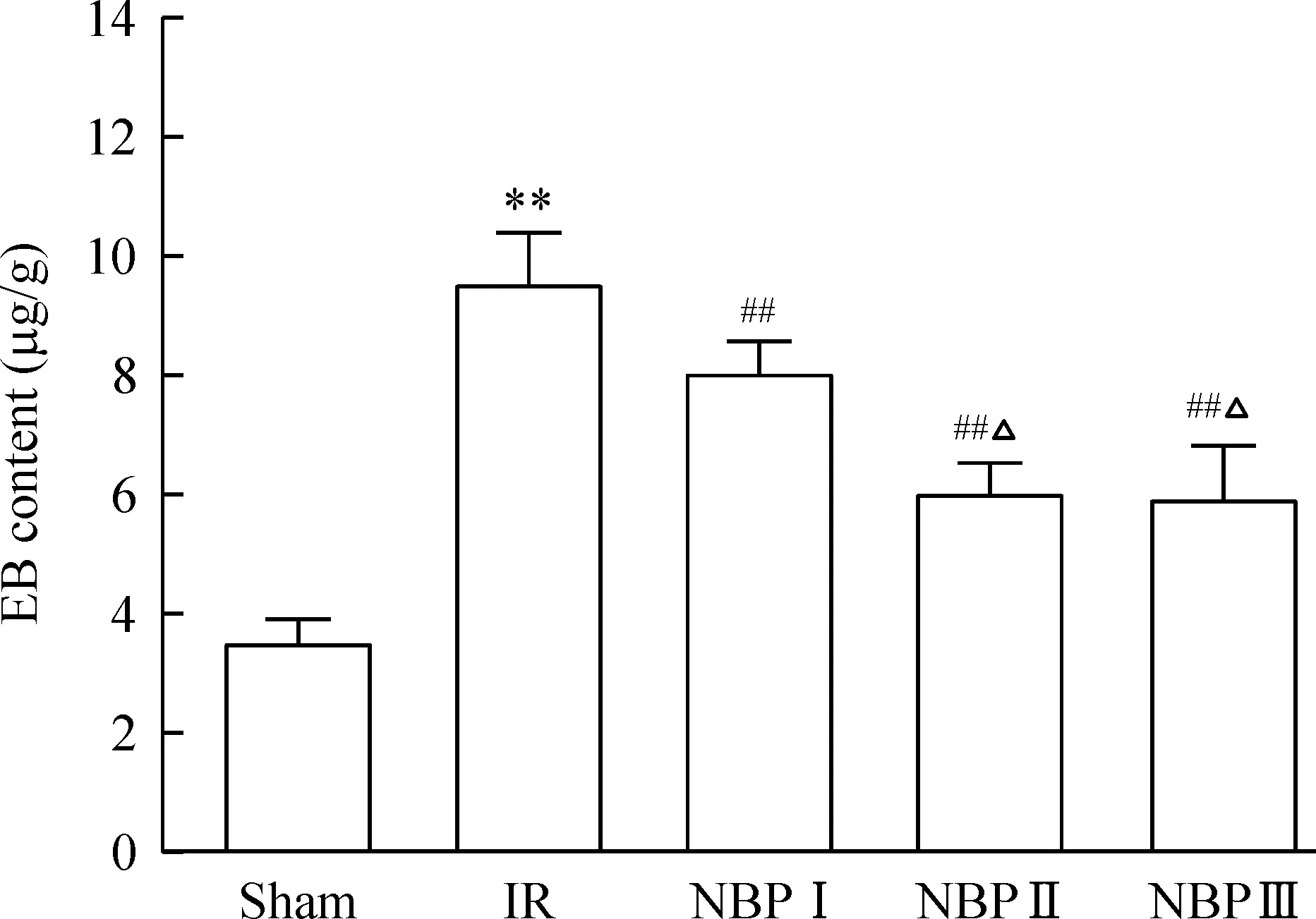
Figure 2. BBB permeability alterations in the rats with different treatments. Mean±SD.n=6.**P<0.01 vs sham;##P<0.01 vs IR; △P<0.05 vs NBP Ⅰ.
3 电镜下观察NBP预处理对CIRI大鼠BBB形态学的影响
Sham组毛细血管内皮细胞核膜、核仁形态规则,染色质密度均一,内皮细胞基膜清晰,厚薄均匀,紧密连接结构完好。IR组毛细血管明显变形,管腔狭窄,血管周围见大片电子空白区,内皮细胞大量溶解,残存的线粒体空泡变性,多处基膜片状溶解、断裂,紧密连接融合、扩张。NBP各组均有不同程度的改善,NBPⅠ组血管周围仍可见电子空白区,毛细血管基膜有溶解、断裂现象,内皮细胞内线粒体空泡变性,紧密连接融合、扩张;NBPⅡ、Ⅲ组的情况较Ⅰ组有明显改观,见图3。

Figure 3. BBB ultrastructure alterations in the rats with different treatments (×20 000).
4 NBP预处理对CIRI大鼠MMP-9 蛋白表达的影响
IR组的MMP-9蛋白表达平均灰度值(139.49±5.53)明显低于sham组(179.52±6.35;P<0.01);NBP各组MMP-9蛋白的表达平均灰度值较IR组均有不同程度增高(均P<0.01),且NBPⅡ组(162.22±3.76)、NBPⅢ组(166.69±6.85)比NBPⅠ组(151.32±3.83)增高更为显著(P<0.05),但是NBPⅡ、Ⅲ组之间无显著差异(P>0.05),见图4。

Figure 4. The protein expression of MMP-9 in the rats with different treatments (immunohistochemical staining, ×200).
5 NBP预处理对CIRI大鼠MMP-9 mRNA表达的影响
Sham组MMP-9有微量表达;IR组MMP-9的表达较正常组明显升高(P<0.01),NBP各组MMP-9含量均减少,且NBPⅡ、Ⅲ组比Ⅰ组减少更为显著(均P<0.05),但Ⅱ、Ⅲ组之间差异不明显(P>0.05),见图5。
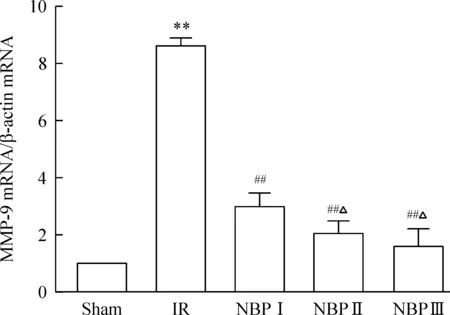
Figure 5. The mRNA expression of MMP-9 in the rats with different treatments. Mean±SD.n=6.**P<0.01 vs sham; ## P<0.01 vs IR; △P<0.05 vs NBP Ⅰ.
讨 论
目前研究表明,脑水肿是脑缺血再灌注损伤后BBB破坏所引起的主要表现。同时,BBB通透性增强会导致大量有害物质进入脑组织,引起细胞内外环境的改变,进一步加重脑水肿,导致神经元损伤[8]。MMP-9因有较强降解细胞外基质的能力,常被作为评价BBB完整性的检测指标[1, 9-10]。EB作为一种示踪剂可直接反映BBB的通透情况,脑含水量是评价脑水肿的直接指标[11],可间接反映BBB的开放程度。电镜下的观察,是对血脑屏障形态学变化最有力的说明[12]。
本实验脑缺血2 h再灌注24 h后,MMP-9表达明显上调,EB含量和脑含水量大幅增加,电镜摄片也显示血脑屏障紧密连接融合、扩张,毛细血管明显变形,内皮细胞大量溶解,多处基膜片状溶解、断裂,与文献报道一致[13]。
丁苯酞是人工合成的消旋体,可改善脑缺血所致的脑损伤,有较强的抗缺血作用,能够明显缩小脑缺血的梗死体积,减轻脑水肿,抑制细胞凋亡,改善缺血区的微循环和脑能量代谢[14]。本实验不再探讨丁苯酞的治疗作用,而是将其预处理于脑缺血再灌注损伤的大鼠,探讨其对脑缺血的预防性保护作用。结果显示,丁苯酞20 mg/kg预处理后,脑水肿减轻,BBB通透性降低,MMP-9表达下调,提示预防性应用丁苯酞后,小剂量即可起到保护作用。
为了探讨丁苯酞预处理大鼠的合适剂量,我们又做了中、高(40、80 mg/kg)剂量的探索。结果发现,这2个剂量组与低剂量组相比,脑水肿进一步减轻,BBB通透性降低,MMP-9表达明显减少,同时,中、高剂量组之间在上述指标中虽有数值的差异,但并无统计学的意义,提示应用40 mg/kg的丁苯酞预处理脑缺血再灌注损伤大鼠,可发挥较好的保护作用。
综上所述,丁苯酞预处理可减轻脑水肿,减少BBB的通透性,发挥一定的预防性保护作用。其机制可能是通过调节MMP-9的表达,降低因血脑屏障通透性增加带来的神经损伤。此外,本研究还采用了不同剂量的分组,找到了预处理应用于大鼠的最佳剂量,为临床进一步应用提供有力的基础支持。
[参 考 文 献]
[1] Wu Y, Wang YP, Guo P, et al. A lipoxin A4 analog ameliorates blood-brain barrier dysfunction and reduces MMP-9 expression in a rat model of focal cerebral ischemia-reperfusion injury [J]. J Mol Neurosci, 2012, 46(3): 483-491.
[2] Lee JH, Cui HS, Shin SK, et al. Effect of propofol post-treatment on blood-brain barrier integrity and cerebral edema after transient cerebral ischemia in rats[J]. Eur J Neurosci, 2013, 38(11):2276-2286.
[3] Wang Z, Leng Y, Tsai LK, et al. Valproic acid attenuates blood-brain barrier disruption in a rat model of transient focal cerebral ischemia: the roles of HDAC and MMP-9 inhibition[J]. J Cereb Blood Flow Metab, 2011, 31(1):52-57.
[4] 高 峰,宋水江,吴继敏,等. 基质金属蛋白酶-9及其组织抑制物-1与颈动脉粥样斑块稳定性相关研究[J]. 中国病理生理杂志,2007,23(9):1700-1702.
[5] 纪海茹,孔 维,赵淑敏,等. 丁苯酞对脑缺血再灌注损伤保护作用的研究进展[J]. 承德医学院学报, 2014, 31(3):250-252.
[6] 李国前,王杰华,杨小霞,等. 丁苯酞对大鼠脑缺血再灌注损伤后凋亡相关因子表达的影响[J]. 中国临床药理学杂志, 2011, 27(9):682-685.
[7] Longa EZ, Weinsten PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[8] Lee K, Lee JS, Jang HJ, et al. Chlorogenic acid ameliorates brain damage and edema by inhibiting matrix metalloproteinase-2 and 9 in a rat model of focal cerebral ischemia[J]. Eur J Pharmacol, 2012, 689(1-3):89-95.
[9] Xiang J, Lan R, Tang YP, et al.Apocynumvenetumleaf extract attenuates disruption of the blood-brain barrier and upregulation of matrix metalloproteinase-9/-2 in a rat mo-del of cerebral ischemia-reperfusion injury[J]. Neurochem Res, 2012, 37(8):1820-1828.
[10]Tu XK, Yang WZ, Liang RS, et al. Effect of baicalin on matrix metalloproteinase-9 expression and blood-brain barrier permeability following focal cerebral ischemia in rats[J]. Neurochem Res, 2011, 36(11):2022-2028.
[11]余 涓,许 琳,林艳婷,等. 局灶性脑缺血再灌注致血脑屏障破坏与zileuton的保护作用[J]. 中国病理生理杂志,2009, 25(7):1342-1347.
[12]Zhao S, Kong W, Zhang S, et al. Pretreatment withScutellariabaicalensisstem-leaf total flavonoid prevents cerebral ischemia-reperfusion injury[J]. Neural Regen Res, 2013, 8(34):3183-3192.
[13]赵淑敏, 孔 维, 张树峰, 等. 黄芩茎叶总黄酮预处理对缺血再灌注损伤神经元凋亡蛋白表达和超微结构的影响[J]. 神经药理学报,2011, 1(5):19-26.
[14]王建华, 刘瑞珍. 丁苯酞对大鼠脑缺血再灌注损伤后细胞色素-C的影响[J]. 中西医结合心脑血管病杂志, 2014, 8(3):320-322.

