TPCA-1对脂多糖诱导的角膜基质成纤维细胞作用及其机制的研究
姜 宏,仲 炜,闫东君
(吉林大学中日联谊医院 眼科,吉林 长春130033)
通过研究TPCA-1影响LPS刺激角膜基质成纤维细胞分泌炎性细胞因子(IL-1,TNF-α,IL-6)和趋化因子(IL-8)以及细胞表面ICAM-1中的作用,旨在观察TPCA-1对脂多糖诱导的角膜基质细胞分泌炎性细胞因子、趋化因子、细胞间黏附因子抑制作用及其信号转导途径,为临床治疗角膜溃疡提供有益的线索。
1 材料与方法
1.1人角膜基质细胞的培养及鉴定组织来源于角膜移植术后剩余角膜材料,供体为健康成年人。采用消化培养法,用小鼠抗人波形蛋白及角蛋白单克隆抗体进行细胞鉴定。
1.2ELISA法检测角膜基质细胞LPS作用前后培养上清中分泌IL-1,TNF-α,IL-6,IL-8水平分组为:① 阴性对照组:加入不含有任何血清或药物的同体积MEM培养液;② 溶媒对照组:单纯给予含有0.5%人血清(AB型)的MEM培养液;③LPS组:给予含有0.5%人血清(AB型)及LPS 100 ng/ml的MEM培养液。
1.3ELISA检测不同浓度的TPCA-1对LPS作用前后分泌IL-6,IL-8蛋白的作用ELISA检测试剂盒按说明书操作。并根据此结果进行下一步试验。
1.4蛋白质印迹杂交(Westernblot)法检测TPCA-1对LPS作用后细胞IL-6,ICAM-1的影响分组为:①阴性对照组:给予等体积MEM培养液;②LPS组:给予含有0.5%人血清(AB型)的LPS(100 ng/ml);③TPCA-1组:给予TPCA-1(1.0 μM)预处理1小时后,给予含有0.5%人血清(AB型)的LPS(100 ng/ml)。
以上3组各自作用24 h后,提取细胞中总蛋白,进行蛋白含量的测定,蛋白质印迹杂交,将Westem印迹杂交X线片图像扫描入计算机,采用Quanty one软件进行定量分析。
1.5逆转录多聚酶链反应(RT-PCR)方法检测TPCA-1LPS刺激前后细胞IL-6,IL-8,ICAM-1的影响分组同1.4。PCR使用的引物包括:① GAPDH:上游5’-ACC ACA GTC CAT GCC ATC AC-3’ ,下游5’-TCC ACC ACC CTG TTG CTG TA-3’,用这对引物可扩增出长度为447 bp的GAPDH cDNA片段; ② IL-6:(+)5′-GGA GAC TTG CCT GGT GAA-3′,(-)5′-CTG AGG TGC CCA TGC TAC-3′,用这对引物可扩增出长度为330 bp的IL-6 cDNA片段; ③ IL-8:(+)5′-ATG ACT TCC AAG CTG GCC GTG GCT-3′,(-)5′-TCT CAG CCC TCT TCA AAA ACT TCT C-3′,用这对引物可扩增出长度为293 bp的ICAM-1cDNA片段。 ④ ICAM-1:(+)5′-TGA CCA GCC CAA GTT GTT GG-3′,(-)5′-ATC TCT CCT CAC CAG CAC CG-3′,用这对引物可扩增出长度为380 bp的ICAM-1cDNA片段。取5 μl PCR产物进行2%琼脂糖凝胶(含0.5 μg/ml溴化乙锭)3 V/cm电泳30-50 min,紫外灯下照相,用凝胶成像处理系统对每一样品PCR产物扩增的特异性片断(IL-6、IL-8、ICAM-1和GAPDH)进行辉度扫描,以GAPDH密度作为参考定量标准,标本目的基因条带的光密度参数与内参基因GAPDH条带的光密度参数之比值作为该标本mRNA的相对定量。
1.6免疫组化染色检测TPCA-1对LPS作用前后NF-κB的分布及表达实验细胞的准备及分组同1.5,免疫组化染色按试剂盒说明书操作。
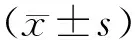
2 结果
2.1ELISA法检测角膜基质细胞LPS作用前后分泌IL-1,TNF-α,IL-6,IL-8水平各组均未检测到IL-1、TNF-α,与阴性对照组比较,人血清组分泌IL-6、IL-8因子水平无显著差异(P>0.05);LPS组分泌IL-6、IL-8水平明显高于阴性对照组(P<0.01)。
2.2ELISA检测不同浓度的TPCA-1对LPS作用前后分泌IL-6,IL-8蛋白的影响在无LPS作用下,不同浓度的TPCA-1作用后IL-8的基础分泌与阴性对照组比较无显著差异(P>0.05);IL-6的基础分泌与阴性对照组比较明显降低(P<0.05),作用随TPCA-1浓度增加而增大,具有浓度依赖性。LPS作用后,各浓度的TPCA-1对IL-6、IL-8的影响与LPS组比较均有显著差异(P<0.05),作用随TPCA-1浓度增加而增大,具有浓度依赖性。
2.3蛋白质印迹杂交(Westernblot)法检测TPCA-1应用对LPS作用后细胞IL-6,ICAM-1蛋白的影响阴性对照组表达IL-6及ICAM-1蛋白,LPS作用后表达水平增高,与阴性组比较有显著性差异(P<0.01)。与LPS组比较,LPS+TPCA-1组能够明显抑制角膜基质细胞IL-6及ICAM-1的表达(P<0.01)。
2.4RT-PCR检测TPCA-1应用对LPS作用后细胞IL-6,IL-8,ICAM-1的影响阴性组mRNA水平表达IL-6、IL-8及ICAM-1,LPS作用后表达水平增高,与阴性组比较有显著性差异(P<0.05)。LPS+TPCA-1组能够明显抑制角膜基质细胞IL-6、IL-8及ICAM-1在mRNA水平的表达,与LPS组比较有显著性差异(P<0.05)。
2.5免疫组化染色检测TPCA-1应用对LPS作用前后细胞核NF-κB表达细胞爬片行NF-κB免疫组织化学染色,可见正常培养的人角膜基质成纤维细胞核呈深蓝色,LPS作用后细胞核黄褐色阳性着染,TPCA-1抑制后给予LPS作用细胞核染色为深蓝色阴性。
3 讨论
角膜基质成纤维细胞在角膜防御和炎症反应中有重要作用。这些细胞不仅通过对炎性细胞因子发生反应,还可以直接和细菌相互作用诱导炎性细胞局部浸润。成纤维细胞依其所在身体的不同部位和局部刺激物而表现不同的结构和功能特性[1],在离体培养后他们的不同表现型能够维持不变[2,3]。角膜、皮肤、肺等不同组织来源的成纤维细胞细胞因子调节TARC表达是不同的[4,5],成纤维细胞对LPS的应答反应也因组织来源不同而不同。例如,肺成纤维细胞在LPS刺激时表达MCP-1而不表达IL-8[6],现在我们证实角膜基质成纤维细胞在LPS刺激时则表达IL-8。成纤维细胞对LPS或其他炎性介质的不同反应,可能构成了不同组织在炎症反应中的不同特征。细胞因子介导的细胞信号系统,被认为在很多结缔组织和上皮组织构成器官的发展、内环境稳定和创伤愈合中,在结构和功能上发挥最重要的作用。角膜因为没有像皮肤等器官那样的血管、皮脂腺、毛囊或混杂其他组织,在研究信号系统时成为特殊的模型[7]。
本研究结果提示TPCA-1通过抑制炎性细胞因子表达可能会抑制炎性细胞的趋化,对免疫细胞和组织固有细胞各自发挥多种作用。IKK-2的小分子抑制物TPCA-1最近被发现有希望用于治疗炎症性疾病如哮喘[8]、关节炎[9]以及眼部碱烧伤等情况的动物模型[10,11],并且安全有效。最近有人证实中性粒细胞刺激角膜基质胶原降解[12],炎性细胞和角膜固有的基质成纤维细胞的相互作用在角膜炎症中发挥重要的作用。TPCA-1可以对IL-6,IL-8及细胞表面ICAM-1有显著的抑制作用提示TPCA-1在抑制感染性角膜炎症中可能发挥更重要的作用。它是否有副作用尚需进一步探讨。
在原始上皮和内皮细胞,地塞米松抑制了NF-κB依赖的转录活性,但不改变IB水平或NF-κB的核转位。我们证实了相似的机理出现在角膜基质成纤维细胞。IKK-2阻滞剂在抑制脂多糖诱导的角膜基质成纤维细胞炎性因子表达和胶原降解方面与地塞米松有相似作用,但是两种药物会发挥不同的作用机理[12,13]。IKK-2对NF-κB的激活发挥中心作用[14]。我们从实验中证实,选择性IKK-2受体抑制剂TPCA-1对抑制脂多糖诱导的角膜基质成纤维细胞表达和分泌IL-6、IL-8以及细胞表面ICAM-1。
我们证实了IKK-2受体阻滞剂(TPCA-1)能在炎症反应中抑制IL-6、IL-8、ICAM-1等表达,是由于它阻断了IB磷酸化和降解以及继发的NF-κB核转位。提示IKK-2受体阻滞剂(TPCA-1)可能成为治疗角膜溃疡除地塞米松外的另一种选择或补充。可能成为治疗角膜溃疡药物发展方面新的选择。
以文章中的实验结果作为前期工作和基础,我们可以进一步深入探讨角膜炎症和角膜基质胶原降解的信号转导机制。并利用LPS建立角膜溃疡动物模型,进而进行体内试验,探讨TPCA-1抑制角膜基质胶原降解及角膜溃疡的机制,从而为临床上治疗角膜溃疡这一严重致盲眼病提供重要的参考依据。
参考文献:
[1]Nonaka M,Pawankar R,Saji F,et al.Distinct expression of RANTES and GM-CSF by lipopolysaccharide in human nasal fibroblasts but not in other airway fibroblasts[J].Int Arch Allergy Immunol,1999,119:314.
[2]Hogaboam CM,Steinhauser ML,Chensue SW,et al.Novel roles for chemokines and fibroblasts in interstitial fibrosis[J].Kidney Int,1998,54:2152.
[3]Brouty-Boye′ D,Pottin-Cle′menceau C,Doucet C,et al.Chemokines and CD40 expression in human fibroblasts[J].Eur J Immunol,2000,30:914.
[4]Fukuda K,Fujitsu Y,Seki K,et al.Differential expression of thymus-and activation-regulated chemokine (CCL17) and macrophage-derived chemokine (CCL22) by human fibroblasts from cornea,skin,and lung[J].J Allergy Clin Immunol,2003,111:520.
[5]Fukuda K,Yamada N,Fujitsu Y,et al.Inhibition of eotaxin expression in human corneal fibroblasts by interferon-γ[J].Int Arch Allergy Immunol,2002,129:138.
[6]Koyama S,Sato E,Nomura H,et al.The potential of various lipopolysaccharides to release monocyte chemotactic activity from lung epithelial cells and fibroblasts[J].Eur Respir J,1999,14:545.
[7]Wilson SE,Mohan RR,Mohan RR,et al.The corneal wound healing response:cytokine-mediated interaction of the epithelium,stroma,and inflammatory cells[J].Prog Retinal Eye Res,2001,20:625.
[8]Birrell MA,Hardaker E,Wong S,et al.I-B kinase-2 inhibitor blocks inflammation in human airway smooth muscle and a rat model of asthma[J].Am J Respir Crit Care Med,2005,172:962.
[9]Nagai Y,Akashi S,Nagafuku M,et al.Essential role of MD-2 in LPS responsiveness and TLR4 distribution[J].Nat Immunol,2002,3:667.
[10]Schopf L,Savinainen A,Anderson K,et al.IKK inhibition protects against bone and cartilagede struction in a rat model of rheumatoid arthritis[J].Arthritis Rheum,2006,54:3163.
[11]Saika S,Miyamoto T,Yamanaka O,et al.Therapeutic effect of topical administration of SN50,an inhibitor of nuclear factor-B,in treatment of corneal alkali burns in mice[J].Am J Pathol,2005,166:1393.
[12]Saika S,Ikeda K,Yamanaka O,et al.Expression of Smad7 in mouse eyes accelerates healing of corneal tissue after exposure to alkali[J].Am J Pathol,2005,166:1405.
[13]Eberhardt W,Schulze M,Engels C,et al.Glucocorticoid-mediated suppression of cytokine-induced matrixmetalloproteinase-9 expression in rat mesangial cells:involvement of nuclear factor-B and Ets transcription factors[J].Mol Endocrinol,2002,16:1752.
[14]Li W,Zheng S,Tang C,et al.JNK-AP-1pathway involved in interleukin- 1-induced calcitonin gene-related peptide secretion in human type II alveolar epithelial cells[J].Peptides,2007,28:1252.

