具有ACC脱氨酶活性的绞股蓝根际细菌的分离鉴定及其促生作用*
宋金秋,吾鲁木汗·那孜尔别克,张 缇,恩特马克·布拉提白
(吉首大学生物资源与环境科学学院,湖南 吉首 416000)
具有ACC脱氨酶活性的绞股蓝根际细菌的分离鉴定及其促生作用*
宋金秋,吾鲁木汗·那孜尔别克,张 缇,恩特马克·布拉提白
(吉首大学生物资源与环境科学学院,湖南 吉首 416000)
为了筛选含ACC脱氨酶的根际促生细菌,以1-氨基环丙烷-1-羧酸(ACC)为唯一氮源,从绞股蓝根际土壤中富集和分离ACC脱氨酶阳性细菌,利用α-丁酮酸测定法和CAS平板法分别检测其ACC脱氨酶活性和产嗜铁素能力,利用菌液培养接种法检测细菌的促生作用,最后通过生理生化试验和16S rRNA基因序列分析对所筛选的菌株进行鉴定.经富集筛选法从绞股蓝根际土壤中分离出9株ACC脱氨酶阳性细菌,它们均具有不同程度的ACC脱氨酶活性,其中3株细菌能产生嗜铁素.促生试验结果表明,7株ACC脱氨酶活性细菌对水稻幼苗根系的生长发育表现出不同程度的促生作用,其中菌株JDG127的促生作用最明显,与对照组相比,水稻幼苗的根长和根鲜重增长了约1.6倍.鉴定结果表明,9株细菌中1株属于单胞菌属(Stenotrophomonas),1株属于类芽胞杆菌属(Paenibacillus),1株属于芽孢杆菌属(Bacillus),2株属于肠杆菌属(Enterobacter),4株属于不动杆菌属(Acinetobacter),与ACC脱氨酶相比,铁载体对根际细菌的促生作用更明显.
绞股蓝;根际细菌;ACC脱氨酶;促生能力
植物根际促生细菌(plant growth promoting rhizobacteria)是生存在植物根际的一类能促进植物生长、防治植物病害、提高农作物产量的有益细菌,它们通过直接或间接作用机制能促进或调节植物的生长发育[1].文献[2]中的综述中阐述,植物根际土壤中广泛存在多种植物根际促生细菌,目前已鉴定的菌株有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、固氮螺旋菌属(Azospirillum)、固氮菌属(Azotobacter)、肠杆菌属(Enterobacter)、黄单胞菌属(Xanthornonas)、根瘤菌属(Rhizobium)、产碱菌属(Alcaligens)、节杆菌属(Arthobacter)、布克霍尔德氏菌属(Burkholderia)、克雷伯氏菌属(Klebsiella)、沙雷氏菌属(Serratia)等.目前,国内外通过使用化肥提高农作物产量,用农药防治果树和农作物病害.随着化肥和农药使用量的增加,农业生态系统遭到破坏,对食品安全和人类健康造成严重的威胁.因此,研究根际促生细菌的促生作用和生化作用及其机制,对代替或减少农药和化肥的使用、改善农业生态系统、保持植物微生态系统的生物多样性以及维护农田生态平衡都有重要的意义.
乙烯的正常生理功能是协助打破种子休眠,促进植物的成熟和衰老,而植物一生大部分发育阶段只需少量乙烯,当植物在生长发育阶段如遇到高盐、干旱、水涝、重金属污染、机械损害、病原体侵入等不良环境因素时会产生大量乙烯作为植物对环境的一种生理应急反应,称为“逆境乙烯”.逆境乙烯的产生从某种意义上来说是植物的一种自我保护反应,但是乙烯过量产生将导致植物生长发育受阻或死亡,过量乙烯还会抑制根的伸长、侧根的生长以及根毛的形成.文献[3]中的研究表明,根际促生细菌可产生1-氨基环丙胺-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)脱氨酶,该酶是通过催化乙烯的直接前体ACC分解成α-丁酮酸和胺来降低植物体内的乙烯含量,保持植物体内外乙烯的平衡,从而减少过量乙烯对植物生长发育造成的不良影响.文献[4]报道了从辽宁东滨海湿地植物翅碱蓬根际土壤中分离到4株ACC脱氨酶活性细菌,并在盐胁迫条件下检测它们对燕麦初生苗的促生作用,结果显示这4株菌在质量浓度为10 g/L NaCl盐胁迫下也均表现出显著的促生作用.文献[5]报道了将阴沟肠杆菌UW的ACC脱氨酶基因acds克隆到广泛宿主范围表达载体pRK415的多克隆位点上,将重组质粒pRKACC分别转化固氮螺菌Cd和Sp245并检测它们的促生作用,结果显示与固氮螺菌Cd和Sp245相比,重组菌Cd/pRKACC和Sp245/pRKACC都能促进番茄和油菜幼苗的生长.文献[6]报道了从草莓、小麦等农作物根际土壤中分离到6株ACC脱氨酶活性细菌,其中菌株ACC30的酶活性最高,平皿促生试验结果显示,用该菌株处理紫花苜蓿种子后根伸长的长度明显大于对照组CK和Baccillus subtilus处理组.目前,有关具有ACC脱氨酶活性的绞股蓝根际细菌的分离鉴定及其促生作用研究国内外未见报道.笔者采用富集筛选法从湖南省吉首市德夯国家级重点风景名胜区绞股蓝根土壤中筛选到9株具有ACC脱氨酶活性的细菌,通过菌液培养接种法检测它们对水稻幼苗的促生作用.
1 材料与方法
1.1材料
ACC购自上海瀚鸿化工科技有限公司;α-丁酮酸购自美国Sigma公司;PCR试剂和DNA marker购自大连宝生物工程公司;铬天青S购自上海生工生物工程公司;按照文献[7]中的方法分别配制PAF,DF,ADF和TSB培养基,用于含ACC脱氨酶根际细菌的筛选及其ACC脱氨酶酶活性的检测;按照文献[8]中的方法配制CAS培养基,用于检测细菌产生嗜铁素能力;T优300水稻种子购自湖南隆平种业有限公司.
1.2方法
1.2.1根际细菌的分离及纯化 细菌初选工作于2012年3—5月进行.采集湖南省吉首市德夯国家级重点风景名胜区绞股蓝根及其粘附土壤(≤ 2 mm区域),置于冰盒(温度约4 ℃),立即带回实验室.取植物根部,用无菌水冲洗,以去除外围土壤,切成长约1 cm小段,石蜡油封住两端,加入10 mL PBS溶液,150 r/min震荡处理30 min,梯度稀释后,分别取100 μL菌液涂布于TSB固体培养基,28 ℃培养72 h.取15株形态各异的细菌,供下一步工作.
1.2.2 ACC脱氨酶阳性细菌的筛选 将上述15株菌株分别接种于10 mL的PAF液体培养基,28 ℃震荡培养48 h,用新鲜ADF培养基将菌液稀释至10-5倍,取100 μL菌液涂布于ADF固体培养基中,28 ℃培养至出现菌落,挑取单菌落接种于新鲜ADF固体培养基,通过重复转接筛选得到能在以ACC为唯一氮源的ADF培养基上生长的菌株.将菌株接种于10 mL的TBS液体培养基培养24 h,加入体积分数为20%的甘油,-80 ℃冻存.
1.2.3 根际细菌ACC脱氨酶酶活性的测定 用0.1 mol/L Tris-HCl (pH值为8.5)缓冲液配制100 mmol/L的α-丁酮酸保存液,经梯度稀释配制终浓度0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mmol/L的α-丁酮酸溶液,各取200 μL加入300 μL 0.2%的2,4-二硝基苯肼,30 ℃孵育30 min,加2 mL的2 mol/L NaOH溶液显色苯腙,540 nm测定吸光度.以α-丁酮酸的浓度(mmol/L)为横坐标,以吸光率(A540)为纵坐标绘制标准曲线.将-80 ℃保存的菌株接种于15 mL的TSB液体培养基培养24 h,8 000 r/min离心10 min收集菌体,用5 mL的DF液体培养基洗涤菌体后悬浮于7.5 mL ADF液体培养中,28 ℃培养24 h,使细菌诱导产生ACC脱氨酶.参照文献[9]中的方法测定ACC脱氨酶的活性,即将诱导产生ACC脱氨酶的菌液,8 000 r/min离心10 min收集菌体,用0.1 mol/L Tris-HCl (pH值为7.6)缓冲液洗涤,将菌体重悬于600 μL的0.1 mol/LTris-HCl (pH值为8.5)缓冲液,加30 μL甲苯提取细胞液,取200 μL细胞提取液与20 μL的0.5 mol/L ACC溶液混合,30 ℃孵育15 min,加300 μL 0.2%的2,4-二硝基苯肼,30 ℃孵育30 min,加2 mL浓渡为2 mol/L的NaOH溶液显色苯腙,540 nm测吸光率.以牛血清蛋白为标准,采用Bradford法测定细胞提取液中的总蛋白质含量.将每分钟形成1 μmol α-丁酮酸的量定义为1个酶活力单位.
1.2.4 根际细菌产嗜铁素能力的检测 用CAS平板检测法[8]测定根际细菌的产嗜铁素能力,即将活化后的菌株接种于CAS检测平板上,28 ℃培养48 h后观察平板上黄绿色透明圈的产生和大小,如菌落周边有黄绿色晕圈产生,即表明该菌株具产嗜铁素能力.
1.2.5 根际细菌对水稻初生苗的促生作用 参照文献[10]报道的菌液培养接种法检测ACC脱氨酶活性菌株对水稻的促生作用,即挑取饱满无病害的水稻种子进行表面消毒,消毒后立即用无菌水充分洗涤,并将ACC脱氨酶活性菌株、大肠杆菌DH5α分别配制成108CFU/mL的菌悬液.将消毒洗净后的种子置于培养皿中(每皿30粒种子,每个种子重复处理3次),培养皿底部分别放有7 mL的ACC脱氨酶活性菌株菌悬液、大肠杆菌DH5α菌悬液、无菌水湿润的滤纸,置于25 ℃恒温培养箱中培养,7 d后测定根长及其鲜重.
1.2.6 根际细菌的生理生化鉴定 根据绞股蓝根际ACC脱氨酶活性细菌的菌落形态特征、菌体形态特征、革兰氏染色性状,有关生理生化鉴别试验参照《常见细菌系统鉴定手册》进行属和种的鉴定.
1.2.7 根际细菌16S rRNA序列分析 用改良的CTAB法提取细菌基因组DNA.采用通用引物27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)经PCR从细菌基因组DNA中扩增出16S rRNA序列,PCR产物送上海生工生物工程有限公司进行测序.通过BLAST软件对测定16S rRNA基因序列进行同源性比较,选取同源性较高的序列,利用MEGA4.1软件构建系统发育树.
2 结果与讨论
2.1绞股蓝根际ACC脱氨酶活性细菌的筛选
通过富集定向筛选,从绞股蓝根际土壤中分离得到9株能在以ACC为唯一氮源的ADF培养基上生长的细菌.酶活力检测结果显示,菌株JDG122,JDG124,JDG126,JDG127,JDG186,JDG188,JDG191,JDG192和JDG223的酶活力分别为0.042,0.032,0.292,0.521,0.271,0.322,0.171,0.057,0.463 U/mg,其中JDG127菌株的酶活力最高.
2.2根际细菌的产铁载体能力
在CAS平板上检测9株ACC脱氨酶活性菌株的产嗜铁素能力.结果显示,菌株JDG127,JDG122,JDG124和JDG191均能产生嗜铁素,其中菌株JDG127的产嗜铁素能力最强,而菌株JDG126,JDG186,JDG188,JDG192和JDG223均为嗜铁素阴性(见图1).

图1 具ACC脱氨酶活性菌株的产嗜铁素能力的CAS平板检测结果
2.3具ACC脱氨酶活性细菌的促生作用
与大肠杆菌DH5α处理组和无菌水处理组相比,9株ACC脱氨酶活性菌株对水稻种子的萌发率均没有明显的影响.促生试验结果显示,9株ACC脱氨酶活性菌株中,7株菌株对水稻幼苗根系的生长发育表现不同程度的促生作用(见表1),其中菌株JDG127接种处理组水稻幼苗的根长为9.8 cm和根鲜重为0.84 g,与对照组相比,其根长和鲜重分别增长了55%和52%(见图2),表明JDG127菌株具有较强的促生作用.

表1 具ACC脱氨酶根际细菌对水稻幼苗根长和根鲜重的促生效果
注 肩标a表示接种处理组的幼苗根长及其鲜重显著高于未接种对照组(P<0.01);肩标b表示接种处理组的幼苗根长及其鲜重均显著高于未接种对照组(P<0.05).
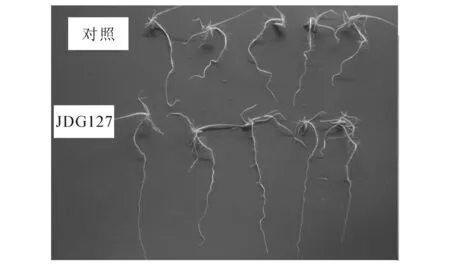
图2 菌株JDG127对水稻幼苗根系的促生作用
2.4具ACC脱氨酶活性细菌的形态及生理生化特征
将9株具ACC脱氨酶活性菌株的形态特征和生理生化特征(见表2)与《常见细菌系统鉴定手册》中相应属、种进行对照.初步鉴定结果表明,JDG223属于芽孢杆菌属(Bacillus),JDG122,JDG124,JDG127和JDG186属于不动杆菌属(Acinetobacter),JDG126属于单胞菌属(Stenotrophomonas),JDG188和JDG192属于肠杆菌属(Enterobacter),而JDG191属于类芽胞杆菌属(Paenibacillus).

表2 具ACC脱氨酶活性绞股蓝根际细菌的形态及生理生化特征
2.5具ACC脱氨酶活性细菌16SrRNA序列分析
用通用引物从9株绞股蓝根际ACC脱氨酶活性菌株基因组中扩增出1.4 kb左右的PCR片段,并进行DNA测序.通过BLAST软件对测定16S rRNA基因序列进行同源性分析,从NCBI数据库中选取同源性较高的序列,利用MEGA4.1软件构建系统发育树,如图3—5所示.从图3可知,JDG122,JDG127,JDG124,JDG186与Acinetobacter属的9个种类归在一个簇群中,JDG122和JDG127与AcinetobacterbereziniaeATCC 17924的同源性分别为98%和99%,JDG124与AcinetobacterguillouiaeATCC 11171的同源性为99%,而JDG186与AcinetobacterbaumanniiATCC 19606的同源性为98%;从图4可知,JDG188和JDG192与Enterobacter属的3个种类归在一个簇群中,JDG188和JDG192与Enterobactersp.E4M-P和EnterobacterasburiaeM16的同源性均为99%,而JDG126与Stenotrophomonas属的2个种类聚在一起,与Stenotrophomonassp.MH107的同源性为99%;从图5可知,JDG191与PaenibacillusxylanexedensB22a聚在一起,而JDG223与BacillusweihenstephanensisWSBC 10204 聚在一起,它们的同源性均为98%.进一步结合生理生化试验结果,将菌株JDG-122,JDG-127,JDG-124,JDG-186分别鉴定为Acinetobacterbereziniae,Acinetobacterbereziniae,Acinetobacterguillouiae,Acinetobacterbaumannii,菌株JDG192和JDG188分别鉴定为Enterobacterasburiae和Enterobactersp.,而菌株JDG126,JDG191和JDG223分别鉴定为Stenotrophomonassp.,Paenibacillusxylanexedens和Bacillusweihenstephanensis.本研究结果表明,绞股蓝根际具ACC脱氨酶活性细菌具有较丰富的种属多样性.

图3 菌株JDG122,JDG124,JDG127和JDG186的16S rRNA序列系统发育树

图4 菌株JDG188,JDG192和JDG126的16S rRNA序列系统发育树

图5 菌株JDG191和JDG223的16S rRNA序列系统发育树
3 分析
(1)采用富集筛选法从绞股蓝根际土壤中分离得到9株具有ACC脱氨酶活性的根际细菌,其中菌株JDG127的ACC脱氨酶活性最高(0.521 U/mg),比文献[6]报道的草莓根际产酸菌ACC30株ACC脱氨酶活性(0.217 U/mg)高出2倍,而与文献[11]报道的杜仲内生假单胞菌JDM-2株ACC脱氨酶活性(0.468 U/mg)基本相等,表明菌株JDG127具有较高的ACC脱氨酶活性.
(2)文献[1]报道,绝大多数根际促生细菌通过非核糖体途径合成分泌1种或几种铁载体,而铁载体通过提高植物根际土壤中铁的可用性以直接的方式促进植物的生长.文献[12]报道了从水稻根际土壤中分离得到能产生植物生长激素IAA的固氮菌、肺炎克雷伯菌、沙雷氏菌和假单胞菌等根际细菌,通过CAS平板法检测它们的铁载体合成能力,结果显示只有假单胞菌属菌株能合成铁载体,抑菌试验结果显示恶臭假单胞菌、铜绿假单胞菌和荧光假单胞菌对马铃薯晚疫病菌(Phytophthorainfestans)有较强的拮抗作用.文献[13]报道了用荧光素标记的铁载体ferrioxamine B探讨植物根系对细菌铁载体的吸收情况,结果显示根际促生细菌只有定殖植物组织内部或根表时玉米和棉花才能吸收利用铁载体.文献[14]报道了构建一株苜蓿根瘤菌的嗜铁素突变株,并检测其结瘤作用,结果显示与野生株相比突变株的固氮作用明显降低,表明根瘤菌的固氮作用也依赖于根瘤菌铁载体的合成,因为固氮酶活性的维持需要铁.从上述研究结果可以看出,嗜铁素的存在对于根际细菌和植物无疑具有特殊的意义.笔者利用CAS平板法检测9株绞股蓝根际ACC脱氨酶活性细菌的产生铁载体的能力,结果显示只有4株菌可产铁载体的细菌,但它们的ACC脱氨酶活性显著低于不产铁载体菌株的ACC脱氨酶活性,提示根际细菌的ACC脱氨酶活性和产铁载体能力间可能无相关性.
(3)采用菌液培养接种法对筛选获得的9株ACC脱氨酶活性菌株进行促生效应的检测,结果显示7株菌对水稻幼苗根系的生长发育表现出不同程度的促生作用,其中菌株JDG127的促生作用最为显著,但另2株具有较高ACC脱氨酶活性的菌株JDG126和JDG188没有促生作用,表明具有ACC脱氨酶活性的不同菌种对植物的促生作用及其机制可能有一定的差异.而4株可产铁载体的ACC脱氨酶活性菌株对水稻幼苗根系的促生作用显著高于不产铁载体的ACC脱氨酶活性菌株,表明产生铁载体是植物根际促进宿主生长发育的一个重要途径,并提示根际细菌ACC脱氨酶活性和铁载体活性之间可能没有相关性,但根际促生细菌ACC脱氨酶和铁载体的关系及其作用机制还需要进一步研究.
(4)文献[15]中的研究结果表明,绞股蓝根际细菌、放线菌和氮素生理类群数量随模拟酸雨pH值的降低而明显减少,但未鉴定绞股蓝根际细菌的种属特异性.笔者首次从湖南省吉首市德夯国家级重点风景名胜区绞股蓝根际中分离得到9株ACC脱氨酶阳性细菌,鉴定结果显示9株细菌中有1株属于单胞菌属,1株属于类芽胞杆菌属,1株属于芽孢杆菌属,2株属于肠杆菌属,4株属于不动杆菌属,表明绞股蓝根际ACC脱氨酶阳性细菌具有丰富的种属多样性.CAS平板检测结果显示,9株ACC脱氨酶阳性菌株中只有4株菌能合成铁载体,其中2株为不动杆菌属菌种,1株为芽孢杆菌属菌种,而它们对水稻幼苗根系的促生作用最强,表明铁载体是根际促生细菌的主要促生因子之一.
综上所述,4株具有ACC脱氨酶活性和可产铁载体的菌株对水稻幼苗根系的促生作用明显,下一步将开展这4株菌作为微生物肥料的研发,并进行大田促生试验研究.
[1] KLOEPPER J W,LEONG J,TEINTZE M,et al.Enhanced Plant Growth by Siderophores Produced by Plant Growth Promoting Rizobacteria[J].Nature,1980,286(28):885-886.
[2] VACHERON J,DESBROSSES G,BOUFFAUD M L,et al.Plant Growth-Promoting Rhizobacteria and Root System Functioning[J].Frontiers in Plant Science,2013,4:356.
[3] GLICK B R,PENROSE D M,LI J P.A Model for the Lowering of Plant Ethylene Concentrations by Plant Growth-Promoting Bacteria[J].Journal of Theoretical Biology,1998,190(1):63-68.
[4] 吉云秀,黄晓东.植物促生菌对燕麦初生苗盐分胁迫下的促生效应[J].大连海事大学学报,2007,33(3):86-89.
[5] HOLGUIN G,GLICK B R.Expression of the ACC Deaminase Gene from Enterobacter Cloacae UW4 in Azospirillum Brasilense[J].Microbial Ecology,2001,41(3):281-288.
[6] 黄 盖,高 焓,王 琛,等.ACC脱氨酶活性菌株ACC30的分离、鉴定及其促生作用[J].微生物学通报,2013,40(3):812-821.
[7] PENROSE D M,GLICK.Methods for Isolating and Characterizing ACC Deaminase-Containing Plant Growth-Promoting Rhizobacteria[J].Physiologia Plantarum,2003,118(1):10-15.
[8] SCHWYN B,NEILANDS J B.Universal Chemical Assay for the Detection and Determination of Siderophores[J].Analytical Biochemistry,1987,160(1):47-56.
[9] HONMA M,SHIMOMURA T.Metabolism of 1-Aminocyclopropane-1-Carboxylic Acid[J].Agricultural and Biology Chemistry,1978,42(10):182501931.
[10] 沈 萍,闫淑珍,陈双林,等.具ACC脱氨酶活性的植物内生细菌对辣椒的促生作用和对疫霉病的防治作用[J].植物保护学报,2008,35(1):28-35.
[11] 龚凤娟,恩特马克·布拉提白,张宇凤,等.具有ACC脱氨酶活性的杜仲内生细菌的分离鉴定及其抗菌活性[J].微生物学通报,2011,38(10):1 526-1 532.
[12] MARLA G T R,SANDRA A V P,JAIME B C,et al.Isolation of Enterobacteria,Azotobactersp. andPseudomonassp.,Producers of Indole-3-Acetic Acid and Siderophore,from Colombian Rice Rhizosphere[J].Revista Latinoamericana de Microbiologia,2000,42:171-176.
[13] BAR-NESS E,HADAR Y,CHEN Y,et al.Iron Uptake by Plants from Microbial Siderophores[J].Plant Physiology,1992,99:1 329-1 335.
[14] GILL P R,BARTON L L,SCOBLE M D,et al.A High Affinity Iron Transport System of Rhizobium Meliloti may be Required for Efficient Nitrogen Fixation in Planta[J].Plant and Soil.,1991,130:211-217.
[15] 司美茹,苏 涛,赵云峰.模拟酸雨与重金属符合胁迫对绞股蓝生长及根际微生物的影响[J].生态与农村环境学报,2011,27(2):69-74.
(责任编辑 陈炳权)
IsolationandPlantGrowth-PromotingAbilityofACCDeaminase-ContainingBacteriafromRhizosphereofGynostemmaPentaphyllumMakino
SONG Jinqiu,NAZIERBIEKE Wulumuhan,ZHANG ti,BORRATHYBAY Entomack
(College of Biology and Environmental Sciences,Jishou University,Jishou 416000,Hunan China)
A total of 9 bacterial strains were isolated from rhizosphere ofGynostemmapentaphyllumthrough enrichment on 1-aminocyclopropane-1-carboxylate (ACC) as a sole nitrogen source.ACC deaminase assay showed that all isolates differed in their potential for ACC deaminse activity,among which 3 strains were positive for siderosphere by chrome azurol S (CAS) assay.Inoculation of rice seedlings with 7 ACC deaminase-containing strains had significant effect on root elongation and root fresh weight,among which the strain JDG127 caused 1.6-fold increase in root length and root fresh weight over uninoculated control.Based on the physiological and biochemical characteristics in combination with 16S rRNA gene sequences analysis,the 9 ACC deaminase- containing strains were identified asStenotrophomonas(1 strain),Paenibacillus(1 strain),Bacillus(1 strain),Enterobacter(2 strains) andAcinetobacter(4 strains).The results indicated that the siderosphere producing ability of rhizobacteria may be correlated with their plant growth-promoting ability when compared to their ACC-deaminase activity.
Gynostemmapentaphyllum;rhizobacteria;ACC deaminase;growth-promoting ability
1007-2985(2014)05-0043-08
2014-06-15
生态旅游湖南省重点实验室开放基金资助项目(JDSTLY201202);国家自然科学基金资助项目(31260039)
宋金秋(1982—),女,湖南吉首人,吉首大学生物资源与环境科学学院硕士生,主要从事微生物生态学研究
恩特马克·布拉提白(1961—),男,新疆人,吉首大学生物资源与环境科学学院教授,博士,主要从事动物病原微生物学研究;E-mail etmkb@jsu.edu.cn.
R285.5
B
10.3969/j.issn.1007-2985.2014.05.011

