人脐带间充质干细胞治疗热烟雾致急性肺损伤的实验研究
李嫣 樊毫军 侯世科 丁辉


DOI:10.3760/cma.j.issn.1671-0282.2014.09.013
基金项目:武警总部科研课题(WJHQ2010-08)
作者单位:300162 天津,中国人民武装警察部队后勤学院附属医院呼吸科(李嫣),医教部(樊毫军、侯世科、丁辉)
通信作者:樊毫军,Email:fanhaojun999@126.com
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是指严重感染、创伤、休克等打击后,出现以肺泡毛细血管损伤导致肺水肿和肺不张为病理特征的综合征[1]。中重度热烟雾致吸入性肺损伤作为一种特殊类型的ALI/ARDS,目前治疗仍然主要是肺保护性通气、液体支持疗法、控制感染、抗炎因子、應用皮质激素和血管扩张剂等的治疗,其病死率仍在23%以上[2]。美国国家健康组织估计ARDS/ALI的发病率约有75/100 000,病死率甚至高达40%~60%[3]。肺损伤主要是血清和肺泡腔内促炎因子如IL-6、IL-8、TNF-α、IL-1β的升高[4],伴有肺泡上皮细胞、内皮的损伤以及肺泡毛细血管屏障的减弱。脐带源性间充质干细胞(mesenchymal stem cells,MSCs)不但能够成为骨髓MSCs的理想替代物,而且具有来源丰富、取材方便,MSCs含量丰富、获得率高,多向分化潜能、增殖能力强和低免疫原性、低病毒感染率等优点;同时还克服了骨髓源MSCs随年龄增长或老化而增殖能力和分化能力下降[5]等缺点。因此,本文将通过研究人脐带间充质干细胞( human umbilical cord derived mesenchymal stem cells,u-MSCs)移植于热烟雾致肺损伤大鼠的组织修复机制,为人ALI的治疗提供新的治疗方案。
1 材料与方法
1.1 实验动物
健康雄性SPF级Wistar大鼠72只,体质量(200±10)g,由北京华阜康生物科技股份有限公司提供。
1.2 实验设备
荧光倒置显微镜(奥林巴斯 IX71),全自动脱水机(久圣,JTS-120P),组织包埋机(久圣,JBM-B),轮转式石蜡切片机(莱卡,RM2245),组织挪片机(久圣,TP-D),组织烘片机(久圣,HP-D),无菌解剖剪、镊子、手术刀、眼科剪等(上海医疗器械(集团)有限公司手术器械厂)
1.3 实验试剂
5-溴脱氧尿嘧啶核苷(BrdU)、SP组化试剂盒(北京优博奥公司)、DAB显色试剂盒(博士德生物工程有限公司)、兔抗鼠水通道蛋白-5(aquaporin,AQP-5)、兔抗鼠碱性磷酸酶(alkaline phosphatase,AKP)、兔抗鼠角蛋白(武汉博士德)、Polymer免疫组化双染试剂盒DS-0001(北京中杉金桥生物技术有限公司)、4%中性多聚甲醛固定液(Solarbio)。
1.4 实验方法
64只大鼠随机(随机数字法)分为A组正常对照组,静注生理盐水1 mL;B组实验对照组,静注1×106个u-MSCs的PBS 1 mL;C/D组热烟雾吸入损伤后2 h 静注/经气管滴入PBS 1 mL;E/F组热烟雾吸入损伤后2 h 经静脉注射/经气管滴入含1×106个u-MSCs的PBS 1 mL。致伤前每只大鼠自由摄食、饮水及活动。参照文献[6]制备热烟雾致大鼠ALI模型,并参照该文献评估致伤模型是否成功,致伤成功2 h后经气管及静脉注射三代u-MSCs(u-MSCs由武警总医院中心实验室细胞培养室赠送),移植前用荧光染料BrdU(10 mg/L)与三代u-MSCs 共培养72 h,并经细胞爬片免疫组化证实标记是否成功。
1.5 实验取材及检测指标
各组分别在移植u-MSCs后12 h、24 h、1周时间点分别处死4只。(1)标本留取:开胸,迅速取气管、肺及心肝肾,甲醛固定,常规石蜡包埋、切片,HE染色,倒置显微镜观察。参照文献[7]进行肺损伤Smith评分。对肺不张、肺水肿、肺泡及间质出血、肺泡及间质炎症和透明膜,依次行0至4分计分:正常记为0分,病变范围小于1/4记为1分、1/4至1/2之间记为2分、1/2至3/4之间记为3分、整个视野记为4分,上述5项之和记为总肺损伤评分。每个标本取10个视野(×400倍),取其均数。(2)免疫组化染色显示u-MSCs在大鼠体内分布:将切片浸在3%H2O2新鲜配制的甲醇溶液中孵育,高压抗原修复,加入足量两种一抗混合物于切片上(BrdU、人水通道蛋白5、碱性磷酸酶、以及角蛋白抗体稀释度均为1∶ 100),孵育。每张切片加入混合二抗,湿盒中室温孵育。滴加DAB液,镜下观察切片显色情况。滴加AP-Red工作液,孵育后,镜下观察显色情况。滴加封片剂,水平放置,完全变干后显微镜观察并拍照。
1.6 统计学方法
计量资料均以均数±标准差(x±s)表示,采用SPSS 17.0统计软件包进行统计描述、数据处理。不同时间点各组比较采用重复测量的方差分析;同一时间点不同组之间的比较采用单因素方差分析,两两比较采用最小显著差法(LSD-t)。以P<0.05为差异具有统计学意义。
2 结 果
2.1 大鼠气管、肺及心肝肾病理观察
给予u-MSCs对正常大鼠肺脏无明显影响,A、B两组在三个时间点镜下观肺、气管、心肝肾属于正常结构。而热烟雾吸入后u-MSCs移植可显著改善肺病理性损伤,12 h、24 h、1周肺组织逐渐好转。经气管及静脉输入u-MSCs组在12 h、24 h均表现为可见少量支气管上皮细胞脱落至肺泡腔内,肺泡及支气管周围的中性粒细胞浸润较损伤组减少。气管黏膜上皮少许脱落,并可见少许血管扩张。1周肺泡融合较损伤组减少,肺泡间隔变宽不明显,肺水肿和肺不张也较损伤组改善。肺泡腔内中性粒细胞和红细胞数量较损伤组明显减少。气管结构相对更加完整,上皮脱落数量明显减少,炎症细胞浸润也明显减少,较损伤组明显减轻。
各时间点肺组织损伤评分见表1。方差齐性检验提示方差齐(F=0.680,P=0.554)。其中A与B组评分组间差异无统计学意义(P>0.05 );而E组较C组低、F组较D组低、E组较F组低、差异均具有统计学意义(P<0.05 )。
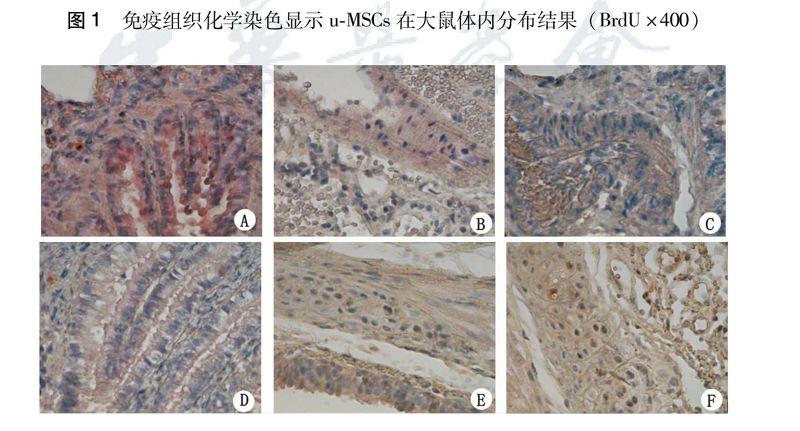
2.2 免疫组织化学染色显示u-MSCs在大鼠体内分布
ABCD组未见阳性细胞(BrdU标记u-MSCs阳性即细胞核呈棕褐色)。E组和F组显示出BrdU标记的u-MSCs在热烟雾致肺损伤后2 h 经静脉和气管移植入大鼠体内,在12 h时间点能在损伤的肺和气管组织中找到少量阳性细胞;1周阳性细胞数依次较24 h多;在1周正常的心、肝、肾组织中可观察到少许阳性细胞(图1)。
2.3 免疫组织化学双染色显示u-MSCs分化为肺泡上皮细胞
在E、F组1周可见AQP-5、AKP、角蛋白和BrdU双染阳性细胞,即肺泡Ⅰ型、Ⅱ型上皮细胞膜和气管上皮细胞膜染为红色,细胞核染为棕黄色,说明u-MSCs在肺内能分化为肺泡Ⅰ型、Ⅱ型上皮细胞,在气管内能分化为气管上皮细胞(图2)。
3 讨论
迄今研究表明,ALI/ARDS的重要病理特征是肺血管通透性增加造成的肺水肿。肺泡上皮细胞的肺泡液体清除作用(alveolar fuid clearance,AFC)是机体清除肺泡内多余液体的重要途径,肺泡Ⅰ型和Ⅱ型上皮细胞,尤其是后者与AFC关系最为密切。Matthay和Wierer[8]第一次临床证实ALI/ARDS患者存在AFC功能障碍。因此,热烟雾吸入致大鼠ALI/ARDS的主要治疗应该是肺的功能细胞AT Ⅰ和AT Ⅱ以及气管、支气管的修复治疗。本实验采用免疫组化双染色,分别选择了AT Ⅰ和AT Ⅱ及气管上皮的特征性标记物水通道蛋白-5(AQP-5)、碱性磷酸酶、角蛋白(keratin)进行检测。综合考虑实验结果,认为u-MSCs可能通过以下方面发挥作用: (1)在体内能分化为肺泡Ⅰ型上皮细胞;(2)还可能分化为肺泡Ⅱ型上皮细胞;(3)在气管内能分化为气管上皮细胞;即u-MSCs移植能促进肺泡Ⅰ型和Ⅱ型上皮细胞及气管上皮再生, 促进肺及气管组织恢复。同时,肺损伤大鼠移植u-MSCs后,明显降低肺损伤Smith评分,不仅如此,本研究在u-MSCs移植后1周大鼠ALI模型中,心、肾、组织中均可检测到BrdU标记的阳性细胞,这与国内其他研究相似[9]。但是对于这种表达了阳性细胞的心、肝、肾,笔者目前只进行了病理组织切片,未发现明显异常,对于u-MSCs对心、肝、肾组织的长期影响,以及是否会产生肿瘤组织,尚有待下一步实验研究。
关于u-MSCs促进ALI/ARDS的组织修复的机制,首先是u-MSCs的多向分化潜能和“归巢”机制,学者公认MSCs具有多向分化潜能。大量研究显示MSCs能“归巢”至肺损伤和炎症区域,分化成为肺泡上皮细胞或肺血管内皮细胞等,这是发挥其功能的前提。肺损伤后,坏死肺组织细胞可能通過释放出一系列信号因子,引导表达特异性受体的干细胞移动并黏附于损伤处,这被认为是干细胞“归巢”的最主要机制。基质细胞衍生因子-1(stromal cell derived factors, SDF-1)及其受体CXCR4、受体c-kit、集落刺激因子、血管内皮生长因子和整合素等,大量细胞因子、蛋白水解酶及黏附分子等可能也参与了此过程[10]。Rojas等[11]发现MSCs对博莱霉素所致的肺损伤具有保护作用,同时伴有循环中粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)和粒细胞巨核细胞集落刺激因子(granulocytemegakaryocyte colony stimulating factor,GM-CSF)(两者被认为可以促进内源性干细胞的动员和迁移)的升高及炎性因子的降低,这种保护作用可能与u-MSCs分化为ATⅠ和ATⅡ有关。
实验中,需要决定细胞递送的合适的计量和途径。实验中应用的剂量范围是每个动物(主要是鼠)5×105 到5×106 个细胞,剂量反应并未报道,所以鼠的合适的剂量尚不知。目前有研究证实106是细胞移植较为理想的浓度[12],因此本实验采取经气管及静脉输注1×106个细胞。另外,经静脉和经气管途径注入都被证明有效。每种途径都有优点,经气管途径可以在纤维支气管镜下进行,可以明确瞄准肺内受损的区域。另外,经静脉途径可以提供更大的全身的系统的作用,减轻ALI经常伴有的多器官功能障碍。
但u-MSCs移植的上限浓度及最佳移植浓度, 以及如何保证 u-MSCs移植后的存活率及调节其向肺泡上皮细胞及气管上皮细胞的比例, 使其对热烟雾致肺损伤发挥最佳的修复作用,尚需进一步研究证实。国内有研究证实静脉移植的MSCs能归巢至烟雾吸入性肺损伤炎症反应明显的肺组织和气管组织,并分化成肺泡Ⅰ型、Ⅱ型和肺血管内皮细胞,可能参与了烟雾吸入性损伤的组织修复过程[13]。Ortiz等[14]证明在博来霉素致大鼠ALI后立即气管内或全身输入MSCs能减少随后的胶原沉着、纤维化及基质金属蛋白酶水平。不同时间点向博来霉素致肺损伤的大鼠输注MSCs后均能减轻肺纤维化的程度,而早期输入MSCs效果尤佳。因此本研究在热烟雾致大鼠ALI后2 h给予气管内及静脉输入u-MSCs。Ortiz等[14]实验证明经气管移植MSCs,MSCs在肺的归巢和移植可能会因为透明质酸和骨桥蛋白质与CD44受体的结合而增加。博来霉素处理后可以增加肺组织的透明质酸的表达,在这些条件下,骨桥蛋白质mRNA水平也增加。免疫浸润细胞释放的细胞因子和丝裂原可能影响归巢、移植和MSCs的增殖状况。最后,博来霉素毒性致微血管系统的破坏也提供了一个非特异性机制,即MSCs获得了与肺组织的接触的增加。
综上所述,u-MSCs促进并参加ALI/ARDS的肺组织的修复过程,尽管这一机制的研究尚不深入,但是修复后的肺泡上皮细胞的液体清除率及气体交换功能是否保留,或者这种功能是增加还是减退,尚需要进一步探索证实。
参考文献
[1]樊毫军,刘书盈,张健鹏,等.静脉注射内毒素致大鼠急性肺损伤模型的病理生理学指标评价[J].中国危重病急救医学,2006,18(8):485-487.
[2] Demling RH.Smoke inhalation lung injury:an update[J].Eplasty,2008,8:e27.
[3] Ware LB,Matthay MA.The acute respiratory distress syndrome[J].N Engl J Med,2000,342(18):1334-1349.
[4] 樊毫军,张健鹏,刘又宁,等.全氟化碳对肿瘤坏死因子攻击下肺泡上皮细胞产生IL-8水平的影响[J].中华医学杂志,2006,86(15):1075-1076.
[5] Rao MS,Mattson MP.Stem cells and aging:expanding the possibilities[J].Mech Ageing Dev,2001, 122(7):713-734.
[6] 宋建奇,樊毫军,侯世科,等.热烟雾吸入性损伤肺组织水肿与肿瘤坏死因子-α水平的相关性分析研究[J].中国急救复苏与灾害医学杂志,2011,6 (6):510-513.
[7]Smith KM, Mrozek JD, Simonton SC,et al. Prolonged partial liquid ventilation using conventional and high -frequency ventilatory techniques:Gas exchange and lung pathology in animal model of respiratory distress syndrome[J].Crit Care Med,1997,25(11):1888-1897.
[8]Matthay MA,Wiener JP.Intact epithelial function is critical for the resolution of alveolar edema in humans[J]. Am Rev Respir Dis,1990,142(6 Pt 1):1250-1257.
[9] 梁璐,陈小军,吴昊,等.人脐带间充质干细胞在小鼠体内的迁移变化及宿主的免疫反应[J].郑州大学报(医学版),2010,45(1):33-36.
[10]朱峰.骨髓间充质干细胞移植对烟雾吸入性损伤炎症反应及组织修复的影响[D]. 南昌:南昌大学,2010.
[11]Rojas M, Xu J, Woods CR, et al. Bone marrow-derived mesenchymal stem cells in repair of the injured lung[J].Am J Respir Cell Mol Biol, 2005, 33 (2):145-152.
[12]趙鹏,冯世庆,王颖,等.不同浓度人脐带间充质干细胞移植修复大鼠脊髓损伤的实验研究[J].中国矫形外科杂志,2010,18(21):1817-1821.
[13]朱峰,郭光华,陈任生,等.骨髓间充质干细胞在烟雾吸入性损伤家兔体内向功能细胞分化的观察[J].中国烧伤杂志,2011,27(2):150-155.
[14] Ortiz LA,Gambelli F,McBride C,et al.Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effect[J].Proc Natl Acad Sci U S A,2003,100(14):8407 -8411.
(收稿日期:2014-01-30)
(本文编辑:郑辛甜)
P1001-1005

