microRNA-1诱导大鼠骨髓间充质干细胞向心肌样细胞分化过程中Notch信号分子的表达变化
邓海燕,曾俊义,魏云峰,,王梦洪,,郑泽琪,,张 婉,文 通
(南昌大学 第一附属医院 1.心血管内科; 2.江西省高血压病研究所, 江西 南昌 330006)
研究论文
microRNA-1诱导大鼠骨髓间充质干细胞向心肌样细胞分化过程中Notch信号分子的表达变化
邓海燕1,曾俊义2*,魏云峰1,2,王梦洪1,2,郑泽琪1,2,张 婉2,文 通1
(南昌大学 第一附属医院 1.心血管内科; 2.江西省高血压病研究所, 江西 南昌 330006)
目的探讨微小RNA-1对大鼠骨髓间充质干细胞向心肌样细胞分化的影响及分化过程中Notch信号分子的表达变化。方法全骨髓贴壁培养法分离培养大鼠MSCs并进行流式细胞学鉴定,miR-1慢病毒载体感染大鼠MSCs(MSCsmiR-1)按培养时间将细胞分成4组:对照组、培养4、6和15 d组;光镜下观察细胞形态变化,qPCR检测miR-1及心肌细胞特异性基因GATA-4、cTnI、α-actin表达,免疫荧光检测cTnI表达,Western blot检测α-actin表达;qPCR检测Notch信号通路相关基因的表达变化。结果原代大鼠MSCs呈长梭形、漩涡状生长,98%以上细胞表达CD44和CD29,不足1%的细胞表达CD45。MSCsmiR-1中miR-1表达水平持续上升,同时伴随心肌特异性基因GATA-4、cTnI和α-actin的表达逐渐增强,感染4 d后可见cTnI在部分MSCsmiR-1中表达,同时可检测到α-actin在MSCsmiR-1中表达;MSCsmiR-1向心肌样细胞分化过程中,Notch信号分子Jagged1、Notch1、Notch3和Hey2表达水平逐渐下调,于15 d时下调幅度最大。结论传导miR-1至大鼠MSCs中可促使其向心肌样细胞的分化;且分化过程中伴随着Notch信号分子Jagged1-Notch1/Notch3-Hey2表达水平下调。
miR-1;骨髓间充质干细胞;心肌样细胞;Notch
微小RNA(microRNAs,miRNAs)作为生命过程中一类重要的调控因子成为近年来的一大研究热点。研究表明, miRNAs在一系列生物学行为比如干细胞增殖、干细胞分化中起着非常重要的作用[1]。在众多miRNAs中存在一类肌相关miRNAs,包括miR-1、miR-133、miR-206和miR-499等,其中以肌特异性miR-1的生物学作用尤为引人关注[2- 3]。目前认为,miR-1主要存在于脊椎动物的心脏组织中,在机体的心脏发育及心肌细胞的分化成熟过程中发挥着重要的调控作用[4]。因此,本研究通过miR-1慢病毒载体感染大鼠(mesenchymel stem cells,MSCs),探讨miR-1对MSCs向心肌样细胞分化的影响及分化过程中notch信号分子的表达变化,以期阐明MSCs向心肌样细胞分化的相关机制。
1 材料与方法
1.1 材料
4周龄清洁级Wistar大鼠,体质量100~150 g,雌雄不限[江西中医学院实验动物中心,许可证号: SCXK(赣) 200520001]。α-MEM培养基和EDTA胰蛋白酶(Gibco公司),胎牛血清(Hyclone公司),仓鼠抗CD29单克隆抗体、小鼠抗CD44 单克隆抗体和小鼠抗CD45单克隆抗体(eBioscience公司),miR-1重组慢病毒载体(上海吉凯基因化学技术有限公司),反转录试剂盒、qPCR检测试剂盒和miRNA qRT-PCR检测试剂盒(GeneCopoeia公司),兔抗心肌肌钙蛋白I多克隆抗体(Santa Cruz公司),小鼠抗心肌肌动蛋白α(武汉博士德公司),小鼠抗β-actin多克隆抗体(北京中杉金桥生物技术有限公司)。miR-1及U6引物来自GeneCopoeia公司(RmiRQP1188, RmiRQP9003)。
1.2 方法
1.2.1 大鼠MSCs分离、扩增培养及鉴定:颈椎脱臼法处死大鼠,无菌条件下取出股骨和胫骨,剪除两端干骺端,用含10%胎牛血清的α-MEM培养基冲洗骨髓腔,制成细胞悬液,以1×109/L接种于25 cm2培养瓶中, 放置37 ℃、5% CO2培养箱中培养。24 h后可见少量贴壁细胞,48 h后第1次换液去除非贴壁细胞,此后每3天换液1次,待贴壁细胞达到80%~90%汇合时,0.25% EDTA胰蛋白酶消化传代,培养至第3代时用于实验。实验前取适量第3代MSCs进行流式细胞学检测,选取细胞表面标志物CD29、CD44和CD45作为检测指标,以确定细胞纯度。
1.2.2 重组慢病毒载体感染大鼠MSCs及实验分组:预先构建miR-1重组慢病毒载体,感染前1天将细胞以4×104/孔接种到12孔板中,并加入常规培养基培养,当细胞的汇合率约为30%时按感染复数(MOI)50进行感染,同时加入终浓度为8 μg/mL的polybrene[5],放回培养箱孵育。24 h后更换正常培养基继续培养。按培养时间将细胞分成对照组、培养4、6和15 d组。倒置荧光显微镜下观察绿色荧光蛋白(GFP)表达情况,评价慢病毒感染效率。提取细胞总RNA,经纯度及浓度测定后行qPCR检测miR-1,总RNA提取、cDNA合成及qPCR均按试剂说明书进行。数据采集由ABI7500完成。miR-1的检测以U6作内参,以2-△△Ct比较miR-1表达水平。
1.2.3 检测心肌特异性基因的表达:取各组细胞进行总RNA提取、cDNA合成及qPCR反应,分别按试剂说明书进行。GATA-4:上游引物5′- CTGTGCCA ACTGCCAGACTA -3′,下游引物5′-AGATTCTTGGG CTTCCGTTT-3′,165 bp;α-actin:上游引物5′-AGCC ATGTACGTAGCCATCC-3′,下游引物5′-CTCTCAGC TGTGGTGGTGAA-3′,228 bp;cTnI:上游引物5′-CCT GCGTGGCAAGTTTAA-3′,下游引物5′-TTCCTTCTC AATGTCCTCCT-3′,94 bp;GAPDH:上游引物5′-CTC ATGACCACAGTCCATGC-3′,下游引物5′-TTCAGC TCTGGGATGACCTT-3′,155 bp。
1.2.4 细胞免疫荧光检测cTnI的表达:收集各组细胞爬片行细胞免疫荧光检测。弃去培养液, PBS冲洗, 4%多聚甲醛4 ℃固定20 min, 1%牛血清白蛋白(BSA)室温30 min封闭非特异性抗原,1∶100稀释的兔抗大鼠cTnI多克隆抗体于4 ℃孵育过夜,1∶200稀释的TRITC标记羊抗兔IgG于37 ℃孵育1 h。封片后倒置荧光显微镜下观察。实验中用PBS代替一抗作阴性对照。
1.2.5 Western blot检测α-actin的表达:分别收集各组细胞,提取总蛋白并用BCA法测定蛋白浓度。取50 μg处理的蛋白样品进行聚丙烯酰胺凝胶电泳,半干转条件下以恒流将蛋白样品从胶转移至NC膜上。5%脱脂奶粉室温振荡封闭1 h, 加入适当稀释的一抗(α-actin浓度为1∶500,β-actin浓度为1∶1 000),4 ℃过夜;根据一抗来源选择辣根过氧化物酶(HRP)标记的二抗,按相应比例稀释后室温下孵育1 h。TBST洗膜后加入发光液显影,使用化学发光成像系统(LAS 4000)进行图像采集及目标条带分析。
1.2.6 Real time qPCR检测Notch信号分子表达变化:分别取各组细胞进行总RNA提取、cDNA合成及qPCR反应,分别按试剂说明书进行。Notch信号通路相关基因引物见(表1)。
1.3 统计学分析
2 结果
2.1 大鼠MSCs分离培养与鉴定
MSCs接种24 h后少量开始贴壁,细胞形态均一,呈梭形或多角形。48 h后首次换液去除未贴壁细胞,3~4 d后可见放射状排列的细胞集落,伸出长短不一、粗细不均的突起,梭形细胞为主(图1A)。5 d时细胞集落生长范围扩大,汇合80%~90%,经胰蛋白酶消化传代后均匀铺于瓶底,呈漩涡状同向排列(图1B)。第3代大鼠MSCs均一表达CD44和CD29,阳性率分别为98.03%,99.00%,而CD45呈阴性表达,阳性率仅为0.02%,证实培养所获细胞为MSCs,且纯度较高(图2)。

表1 Notch信号通路相关基因引物序列

A .primary rat MSCs(×100);B.the third passage of rat MSCs(×100)图1 大鼠MSCsFig 1 Micrographs of rat MSCs
2.2重组慢病毒载体感染大鼠MSCs效率及miR-1表达检测
慢病毒感染大鼠MSCs第2天即可观察到部分细胞表达GFP,细胞形态变化不明显,随培养时间推移,GFP阳性细胞逐渐增多,GFP表达逐渐增强,至4 d时绿色荧光蛋白表达基本达到稳定,其后持续高表达,感染效率达90%以上。到15 d时仍可见绿色荧光表达,部分细胞形态呈多角、短梭形变化(图3)。miR-1表达水平随时间逐渐增高,到15 d时MSCsmiR-1中miR-1表达量达到最高(表2)。
2.3 心肌特异性基因的表达变化
心肌特异性蛋白cTnI和α-actin只在诱导后的细胞中表达,表达水平逐渐上升,15 d时达到高峰;转录调控因子GATA-4在分化过程中的第4天表达水平稍下降,以后逐渐上升,一直持续到15 d(表3)。

表2 MSCsmiR-1 中miR-1表达变化Table 2 Expression of miR-1 in MSCsmiR-1
*P<0.01 compared with day 4.
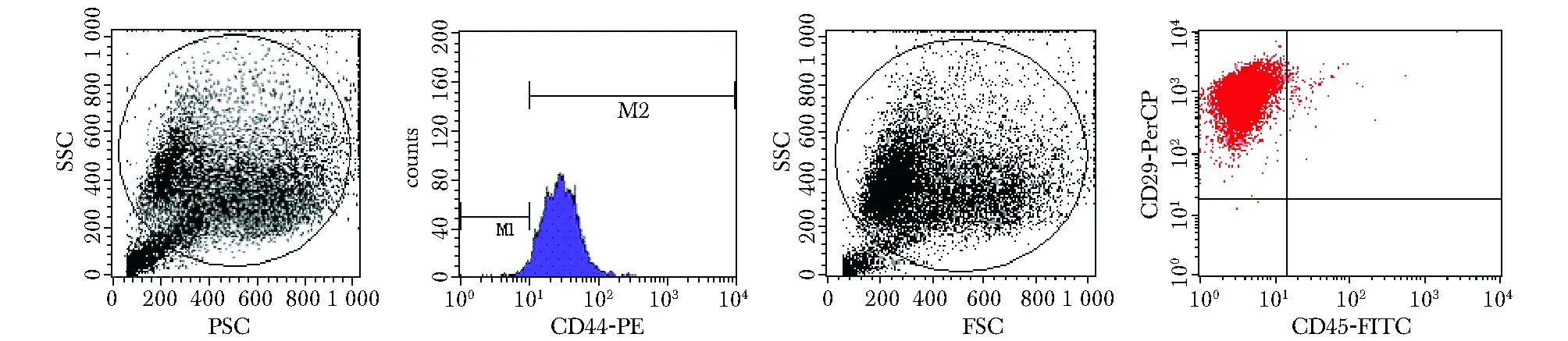
More than 98% of the MSCs population expressed CD44 and CD29,less than 1% cells were CD45 positive图2 流式细胞检测大鼠MSCs表面标志物Fig 2 Identification of MSCs phenotype by flow cytometry

A.control group;B.4-day group;C.6-day group;D.15-day group图3 MSCsmiR-1中GFP的表达Fig 3 GFP expression of MSCsmiR-1(×100)
2.4 免疫荧光检测cTnI的表达
感染后的MSCsmiR-1细胞体积较前变长和宽大,形成类似肌管样的形态特点。MSCsmiR-1于感染后第
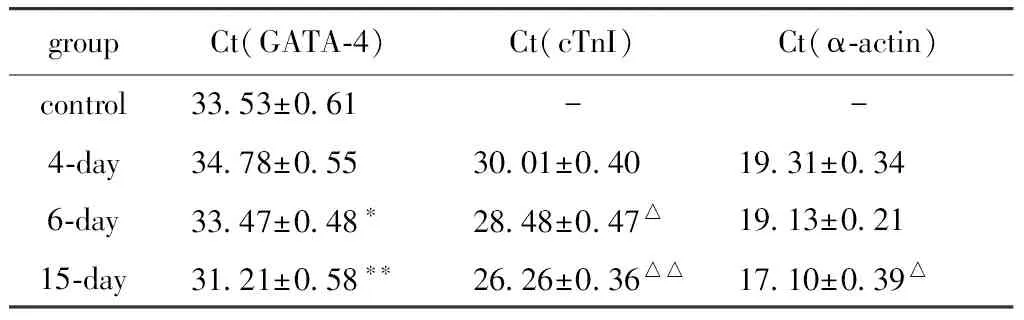
表3 MSCsmiR-1心肌特异性基因的表达变化
*P<0.05,**P<0.01compared with control;△P<0.05,△△P<0.01 compared with day 4.4天开始少量表达cTnI,随着培养时间的延长,阳性率逐渐增加(图4)。
2.5 Western blot检测α-actin的表达
感染前大鼠MSCs不表达α-actin。感染4 d时α-actin蛋白呈弱表达,到第6天表达明显增强,并持续高表达至第15天(图5)。
2.6 Notch信号分子表达变化
大鼠MSCs原代细胞高水平表达Notch1、Jagged1、Hey1和Hey2,中等表达Dll1、Dll3、Dll4、Notch2、Notch3和Notch4,下游靶基因Hes1和Hes5在肌分化过程中等量持续表达。miR-1重组慢病毒感染MSCs后,Jagged1、Notch1、Notch3和Hey2表达水平随着观察时间的延长而逐渐下调,其中配体Jagged1的含量下调最显著 (表4)。而配体Dll1、Dll3和Dll4,受体Notch2和Notch4及靶基因Hes-1、Hes-5和Hey-1表达水平虽有波动,但无显著性差异(表5)。
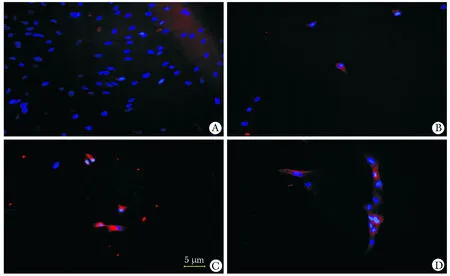
A.control group; B.4-day group; C.6-day group; D.15-day group图4 MSCsmiR-1中cTnI的表达Fig 4 Expression of cardiomyocyte-specific cTnI in MSCsmiR-1(×100)

*P<0.01 compared with control图5 MSCsmiR-1中α-actin表达变化Fig 5 Expression of cardiomyocyte-specific α-actin in MSCsmiR-1

groupCt(Jagged1)Ct(Notch1)Ct(Notch3)Ct(Hey2)control 2130±032 2491±042 2399±039 2671±0344⁃day 2283±030∗ 2609±036 2284±048∗ 2807±057∗6⁃day 2316±038∗∗ 2708±046∗∗ 2701±055∗∗ 2703±042∗∗15⁃day 2607±048∗∗ 2728±051∗∗ 2729±049∗∗ 2833±039∗∗
*P<0.05,**P<0.01 compared with control.

表5 Notch信号分子的表达变化Table 5 Expression of genes related to Notch signaling pathway
3 讨论
miR-1作为首个确定的肌相关miRNAs,其调控机体心脏发育过程及心肌细胞分化的作用在一系列相关研究得到证实。敲除miR-1的小鼠心脏祖细胞的增殖明显,而分化成的心肌细胞明显减少[6]。在C2C12肌细胞中过表达miR-1使得早期和晚期心肌相关基因表达增多,明显促进肌生成[7]。本研究结果同样证实miR-1可促使大鼠MSCs向心肌细胞分化,并进一步验证了本实验的前期研究[8],表明miR-1具有决定干细胞向心肌细胞定向分化的作用。
在脊椎动物的心脏发育的不同阶段伴随着Notch信号通路不同组分的时空表达变化,表明Notch信号通路在心脏发育的多个过程中发挥重要的调控作用[9]。本研究中,miR-1重组慢病毒载体感染MSCs后,伴随其向心肌样细胞定向分化过程,Notch信号分子Jagged1、Notch1、Notch3及Hey2表达水平随时间逐渐下调,推测Jagged1-Notch1/Notch3-Hey2介导的Notch信号下调可能参与了miR-1诱导大鼠MSCs的心肌分化过程,并在其中发挥着重要的调控作用。一项关于爪蟾的研究发现,通过Notch1激活内源性Notch信号通路可导致心肌分化标志物cTnI、MHC和α-actin的下调,致使心肌细胞分化成熟障碍,抑制Notch信号通路则相反[10]。因此,心脏分化发育过程中Notch1介导的Notch信号下调具有重要的调控作用。研究中发现Notch3的表达变化与Notch1相一致,推测肌分化过程中Notch3具有类似Notch1的同向作用。关于未成熟心肌细胞的体外分化研究发现,Jagged1通过激活Notch1在未成熟心肌细胞的分化中发挥着重要的调控作用[11]。另一项研究发现Jagged1可激活Notch3启动Notch信号通路调控心肌细胞的分化[12]。尽管实验背景有所不同,但Jagged1激活Notch1/ Notch3介导心肌细胞分化得到证实。Hey2特异性敲除的小鼠出现室间隔缺损、瓣膜发育异常,进一步研究证实Hey2是Notch信号通路的重要效应因子[13]。此外,一项体内研究发现Jagged1和Notch1敲除的小鼠中出现的心肌发育异常与Hey2敲除出现的一致,再次印证了Hey2为Notch信号的下游效应因子[14]。由此可知,Jagged1-Notch1/Notch3-Hey2介导的Notch信号下调在miR-1诱导大鼠MSCs的心肌分化过程中发挥着重要的调控作用。需要指出的是,尽管配体Dll1、Dll3、Dll4,受体Notch2、Notch4及靶基因Hes1、Hes5、Hey1表达水平亦随MSCsmiR-1分化过程而波动,但无显著性差异。虽然上述基因均与心脏发育、胚胎发生有着密切的关系,但在miR-1介导MSCs向心肌细胞分化过程中是否发挥相应的调控作用证据不足,进一步的研究有助于阐明其相关作用。
综上所述,本研究通过miR-1慢病毒载体感染大鼠MSCs,证实miR-1可促使MSCs向心肌细胞分化,在此过程中Jagged1-Notch1/Notch3-Hey2介导的Notch信号下调发挥着重要的调控作用。研究不仅为实现MSCs定向分化为心肌细胞找到了一条新途径,同时对其分化机制也进行了初步有益的探讨。相信随着研究的深入,MSCs向心肌细胞分化的相关机制将逐步阐明,干细胞低分化效率的瓶颈也终将突破,进而实现干细胞治疗技术的广泛应用。
[1] Leonardo TR, Schultheisz HL, Loring JF,etal. The functions of microRNAs in pluripotency and reprogramming[J].Nat Cell Biol,2012,14:1114- 1121.
[2] Townley-Tilson WH, Callis TE, Wang D. MicroRNAs 1, 133, and 206: critical factors of skeletal and cardiac muscle development, function, and disease[J]. Int J Biochem Cell Biol,2010,42:1252- 1255.
[3] Sluijter JP, van Mil A, van Vliet P,etal. MicroRNA-1 and -499 regulate differentiation and proliferation in human-derived cardiomyocyte progenitor cells[J]. Arterioscler Thromb Vasc Biol, 2010, 30:859- 868.
[4] Zhao Y, Samal E, Srivastava D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature, 2005, 436: 214- 220.
[5] Ricks DM, Kutner R, Zhang XY,etal. Optimized lentiviral transduction of mouse bone marrow-derived mesenchymal stem cells[J]. Stem Cells Dev, 2008, 17:441- 450.
[6] Zhao Y, Ransom JF, Li A,etal. Dysregulation of cardiogenesis, cardiac conduction, and cell cycle in mice lacking miRNA-1-2[J]. Cell, 2007,129:303- 317.
[7] Chen JF, Mandel EM, Thomson JM,etal. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J]. Nat Genet, 2006,38: 228- 233.
[8] 文通,魏云峰,王梦洪,等.microRNA-1诱导大鼠骨髓间充质干细胞向心肌样细胞分化[J].基础医学与临床,2011,31:41- 46.
[9] MacGrogan D, Nus M, Pompa JL. Notch signaling in cardiac development and disease [J]. Curr Top Dev Biol, 2010, 92: 333- 365.
[10] Rones MS, McLaughlin KA, Raffin M,etal. Serrate and Notch specify cell fates in the heart field by suppressing cardiomyogenesis [J]. Development, 2000, 127: 3865- 3876.
[11] Sassoli C, Pini A, Mazzanti B,etal. Mesenchymal stromal cells affect cardiomyocyte growth through juxtacrine Notch-1/Jagged-1 signaling and paracrine mechanisms: clues for cardiac regeneration [J]. J Mol Cell Cardiol, 2011, 51:399- 408.
[12] Li H, Yu B, Zhang Y,etal. Jagged1 protein enhances the diffe- rentiation of mesenchymal stem cells into cardiomyocytes [J]. Biochem Biophys Res Commun, 2006, 341:320- 325.
[13] Fischer A, Schumacher N, Maier M,etal. The Notch target genes Hey1 and Hey2 are required for embryonic vascular development [J]. Genes Dev, 2004, 18:901- 911.
[14] McBride KL, Riley MF, Zender GA,etal. Notch1 mutations in individuals with left ventricular outflow tract malformations reduce ligand-induced signaling [J]. Hum Mol Genet, 2008, 17: 2886- 2893.
Expression of Notch signaling moleculesin the process of microRNA-1 inducing rat bone marrowmesenchymal stem cells into cardiomyocyte-like cells
DENG Hai-yan1, ZENG Jun-yi2*, WEI Yun-feng1,2, WANG Meng-hong1,2, ZHENG Ze-qi1,2, ZHANG Wan2, WEN Tong1
(1.Dept of Cardiology;2.Jiangxi Institute of Hypertension,the First Affiliated Hospital of Nanchang University,Nanchang 330006,China)
ObjectiveTo investgate the effect of miR-1 on MSCs differentiation into cardiac phenotypes and the expression changes of Notch signaling molecules in this process.MethodsMSCs were isolated from rat bone marrow by the whole bone marrow adherence method; MSCs were introduced by the lentiviral vectors expressing miR-1(MSCsmiR-1),which were then divided into four groups: control group, 4-day culture group, 6-day culture group,15-day culture group;The cell morphology was examined by light microscopy, miR-1 and cardiomyocyte-specific genes including GATA- 4, cTnI and α-actin were examined by real-time qPCR, and the expression of cTnI and α-actin was detected by immunofluorescence and Western blot respectively;Meanwhile, MSCsmiR-1cells were detected for the expression of genes related to notch signaling pathway by qPCR.ResultsIsolated MSCs displayed a stable spindle-phenotype and showed characteristic swirling growth. More than 98% of the MSCs population expressed CD44 and CD29 for MSCs phenotype; Meanwhile, less than 1% cells were CD45 positive. MSCsmiR-1highly expressed miR-1 and showed a higher expression of cardiomyocyte-specific genes, including GATA-4, cTnI and α-actin, cTnI was detected by immunofluorescence in MSCsmiR-1after miR-1 transduction for 4 days, and gradually increased afterwards. Western blot further confirmed the expression of α-actin in MSCsmiR-1. The mRNA expression of Jagged1,Notch1,Notch3 and Hey2 reduced significantly in MSCsmiR-1during its differentiation into cardiomyocyte-like cells,and reached the minimum on day 15.ConclusionsTransduction of miR-1 into rat MSCs induce cell differentiation into cardiomyocyte-like cells,which is in company with down-regulation mRNA expression of Jagged1- Notch1/ Notch3-Hey2 in the Notch pathway.
miR-1; MSCs;cardiomyocyte-specific cells;notch
2013- 11- 18
2014- 03- 28
江西省自然科学基金(2010GZY0321);江西省科技支撑计划(2010BSA11700);江西省教育厅青年科学基金(GJJ12153);江西省卫生厅科技计划(20111021)
*通信作者(correspondingauthor):zjy1312@163.com
1001-6325(2014)09-1204-07
R 542.2
A

