microRNA- 34c调控c-Met抑制肝细胞癌的发生发展
于晓剑,王 燕,李瑞峰,李 莉,刘玉刚
(山东大学 医学院 病理学与病理生理学研究所,山东 济南 250012)
研究论文
microRNA- 34c调控c-Met抑制肝细胞癌的发生发展
于晓剑,王 燕,李瑞峰,李 莉,刘玉刚*
(山东大学 医学院 病理学与病理生理学研究所,山东 济南 250012)
目的探讨 microRNA- 34c及其靶基因c-Met在原发性肝癌发生发展中的作用。方法荧光定量PCR及Western blot分别检测人的肝癌组织及癌旁组织中 microRNA- 34c与c-Met蛋白的表达、细胞系HepG2.2.15转染 microRNA- 34c后c-Met mRNA 及蛋白的表达、细胞系HepG2.2.15转染microRNA- 34c或c-Met干扰RNA后P53蛋白的表达。建立裸鼠成瘤模型并进行瘤内注射治疗,测量计算肿瘤体积。结果microRNA- 34c在人的肝癌组织中表达比癌旁组织明显降低(P<0.01),c-Met在肝癌组织中表达较癌旁组织升高。HepG2.2.15细胞系中转染microRNA- 34c后c-Met表达降低(P<0.01)。HepG2.2.15细胞系中转染microRNA- 34c及c-Met干扰RNA后P53表达升高(P<0.05)。成瘤裸鼠经microRNA- 34c质粒瘤内注射后肿瘤体积较对照组明显减小(P<0.05)。结论microRNA- 34c可能通过调节其靶基因c-Met的表达抑制原发性肝癌的发生和发展。
原发性肝癌;微小RNA- 34c;肝细胞生长因子受体;P53
肝细胞肝癌是最常见的恶性肿瘤之一,并且是世界上肿瘤相关的第三大死因[1]。乙肝病毒感染是肝细胞肝癌发生的重要原因。由于缺少早期的诊断手段,肝细胞肝癌的死亡率高,威胁着人类健康[2]。
microRNA是一种由21~25个核苷酸组成的非编码微小RNA,microRNA可以通过与某些mRNAs接合来影响其翻译过程从而发挥调节某些基因的作用[3]。近年来研究发现,microRNA可以通过调节其靶基因来影响肿瘤的发生与发展[4]。其中,microRNAc- 34是一类重要的抑制肿瘤发生发展的microRNA家族,其在多种肿瘤组织中表达下降。microRNAc- 34家族被认为是P53的直接调节靶点,上调microRNAc- 34可以导致细胞凋亡和细胞周期阻滞[5]。目前,microRNA- 34c有关的研究相对较少,有报道称,microRNA- 34c与干细胞肝癌的的发生与发展有关[6]。本研究探讨 microRNA- 34c调控c-Met在肝细胞肝癌发生发展中的作用。
1 材料与方法
1.1 材料
10组临床标本取自在山东省省立医院肝胆外科行肝癌切除术患者。HepG2.2.15细胞系为山东大学医学院免疫学研究所惠赠。SPF级BALB/C-nu/nu裸鼠,雄性,4~6周龄,体质量17~20 g[北京华阜康生物科技股份有限公司,合格证号:SCXK(京)2009- 0004]
1.2 主要试剂
miRNA合成及定量试剂盒(Invitrogen公司);兔抗人c-Met、P53单克隆抗体(Abcam公司);抗Tubulin、β-actin鼠单克隆抗体(北京康为世纪生物科技有限公司);辣根酶标记山羊抗兔、抗鼠IgG(北京中杉金桥生物技术有限公司);SYBR Green Realtime Pcr Master Mix、cDNA第一链合成试剂盒(Toyobo公司);RNA提取Trizol、转染试剂Lipofectamine2000(Invitrogen公司);c-Met干扰RNA(上海吉玛制药技术有限公司);BCA蛋白浓度测定试剂盒(江苏碧云天生物技术研究所);microRNA- 34c质粒为本实验室保存,实验PCR引物均由上海华大基因提供。
1.3 方法
1.3.1 荧光定量PCR检测临床组织标本中microRNA- 34c的表达:Trizol法提取肝癌组织及癌旁组织总RNA,按说明书反转录为cDNA,并进行荧光定量PCR,反应条件为50 ℃ 2 min, 95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,40个循环,U6为内参。实验结果由2-ΔΔCT公式计算荧光相对计量。
1.3.2 Western blot检测临床组织中c-Met蛋白的表达:RIPA/PMSF法提取肝癌组织及癌旁组织总蛋白,用BCA试剂盒检测所提蛋白浓度后,取40 μg 变性后的蛋白上样,进行SDS-PAGE凝胶电泳,然后电转至硝酸纤维素膜上,用5%脱脂牛奶封闭1 h,与c-Met一抗反应4 ℃过夜,TBST洗过后与山羊抗兔二抗反应1 h,TBST洗过后在伯乐ChemiDoc XRS+system显色。
1.3.3 荧光定量PCR及Western blot分别检测细胞系HepG2.2.15转染microRNA- 34c后c-Met mRNA及蛋白的表达:实验分为pS-microRNA- 34c组,阴性对照pS-control组和空白对照mock组3组。复苏细胞,于转染前24 h将细胞以3×105个/孔接种于6孔板中,每孔加入2 mL DMEM培养基,细胞生长至对数期时每孔加入2 mL optiMEM培养基,10 μL Lipofectamine2000及4 μg microRNA- 34c质粒或空质粒,6 h后换为10%胎牛血清的DMEM培养基,24 h后Trizol法提取转染细胞的总RNA。按说明书合成cDNA,并进行荧光定量PCR反应,反应条件为95 ℃ 30 s, 95 ℃ 5 s,55 ℃ 15 s,75 ℃ 30 s,40个循环,GAPDH为内参。c-Met上游引物:5′-C AGGCAGTGCAGCATGTAGT-3′,下游引物:5′-GATG ATTCCCTCGGTCAGAA-3′,GAPDH上游引物:5′-AG AAGGCTGGGGCTCATTTG-3′,下游引物:5′-AGGGG CCATCCACAGTCTTC-3′。实验结果由2-ΔΔCT公式计算荧光相对计量。重复上述细胞及转染步骤,转染后48 h提取转染细胞的总蛋白。蛋白的提取及检测方法如上所述。
1.3.4 Western blot检测细胞系HepG2.2.15转染microRNA- 34c及c-Met干扰RNA后P53蛋白的表达:实验分为microRNA- 34c组,c-Met siRNA组,空白对照组。c-Met siRNA序列:sense 5′-GCCUGAAU GAUGACAUUCUTT-3′,antisense 5′-AGAAUGUCAUC AUUCAGGCTT-3′。细胞培养及转染方法如上所述,每孔加入5 μL Lipofectamine2000及100 pmol c-Met siRNA或4 μg microRNA- 34c质粒。转染48 h后提取总蛋白并检测,方法如上。
1.3.5 裸鼠肝癌移植肿瘤模型的建立及瘤内注射:培养Hepg2.2.15细胞,胰蛋白酶消化后,PBS稀释为1×107/mL单细胞悬液,经锥虫蓝检测细胞活性大于95%备用。向裸鼠项背部皮下注射0.2 mL备用细胞悬液,14 d后形成肝癌移植肿瘤。将成瘤鼠分为3组,每组6只,从成瘤第5天开始,每两天分别瘤内注射200 μL含pS-microRNA- 34c,pS-control及OPTI-MEM 100 μL的Lipofectamine2000质粒混悬液,治疗14 d后处死成瘤鼠,取移植肿瘤组织测量,按V=LxI2×0.5公式计算肿瘤体积,L为肿瘤长径,I为肿瘤宽径。
1.4 统计学分析
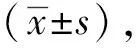
2 结果
2.1肝癌组织中microRNA-34c表达较癌旁组织明显下降
10组临床收集的肝癌组织与癌旁组织比较,9例肝癌组织中microRNA- 34c表达量分别降低为为相应癌旁组织的0.196~0.683倍,1例肝癌组织表达升高为1.137倍(图1)。与10例癌旁组织比较,肝癌组织中microRNA- 34c表达下降(P<0.01)。

图1 临床肝癌组织与相应癌旁组织中microRNA- 34c的表达Fig 1 The expression of microRNA- 34c in clinical liver cancer tissues and related normal tissues
2.2 肝癌组织中c-Met表达较癌旁组织明显上升
10组肝癌组织与癌旁组织比较,7例肝癌组织中c-Met蛋白表达升高(图2)。microRNA靶基因数据库及临床肝癌组织中microRNA- 34c与c-Met表达量的负相关提示,microRNA- 34c可能调控c-Met的表达。
2.3Hepg2.2.15细胞系转染microRNA-34c后c-Met表达下降
与对照组比较,microRNA- 34c转染组c-Met在mRNA水平下降为0.356倍(P<0.01)(图3A)。Mock组蛋白的表达为0.88±0.01, control组蛋白的表达为0.84±0.02,microRNA- 34c组蛋白的表达为0.31±0.01,较mock组及control组明显减少(P<0.01)(图3B)。
2.4Hepg2.2.15细胞系转染microRNA-34c,c-Met干扰RNA后P53表达升高
Mock组蛋白的表达为0.27±0.01,microRNA- 34c转染组蛋白表达为0.69±0.02,c-Met干扰RNA转染组蛋白表达为0.63±0.02,与mock组比较,microRNA- 34c及c-Met干扰RNA组P53表达均增高(P<0.05)(图4)。
2.5 microRNA- 34c在体内抑制肝癌的生长
裸鼠成瘤及瘤内注射14 d后,pS-microRNA- 34c组移植肿瘤体积为289±36 mm3,显著低于pS-control组和OPTI-MEM组的674±49 mm3和698±57 mm3(P<0.05)(图5)。
3 讨论
肝细胞肝癌是最长见的恶性肿瘤之一,与其他肿瘤相比,肝细胞肝癌死亡率在世界范围内位居第三,而在中国位居第二,其五年生存率不足5%[7]。目前,肝细胞肝癌的诊疗手段还十分有限,而分子靶向治疗是当前肝细胞肝癌领域研究的热点。microRNA作为一种自身产生的非编码微小RNA,可以通过调控其靶基因参与细胞分化、细胞增殖及细胞凋亡等病理生理过程[8]。microRNAc- 34家族可能在多种肿瘤的发生发展过程中发挥了抑癌基因的作用,这也提示着microRNAc- 34家族可能作为分子靶向治疗的重要部分为肝细胞肝癌的诊疗带来帮助[9]。本研究发现,肝癌组织中microRNA- 34c在表达明显下降,其预测靶基因c-Met表达增多,二者表达呈负相关。细胞实验中证实,microRNA- 34c可抑制c-Met的表达。前期研究表明,c-Met过表达会持续激活肝细胞生长因子HGF/c-Met通路,促进肿瘤的发展[10- 11]。最新研究表明,抑癌基因P53可以调控microRNAc- 34的表达[12]。本实验结果证明,肝癌细胞中过表达microRNA- 34c及干扰c-Met表达均可增加P53的表达量。目前,microRNA动物实验的研究比较少,本研究通过裸鼠成瘤模型的建立和瘤内注射后肿瘤体积的测量发现,microRNA- 34c在一定程度上可以抑制体内肝癌细胞的生长。综上所述,microRNA- 34c在肝癌组织中表达下调,在肝癌细胞中抑制c-Met的表达并且增加P53的表达。同时,microRNA- 34c可在小鼠体内抑制肝癌细胞生长。本研究为microRNAc- 34作为未来分子靶向治疗的可能提供了一定的理论依据。以后的工作中,可以进一步探讨microRNA- 34c调节c-Met对原发性肝癌侵袭及转移机制的影响,明确microRNA- 34c在原发性肝癌发生发展中的作用。

图2 临床肝癌组织与相应癌旁组织中c-Met蛋白的表达Fig 2 The expression of c-Met protin in clinical liver cancer tissues and related normal tissues
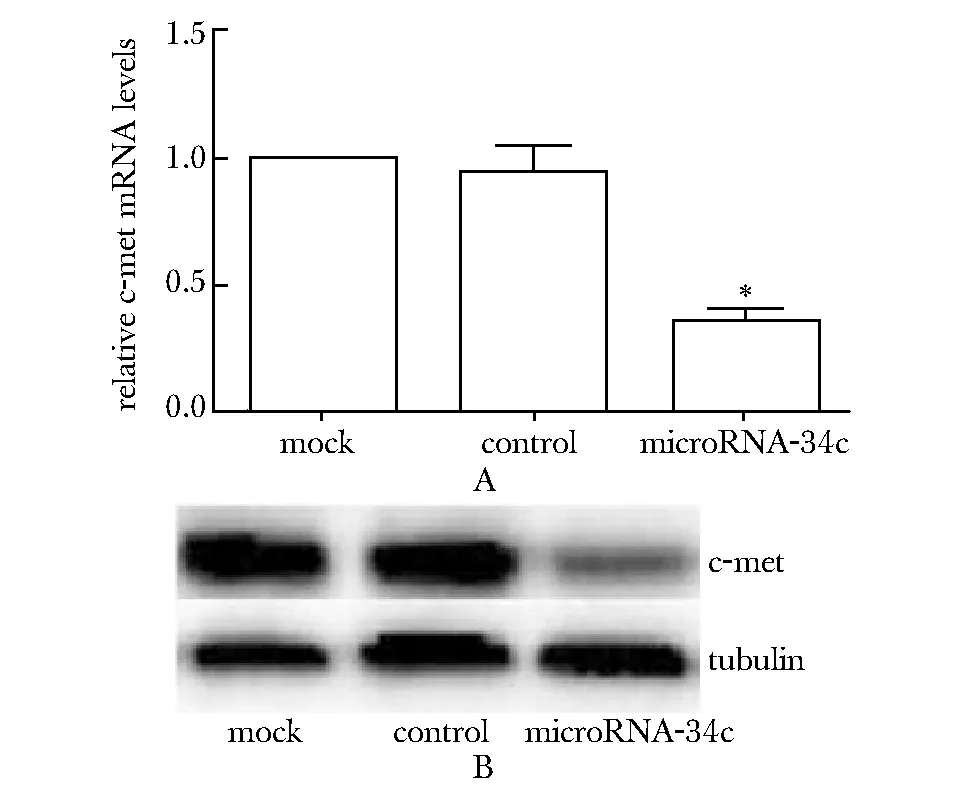
*P<0.01 compared with control图3 Hepg2.2.15细胞系转染microRNA- 34c后c-Met的表达量Fig 3 The expression of c-Met in Hepg2.2.15 cell lines tansfected with microRNA- 34c plasmid
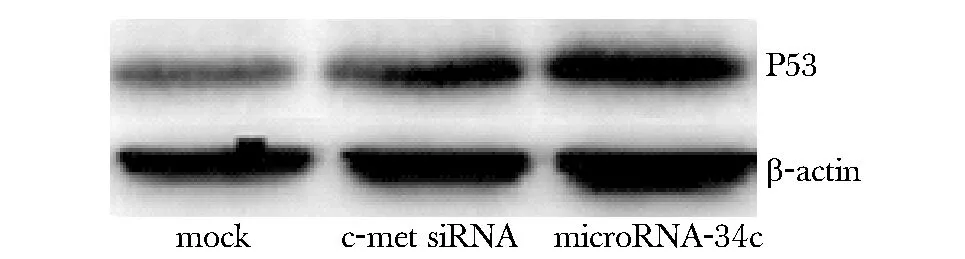
图4 microRNA- 34c质粒及c-Met干扰RNA转染Hepg2.2.15细胞系后P53的表达Fig 4 The expression of P53 in Hepg2.2.15 cell lines transfected with microRNA- 34c plasmid or c-Met siRNA respectively
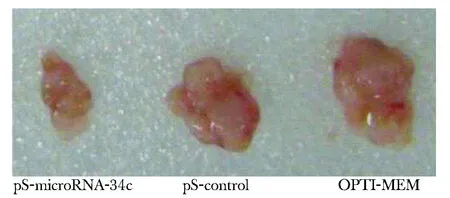
图5 瘤内注射后3组移植肿瘤体积大小的比较Fig 5 Comparion of transplanted tumor size after intratumor injection
[1] Giordano S,Columbano A.MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma?[J].Hepatology, 2013,57:840- 847.
[2] Bosch FX, Ribes J, Diaz M,etal.Primary liver cancer: worldwide incidence and trends[J].Gastroenterology, 2004,127:S5- S16.
[3] 周珏宇,石嵘,郑文玲,等. microRNA与肿瘤细胞周期的关系及其研究方法进展[J]. 基础医学与临床,2013,33:9- 14.
[4] Gougelet A,Colnot S.microRNA: new diagnostic and therapeutic tools in liver disease?[J].Med Sci (Paris), 2013,29:861- 867.
[5] Hermeking H.The miRc- 34 family in cancer and apoptosis[J].Cell Death Differ, 2010,17:193- 199.
[6] Xu Y, Liu L, Liu J,etal.A potentially functional polymorphism in the promoter region of miRc- 34b/c is associated with an increased risk for primary hepatocellular carcinoma[J].Int J Cancer, 2011,128:412- 417.
[7] Wang CM, Wang Y, Fan CG,etal.miR- 29c targets TNFAIP3, inhibits cell proliferation and induces apoptosis in hepatitis B virus-related hepatocellular carcinoma[J].Biochem Biophys Res Commun, 2011,411:586- 592.
[8] Voorhoeve PM, le Sage C, Schrier M,etal.A genetic screen implicates miRNA- 372 and miRNA- 373 as oncogenes in testicular germ cell tumors[J].Cell, 2006,124:1169- 1181.
[9] Bader AG.miRc- 34-a microRNA replacement therapy is headed to the clinic[J].Front Genet, 2012,3:120.
[10] Kirchhofer D, Lipari MT, Santell L,etal.Utilizing the activation mechanism of serine proteases to engineer hepatocyte growth factor into a Met antagonist[J].Proc Natl Acad Sci U S A, 2007,104:5306- 5311.
[11] Ma PC, Tretiakova MS, Nallasura V,etal.Downstream signalling and specific inhibition of c-Met/HGF pathway in small cell lung cancer: implications for tumour invasion[J].Br J Cancer, 2007,97:368- 377.
[12] Wong MY, Yu Y, Walsh WR,etal.microRNAc- 34 family and treatment of cancers with mutant or wild-type p53 (Review)[J].Int J Oncol, 2011,38:1189- 1195.
microRNA- 34c suppressesdevelopment of hepatocellular carcinoma by downregulating c-Met
YU Xiao-jian,WANG Yan,LI Rui-feng,LI Li,LIU Yu-gang*
(Dept. of Pathophysiology,School of Medicine,Shandong University,Jinan 250012,China)
ObjectiveTo study the effect of microRNA- 34c on the development of hepatocellular carcinoma.MethodsExpressions of microRNA- 34c and c-Met protein in clinical hepatocellular carcinoma tissue and para-carcinoma tissue, c-Met mRNA and protein in HepG2.2.15 cells transfected with microRNA- 34c, P53 protein in HepG2.2.15 cells transfected with microRNA- 34c or c-Met siRNA were detected by qPCR and Western blot respectively. Xenograft nude mice with liver cancer was established and the volume of tumors was measured.ResultsMicroRNA- 34c expression was significantly decreased in the hepatocellular carcinoma tissue compared with para-carcinoma tissue(P<0.01),while the c-Met expression was inverse.MicroRNA- 34c can inbit c-Met expression in HepG2.2.15 cells(P<0.01).Downregulation of c-Met ehanced P53 activity(P<0.05).MicroRNA- 34c inhibited the growth of liver cancer in xenograft nude mice modle(P<0.05).ConclusionsMicroRNA- 34c may play a role in suppressing the development of hepatocellular carcinoma by downregulating c-Met.
hepatocellular carcinoma;microRNA- 34c;c-Met;P53
2014- 01- 13
2014- 03- 28
*通信作者(correspondingauthor):liuyugang@sdu.edu.cn
1001-6325(2014)09-1250-05
R 575.1
A

