小鼠成纤维样滑膜细胞原代培养的影响因素研究
唐 媚,常 山,曹宗锐,罗兴燕,胡 松,唐信威,王衍堂,刘 阳,邹 强
0 引 言
成纤维样滑膜细胞(fibroblast-like synoviocytes,FLSs)是组成滑膜层的最大细胞群体,在维持关节正常生理功能和内环境稳态方面发挥重要作用[1]。异常增生活化的FLSs在关节病变中起关键性作用,其已广泛应用于关节疾病发病机制的研究中[2]。目前已建立了较为成熟的体外人[3-4]、大鼠[5-8]FLSs培养体系,主要有组织块培养法[9]和酶消化法[10]。近年来基因敲除小鼠越来越广泛地应用在关节疾病研究中[11],培养小鼠FLSs的方法现已有报道[12]。然而影响体外培养原代小鼠FLSs数量和纯度的因素较多,如关节处理方法、消化酶种类、酶消化时间等。目前关于此类影响因素研究的报道较少。本研究在体外培养小鼠原代操作过程中,发现影响FLSs数量与纯度有3个主要因素:关节处理方式、消化酶种类及酶消化时间,并对其进行探讨,为获得高数量、高纯度FLSs提供参考。
1 材料与方法
1.1 材料
1.1.1 动物 健康SPF级C57雄性小鼠,6月龄,12只,体重20~30 g,由成都医学院动物中心提供,实验动物合格证号:0017184,在独立通风鼠笼IVC系统饲养,给予标准饲料和饮用水,用于分离培养FLSs。
1.1.2 主要设备 超净工作台(苏州安泰);荧光倒置相差显微镜(Olympus);®流式细胞仪(BD公司)。
1.1.3 主要试剂 胎牛血清(上海普飞),L-谷氨酰胺、青霉素、链霉素(北京索莱宝),2-巯基乙醇(美国Sigma);Ⅳ型胶原酶、Ⅱ型胶原酶(Gibco),流式抗体(BD)。
1.2 方法
1.2.1 小鼠双后肢取材 将小鼠脱臼处死,置于75%乙醇中浸泡5 min。随后在髋关节处小心取下小鼠双后肢,保证关节面完整。将取得的小鼠后肢置于75%乙醇培养皿中浸泡5 s,用眼科剪纵行剪开皮肤至脚趾尖。用有齿镊、眼科剪分离皮肤、肌肉及筋腱;为避免骨髓细胞污染,操作过程不能出现骨断裂。将取得的组织用100 U/mL青霉素、200 μg/mL链霉素的PBS漂洗3次以减少污染。
1.2.2 后肢关节不同处理方法及Ⅳ型胶原酶消化随机数表法取6只小鼠,打开其关节处理:将去尽皮肤、肌肉的后肢置于无菌培养皿中,用手术刀依次打开趾关节、踝关节、膝关节,保证关节面完整;不打开关节处理6只小鼠:直接将小鼠后肢进行消化。消化过程为:将小鼠后肢置于离心管内,加入浓度为10 mg/mLⅣ型胶原酶(预实验初步判定Ⅳ型胶原酶转Ⅱ型胶原酶效果好)和含10%FBS的DMEM培养基。在37℃,转速200 r/min的摇床中孵育1 h,弃上清。向离心管内加5mLⅣ型胶原酶和20 mL DMEM完全培养基,在37℃200r/min摇床中孵育5h。取出离心管剧烈涡旋5s,收集上清液800g,离心5min。DMEM完全培养基重悬细胞转入24孔板内,置于5%CO2培养箱中培养。每隔1小时收集消化后的细胞悬液,连续收集7h(预实验结果表明:Ⅳ型胶原酶处理7 h后已将滑膜组织完全消化)。培养24h后,消化检测7h FLSs活细胞总数。
1.2.3 不同类型胶原酶消化对FLSs数量的影响将不打开关节的后肢置于2根50 mL离心管内,分别加入1 mL浓度为10 mg/mLⅡ型+4 mL DMEM、Ⅳ型胶原酶+4 mL DMEM完全培养基进行消化。每隔1小时收集消化后的细胞悬液,连续收集7 h。培养24 h后,消化检测每小时FLSs活细胞数。
1.2.4 Ⅳ型胶原酶消化时间对FLSs数量的影响Ⅳ型胶原酶消化不打开关节的双后肢,每隔1小时收集消化后的细胞悬液,连续收集7 h。培养24 h后,消化检测每小时FLSs活细胞数。
1.2.5 FLSs计数及鉴定 收集消化后的FLSs置于1.5 mL EP管内,加100 μL PBS重悬细胞。向管内加入0.5 μL APC-cy7 标记抗鼠 CD11b 抗体、0.5 μL FITC标记抗鼠CD90抗体,轻轻吹打混匀,4℃避光孵育25 min,再加0.5 μL 荧光染料孵育5 min,洗涤后,加100 μL PBS混匀上机检测。
1.3 统计学分析 采用SPSS 14.0软件进行统计分析。计量资料以均数±标准差(±s)表示,2组均数比较采用t检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 流式细胞术鉴定 Ⅳ型胶原酶消化培养24h后,倒置显微镜下观察FLSs形态多为梭形、菱形;而巨噬样滑膜细胞(macrophage like synoviocyte,MLS)多触角形态极不规则。培养第4天,镜下观察FLSs呈放射状生长,明显可见长满触角的MLS。第2代FLSs体积逐渐增大,伸展更充分,仍可见MLS。第3代表现出典型形态,MLS数量明显减少。第4代FLSs形态上鉴定基本为成纤维样细胞,细胞核呈椭圆形位于细胞中央且状态良好,偶见单个MLS。见图1。

图1 倒置显微镜下观察小鼠FLSs形态(×20)Figure 1 Morphology of mouse FLSs under the inverted microscope(×20)
将培养24 h和第3代的FLSs消化制成细胞悬液,分别用抗鼠 CD90.2、抗鼠 CD11b流式抗体双染。MLS表达 CD11b,FLSs和 MLS表达 CD90.2。结果显示:24 h细胞悬液中抗鼠CD11b阴性细胞比例为86.5%、第3代细胞悬液中抗鼠CD11b阴性细胞比例为97.3%。见图2。
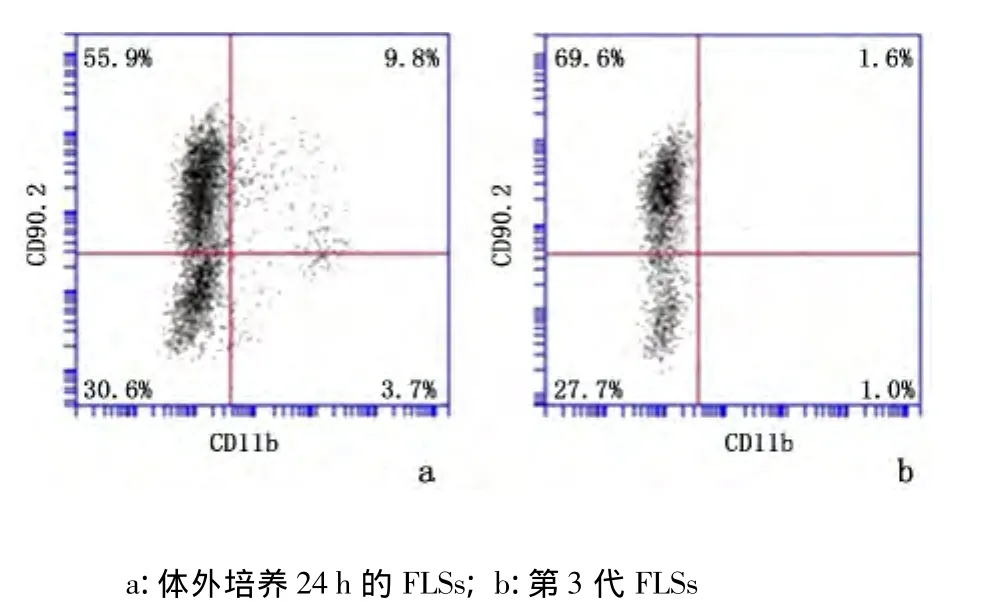
图2 小鼠FLSs表面标记流式分析Figure 2 Flow cytometry analysis of the surface makers of the mouse FLSs
2.2 后肢关节处理方法对FLSs数量的影响 有报道采用打开关节处理方式培养小鼠FLSs[5],但该处理不仅操作复杂且会造成FLSs损失。本实验结果显示:单后肢打开关节消化7 h FLSs总数为(19133±115)个,单后肢不打开关节消化7h FLSs细胞总数为(24933±503)个,两者差异有统计学意义(P<0.05)。
2.3 不同类型胶原酶消化对FLSs数量的影响 本文比较了2种胶原酶消化对FLSs数量的影响。结果显示:Ⅱ型胶原酶消化7 h FLSs总数为(18100±400)个,Ⅳ型胶原酶消化7 h FLSs细胞总数为(24 900±500)个,差异有统计学意义(P<0.05)。
2.4 Ⅳ型胶原酶消化时间对FLSs数量的影响 Ⅳ型胶原酶消化单支后肢,连续收集消化1~7 h细胞悬液,活FLSs数分别为(700±300)、(600±100)、(15200±900)、(5100 ±800)、(2700 ±300)、(900±200)、(300 ±100)个。结果显示,消化1、2 h,FLSs的数量较少,消化3 h的FLSs数量最多,之后数小时消化FLSs数量逐渐减少。见图3。
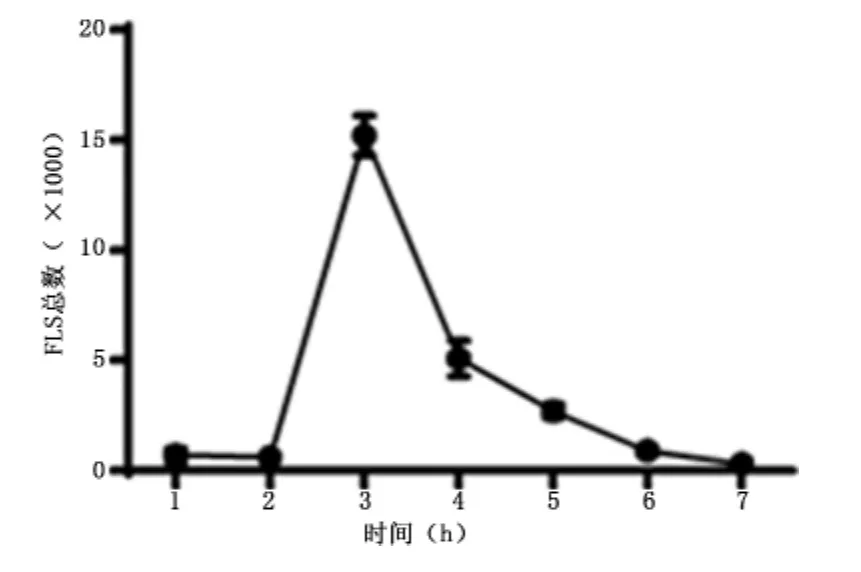
图3 Ⅳ型胶原酶消化时间对FLSs数量的影响Figure 3 Time of type-Ⅳcollagenase digestion in correlation with the number of FLSs
3 讨 论
越来越多研究表明,FLSs在关节疾病发病进程中扮演至关重要的角色[12]。被激活的FLSs一方面分泌基质金属蛋白酶,侵蚀软骨和骨组织,引起关节畸形;另一方面FLSs分泌趋化因子、炎性细胞因子,引起关节炎症。基因敲除小鼠能用于某特定基因功能的深入研究,为寻找新的治疗方法提供了基础,这使得越来越多的学者开始关注其在关节病变中的研究。而建立高效率、短周期体外培养小鼠FLSs方法直接影响到后续实验。因此进行培养条件优化,提高原代FLSs数量及纯度是很有意义的。
有文献报道采用打开关节处理方式培养FLSs[5]。本实验比较打开关节处理和不打开关节处理2种方法。结果显示:不打开关节处理获得FLSs数量显著高于打开关节处理。在操作过程中发现:手术刀依次打开各关节时,不可避免会造成FLSs损失,而不打开关节处理不仅减少实验者的操作步骤,也有效避免了骨髓细胞污染。本实验结果显示,Ⅳ型胶原酶消化获得FLSs数量显著高于Ⅱ型胶原酶消化的数量,分别收集Ⅳ型胶原酶消化7 h细胞悬液培养24h后检测,1h几乎无FLSs;2h的数量开始增多;3 h的数量达到最高;4~6 h的FLSs数量逐次减少,7 h的FLSs降到最低,因为消化1、2 h关节腔尚未完全打开,悬液肉眼可见大量成絮状的筋腱和肌肉,影响FLSs贴壁和增殖,建议弃去。消化3 h关节腔完全打开,FLSs数量最多,而7 h的FLSs数量太少。因此我们收集2~6 h的悬液进行培养。原代细胞纯度相对较低,我们根据MLS贴壁紧、消化时间长(MLS需消化8~10 min,FLSs 4~5 min)且在体外不增殖的特性,逐代将其去除。第3、第4代FLSs纯度可达到95%以上,能满足后续实验需要。关于鉴定FLSs,有文献报道可采用PCR扩增其标志性细胞骨架蛋白波形蛋白基因[13-14],也可采用FLSs表面标记物标记后流式细胞仪检测[3,7]。因细胞表面标记物鉴定目标细胞特异性高且操作简便,现越来越多学者采用流式细胞术检测和鉴定细胞[15-16]。尽量避免采用多次取材得到的FLSs进行实验,以减少批间误差,反映真实结果。
除本实验比较的3个因素外,还有其他因素影响原代FLSs数量与纯度,如不同消化酶联合使用、消化时加磁珠等。实验人员在培养FLSs时,需综合考虑这些影响因素,提高工作效率,降低科研成本。
[1] Edwards JC,Willoughby DA.Demonstration of bone marrow derived cells in synovial lining by means of giant intracellular granules as genetic markers[J].Ann Rheum Dis,1982,41(2):177-182.
[2] Bartok B,Firestein GS.Fibroblast-like synoviocytes:key effector cells in rheumatoid arthritis[J].Immunol Rev,2010,233(1):233-255.
[3] 黄宪章,王 前,郑 磊,等.人类风湿性关节炎成纤维样滑膜细胞培养及生物学特性研究[J].南方医科大学学报,2009,29(3):462-465.
[4] Rosengren S,Boyle DL,Acquisition FG.Culture,and phenotyping of synovial fibroblasts[J].Methods Mol Med,2007,135:365-375.
[5] 袁 琴,阚卫兵,宋朋飞,等.大鼠膝骨关节炎滑膜细胞原代培养[J].现代生物医学进展,2012,12(2):253-255,290.
[6] 孙贵才,徐轶尔,谢晶日,等.四种不同处理方法体外培养大鼠滑膜细胞[J].中国组织工程研究,2012,16(7):1193-1196.
[7] Seluanov A,Vaidya A,Gorbunova V.Establishing primary adult fibroblast cultures from rodents[J].J Vis Exp,2010,44(44):2033.
[8] 顿耀艳,袁 丁,张长城.大鼠滑膜细胞原代培养的研究[J].实用医学进修杂志,2007,35(2):126-128.
[9] 李 婷,戴 冽,杨 斌,等.改良组织块法培养细针活检滑膜组织成纤维样滑膜细胞[J].中山大学学报(医学科学版),2010,31(4):567-571,576.
[10] 彭卫华,侯凡凡,蒋建平,等.改良的胶原酶滑膜细胞分离培养法[J].第一军医大学学报,2000,20(5):469-470.
[11] 黄宪章,王 前.IL-1Ra和CDKIs在类风湿性关节炎基因治疗中的应用[J].广东医学,2008,29(1):150-152.
[12] Huber LC,Distler O,Tarner I,et al.Synovial fibroblasts:key players in rheumatoid arthritis[J].Rheumatology(Oxford),2006,45(6):669-675.
[13] Hashida R,Kobayashi S,Shirota H,et al.Stimulation of prostaglandin systhesis incultured rat synovian cell by a factor derived from polymotphonclear leukocytes[J].Prostaglandin,1984,27(5):697-709.
[14] 孙铁铮,吕厚山,药立波,等.染料木黄酮对类风湿性关节炎成纤维样滑膜细胞生长的影响[J].中华风湿病学杂志,2000,4(5):266-269.
[15] 李金平,蒋日婷,晁耐霞,等.siRNA沉默GC结合因子2表达对BEL-7404细胞增殖和凋亡的影响[J].医学研究生学报,2013,26(9):912-915.
[16] 陈 瑜,刘翠萍,矛晓东,等.糖基化终产物诱导小鼠足细胞内质网应激和细胞凋亡的研究[J].医学研究生学报,2013,26(11):1129-1133.

