钼镉联合胁迫对山羊肾线粒体抗氧化功能的影响
王 琦,庄 煜,曹华斌,胡国良,罗军荣,顾小龙
(江西农业大学 动科院,动物群发性疾病监测和防治研究所,江西 南昌 330045)
钼是动、植物生长所必需的微量元素之一,广泛存在于土壤、空气、水、植物及动物组织中[1]。镉是一种蓄积性毒物,是人体不必需的元素,可通过各种机制引起细胞的损伤,镉对机体的损害广泛涉及各个系统,包括消化道、肾、肺、心、骨骼、生殖器官、神经系统和血液系统等,其中肝、肾是最主要损害的实质器官,肝脏的损伤多在急性情况下,而肾脏是慢性时的主要毒害器官[2-3]。镉进入机体后可通过诱发肾组织氧自由基生成多,引发脂质过氧化反应,造成肾功能损害[4]。前人的实验主要集中在钼、镉单独作用对动植物生长的影响上,而较少对钼镉互作条件下细胞内脂质过氧化水平等进行研究。本试验通过灌服不同浓度七钼酸铵和相同浓度的氯化镉溶液,观察钼、镉联合胁迫对山羊肾线粒体自由基代谢的影响,以期进一步探讨钼镉联合作用对山羊肾线粒体自由基代谢的影响是协同的作用还是拮抗的作用,从而为动植物钼、镉联合中毒的病理学研究提供实验依据。
1 材料与方法
1.1 实验动物分组及日粮
本实验选用36 只波尔山羊均采购自南昌市郊区某山羊养殖场,随机分成4 组,每组9 只。实验期为50 d,10%钼酸铵【(NH4)6Mo7O24·4H2O】水溶液及10%的氯化镉(CdCl2)水溶液经口灌服。实验组每天定时定量灌服10%钼酸铵水溶液及10%的氯化镉(CdCl2)水溶液;对照组(实验Ⅰ组)口服实验组平均剂量去离子水,实验Ⅱ组、实验Ⅲ组和实验Ⅳ组灌服Cd 1.0 mg/kg(BW)同时再分别灌服Mo 15 mg/kg(BW)、30 mg/kg(BW)和45 mg/kg(BW)。试验山羊基础日粮参照NRC(1998)饲养标准山羊营养需要量配制,基础日粮组成成分及营养水平见表1。
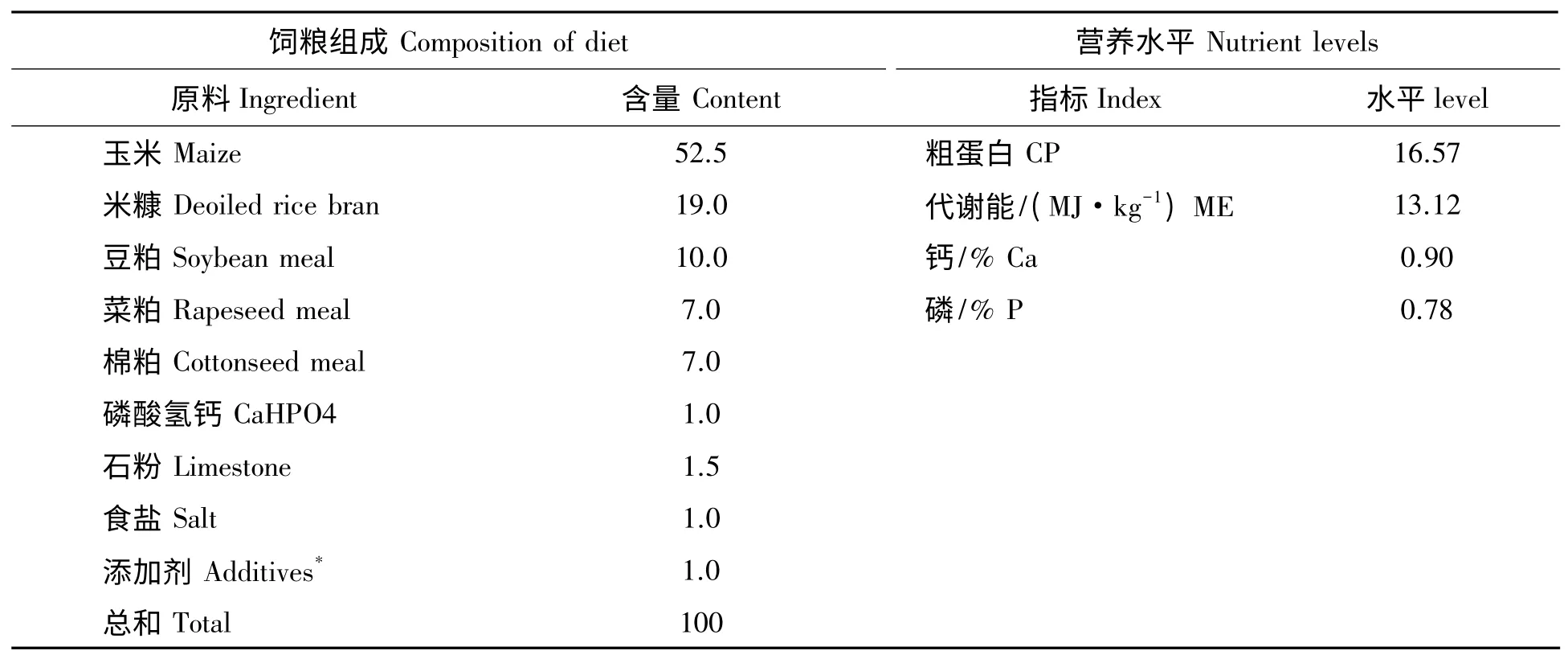
表1 山羊基础日粮组成和营养水平Tab.1 Composition and nutrient levels in the basal diet for the dairy goats
1.2 样品采集
组织样品:于正式实验的第0 天、25 天、50 天,每组随机挑选3 头山羊进行剖杀,迅速取出肾脏,取部分肾实质立即用于线粒体的提取。
1.3 肾脏线粒体的提取与保存
参照Z.Tang 和D.Johnson 等[5-6]介绍的方法进行肾脏线粒体的提取与保存,方法稍有改进。
1.4 肾脏线粒体指标的测定
严格按照试验盒说明书测定肾脏线粒体T-AOC、T-SOD、NO、NOS、MDA 的含量或活力。试剂盒均购自南京建成生物工程研究所。
1.5 数据分析与统计
用Excel2003 对数据进行初步整理,再用SPSS17.0 统计分析软件对整理后的数据进行单因素方差分析(ANOVA),进行各组间均数的多重比较,结果用平均数±标准差(±SD)表示。
2 结果分析
2.1 镉胁迫下钼对山羊肾线粒体T-AOC 活性的影响
镉胁迫下钼对山羊肾线粒体T-AOC 活性的影响见表2。组内比较,对照组在实验期内山羊肾线粒体T-AOC 活性差异不显著(P>0.05)。实验1 组、实验2 组和实验3 组在实验期内,肾线粒体T-AOC活性随实验天数的增加呈下降趋势,其中实验2 组第25 天与第0 天比较,差异不显著(P>0.05),第50天与第0 天、25 天相比差异极显著(P<0.01),实验1 组和实验3 组第25 天与第0 天比较差异极显著(P<0.01),第50 天与第0 天、25 天比较差异极显著(P<0.01)。组间比较,实验1 组和实验3 肾线粒体T-AOC 活性与对照组比较极显著降低(P<0.01),实验2 组肾线粒体T-AOC 活性与对照组比较降低,差异不显著(P>0.05),第50 天实验1 组、实验2 组和实验3 组肾线粒体T-AOC 活性与对照组比较极显著降低(P<0.01)。
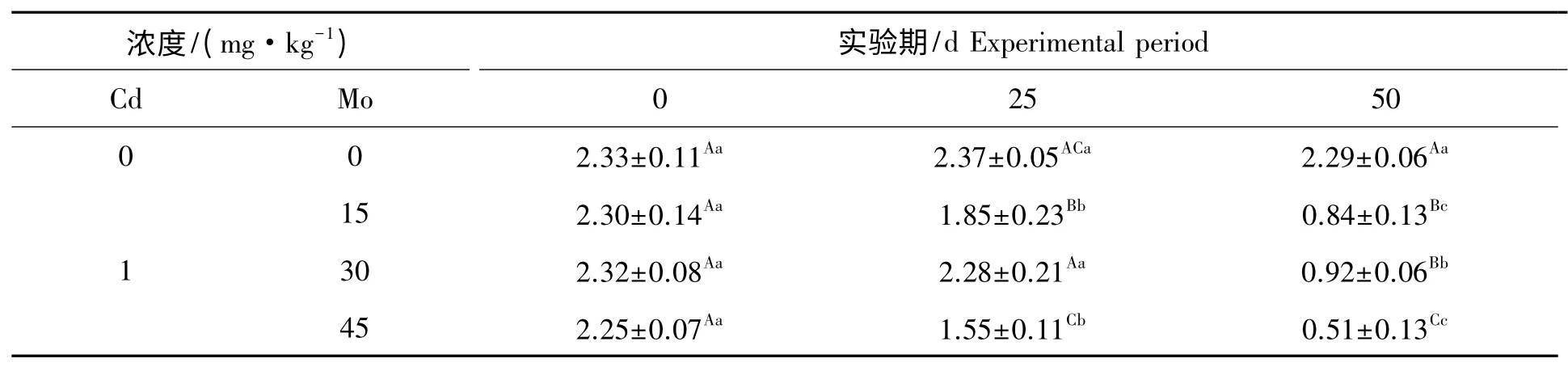
表2 镉胁迫下钼对山羊肾线粒体T-AOC 活性的影响Tab.2 Effect of Mo on the activities of T-AOC in mitochondrial kidney from goat under Cd stress U/group
2.2 镉胁迫下钼对山羊肾线粒体SOD 活性的影响
镉胁迫下钼对山羊肾线粒体SOD 活性的影响见表3。组内比较,对照组在实验期内山羊肾线粒体SOD 活性差异不显著(P>0.05)。实验1 组、实验2 组和实验3 组在实验期内,肾线粒体SOD 活性随实验天数的增加呈下降趋势,其中实验3 组第25 天与第0 天比较差异极显著(P<0.01),实验1 组、实验2组和实验3 组第50 天与第0 天、25 天比较差异极显著(P<0.01)。组间比较,第25 天实验3 组肾线粒体SOD 活性与对照组比较极显著降低(P<0.01),实验1 组和实验2 组肾线粒体SOD 活性与对照组比较降低,差异不显著(P>0.05),第50 天实验1 组、实验2 组和实验3 组肾线粒体SOD 活性与对照组比较极显著降低(P<0.01)。
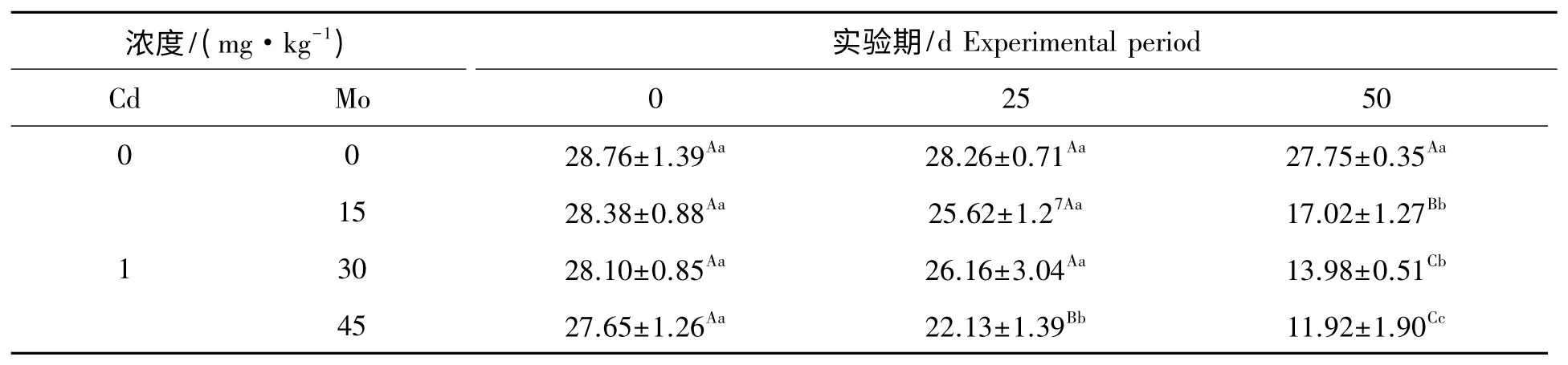
表3 镉胁迫下钼对山羊肾线粒体SOD 活性的影响Tab.3 Effect of Mo on the activities of SOD in mitochondrial kidney from goat under Cd stress U/group
2.3 镉胁迫下钼对山羊肾线粒体MDA 含量的影响
镉胁迫下钼对山羊肾线粒体MDA 含量的影响见表4。组内比较,对照组在实验期内山羊肾线粒体MDA 含量差异不显著(P>0.05)。实验1 组、实验2 组和实验3 组在实验期内,肾线粒体MDA 含量随实验天数的增加呈上升趋势,实验1 组、实验2 组和实验3 组第25 天与第0 天比较差异显著(P<0.05),实验1 组、实验2 组和实验3 组第50 天与第0 天、25 天比较差异极显著(P<0.01)。组间比较,实验1 组和实验2 组肾线粒体MDA 含量与对照组比较显著升高(P<0.05),实验3 组肾线粒体MDA 含量与对照组比较极显著升高(P<0.01),第50 天实验1 组、实验2 组和实验3 组肾线粒体MDA 含量与对照组比较极显著升高(P<0.01)。
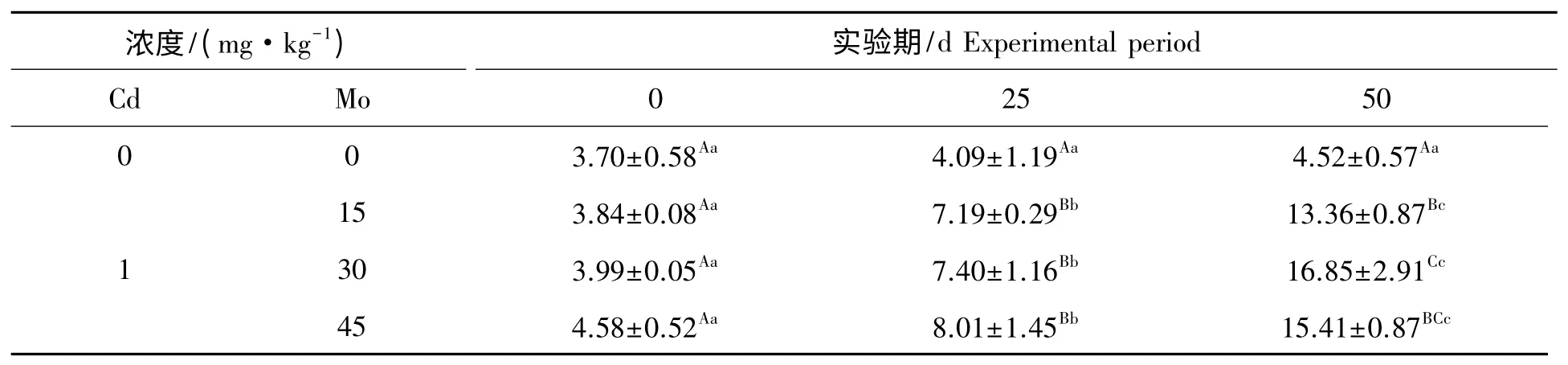
表4 钼对镉胁迫下对山羊肾线粒体MDA 含量的影响Tab.4 Effect of Mo on the content of MDA in mitochondrial kidney from goat under Cd stress nmol/gprot
2.4 镉胁迫下钼对山羊肾线粒体NO 含量的影响
镉胁迫下钼对山羊肾线粒体NO 含量的影响见表5。组内比较,对照组在实验期内山羊肾线粒体NO 含量差异不显著(P>0.05)。实验1 组、实验2 组和实验3 组在实验期内肾线粒体NO 含量随实验天数的增加呈上升趋势,其中实验1 组第25 天与第0 天比较差异极显著(P<0.01),实验2 组第25 天与第0 天比较差异显著(P<0.05),实验1 组、实验2 组和实验3 组第50 天与第0 天、25 天比较差异极显著(P<0.01)。组间比较,第25 天实验3 组肾线粒体NO 含量与对照组比较升高,差异不显著(P>0.05),实验1 组肾线粒体NO 含量与对照组比较极显著升高(P<0.01),实验2 组肾线粒体NO 含量与对照组比较显著升高(P<0.05),第50 天实验1 组、实验2 组和实验3 组肾线粒体NO 含量与对照组比较极显著升高(P<0.01)。
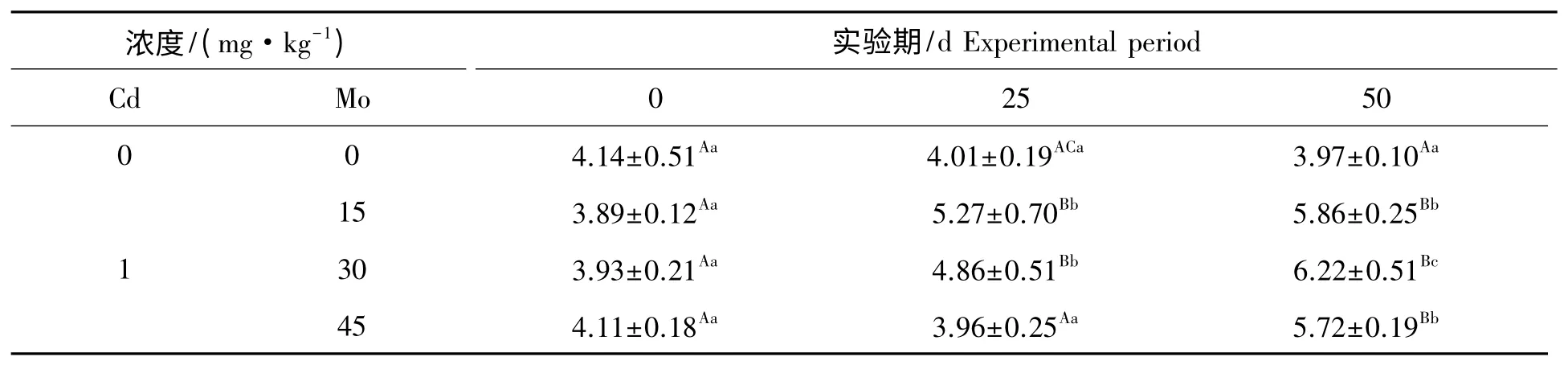
表5 镉胁迫下钼对山羊肾线粒体NO 含量的影响Tab.5 Effect of Mo on the content of NO in mitochondrial kidney from goat under Cd stress nmol/gprot
2.5 镉胁迫下钼对山羊肾线粒体NOS 活性的影响
镉胁迫下钼对山羊肾线粒体NOS 活性的影响见表6。组内比较,对照组在实验期内山羊肾线粒体NOS 活性差异不显著(P>0.05)。实验1 组、实验2 组和实验3 组在实验期内,肾线粒体NOS 活性随实验天数的增加呈上升趋势,其中实验3 组第25 天与第0 天比较差异极显著(P<0.01),实验1 组和实验2 组第25 天与第0 天比较差异显著(P<0.05),实验1 组、实验2 组和实验3 组第50 天与第0 天、25 天比较差异极显著(P<0.01)。组间比较,第25 天实验1 组、实验2 组和实验3 组肾线粒体NOS 活性与对照组比较极显著升高(P<0.01),第50 天实验1 组、实验2 组和实验3 组肾线粒体NOS 活性与对照组比较极显著升高(P<0.01)。
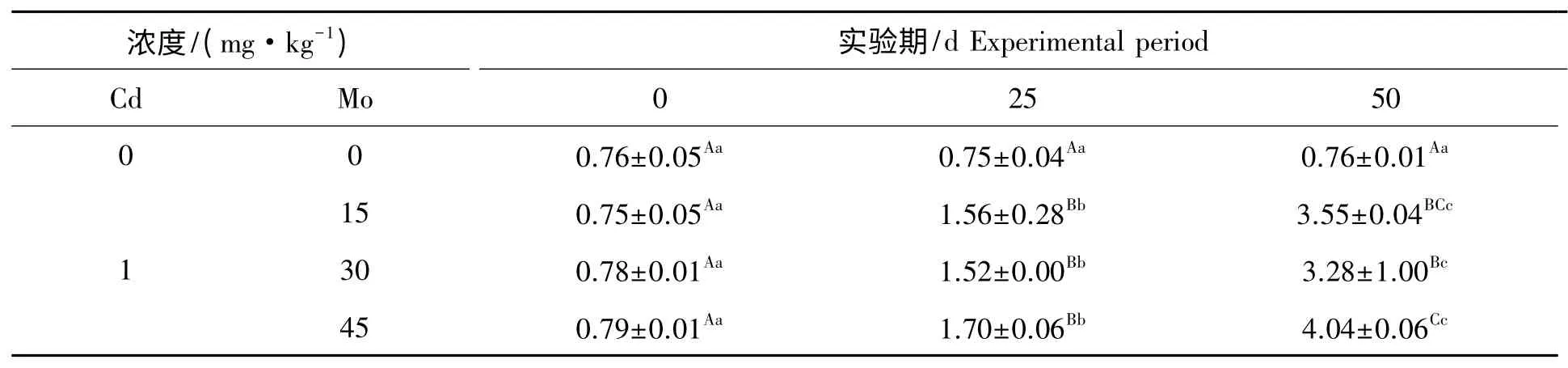
表6 镉胁迫下钼对山羊肾线粒体NOS 活性的影响Tab.6 Effect of Mo on the activities of NOS in mitochondrial kidney from goat under Cd stress U/gprot
2.6 镉胁迫下钼对山羊肾线粒体CAT 活性的影响
镉胁迫下钼对山羊肾线粒体CAT 活性的影响见表7。组内比较,对照组在实验期内山羊肾线粒体CAT 活性差异不显著(P>0.05)。实验1 组、实验2 组和实验3 组在实验期内,肾线粒体CAT 活性随实验天数的增加呈上升趋势,其中实验1 组、实验2 组和实验3 组第25 天与第0 天比较差异极显著(P<0.01),实验1 组第50 天与第0 天比较差异极显著(P<0.01),与第25 天比较差异显著(P<0.05),实验2 组和实验3 组第50 天与第0 天、25 天比较差异极显著(P<0.01)。组间比较,第25 天实验1 组、实验2 组和实验3 组肾线粒体CAT 活性与对照组比较极显著升高(P<0.01),第50 天实验1 组、实验2 组和实验3 组肾线粒体CAT 活性与对照组比较极显著升高(P<0.01)。
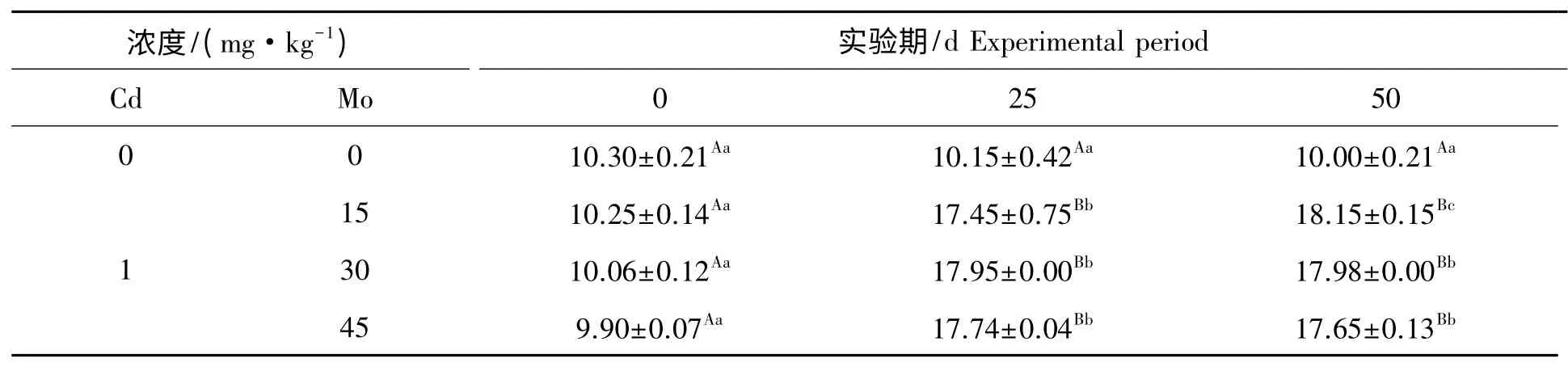
表7 镉胁迫下钼对山羊肾线粒体CAT 活性的影响Tab.7 Effect of Mo on the activities of CAT in mitochondrial kidney from goat under Cd stressU/gprot
3 讨论
线粒体是细胞内一种重要的细胞器,被称为细胞内的动力工厂。线粒体病变使其能量产生出现阻碍,从而导致细胞部分生理活动发生紊乱,影响细胞内各细胞器的协调并危及细胞的生命活动。线粒体内包含多种抗氧化酶类,能有效的清除机体内产生的各种自由基[7]。在正常生理状态下,动物机体内不断产生自由基,同时也被系统自动清除,维持其动态的平衡,但如果机体处于病理状态时,自由基的产生超出其系统自身清除能力时,就会造成自由基在体内蓄积,给机体组织与细胞、亚细胞结构与功能等带来损伤[8]。T-AOC、SOD、CAT 等不仅可以保护线粒体膜不受自由基的损害,同时其活性也可在一定程度上反映线粒体抗氧化功能的状态;MDA 含量可以反映线粒体内脂质过氧化反应的程度,从而间接地反映细胞受损伤的程度。近几年的研究结果显示,许多疾病的发生与自由基的产生有关[9,10]。本实验结果表明,肾脏线粒体中T-AOC 和SOD 活性随钼水平及实验时间的增加而降低,MDA 含量随钼水平及实验时间的增加而升高,进一步证明钼、镉暴露所致肾脏线粒体的抗氧化功能降低与钼浓度和实验时间呈正相关,其联合肾毒性呈现协同效应。
SOD 是生物体内重要的金属抗氧化酶,是生物体内天然存在的超氧自由基清除因子。当机体处于正常状况下,氧化与抗氧化系统保持动态平衡,SOD 的作用就是把有害的超氧自由基转化为过氧化氢,同时通过体内过氧化氢酶和过氧化物酶等作用下将其分解为无害的水,使得机体免受损伤。MDA 是自由基介导的脂质过氧化反应的终产物,是机体内反映氧化损伤程度最重要有效的指标之一,它具有一定的细胞毒性,同时可以引起蛋白质、核酸等大分子的交联聚合。所以,作为脂质过氧化反应的终产物,MDA 的含量常常与细胞损伤的程度呈正相关[11]。
CAT 是一种含铁的氧化酶,它在机体内与D-氨基酸氧化酶、尿酸氧化酶、黄嘌呤氧化酶、L-a-羟基酸氧化酶等产生过氧化氢的酶类相偶联,使过氧化氢分解为水和分子氧[12]。也是广泛存在于生物体内的一种抗氧化防御性功能酶,在正常生理状态下,抗氧化防御系统可以有效地清除生理代谢过程中产生的活性氧自由基,使机体的自由基含量处于平衡状态,但在外源污染物胁迫时,抗氧化防御系统中的CAT 等抗氧化酶的活力就会发生改变,导致自由基代谢平衡的破坏,因此可以作为某些污染物胁迫的生化指标之一[13]。本研究结果表明,随着钼镉浓度的增加以及实验天数的延长,山羊肾线粒体CAT 活性与对照组比较表现为极显著升高。这与王凡,胡蓉等的研究结果一致[14-15]。
一氧化氮(Nitric Oxide,NO)是生物机体内一种重要的小分子物质,是在一氧化氮合成酶(NOS)作用下,以左旋精氨酸(L-Arg)和O2为底物催化而产生的,在维持肾脏的正常功能中发挥重要作用,其含量异常变化可造成肾组织结构和功能损害[16-17]。本实验结果表明,当镉浓度一定时,肾线粒体NO 含量随着钼浓度和实验天数增加而升高,说明钼、镉联合肾毒性呈现协同效应。NOS 即能催化NO 的生成,同时NOS 的活力也可影响NO 的含量。本实验结果表明,NOS 含量随钼水平升高和实验时间延续而升高。该实验结果体现了NO 和NOS 变化的一致性。
[1]樊璞,吴治礼,王继玉,等.耕牛钼中毒的研究初报[J].中国兽医杂志,1983(4):1-3.
[2]Patricia M.Cadmium toxicity in rat pheochromocytoma cells:Studies on the mechanism of uptake[J].Toxicol Appl Pharmacol,1994,124:91-98.
[3]马卓,刘宗平.硒铜对氯化镉致绵羊病理损伤的保护效应[J].甘肃科学学报,1996,8(2):16-20.
[4]王凤清,徐美华,连微峰,等.锌、钼对亚急性镉中毒肾损伤保护作用的比较[J].国外医学临床生物化学与检验学分册,2004,25(3):207-208.
[5]Tang Z,Iqbal M,Cawthon D,et al.Heart and breast muscle mitochondrial dysfunction in pulmonary hypertension syndrome in broilers(gallus domesticus)[J].Comparat Biochemist Physiol Part A,2002,132(3):527-540.
[6]Diane Johnson,Henry Lardy.Isolation of liver or kidney mitochondria[J].Methods in Enzymology,1967(10):94-96.
[7]刘玉清,郭剑英,刘静,等.氨基胍对内毒素血症山羊肝线粒体自由基代谢的影响[J].中国兽医杂志,2008,44(10):6-8.
[8]石达友,李燕华,黄墁玲,等.黄曲霉毒素B1 对肉鸡肝线粒体自由基代谢的影响[J].中国兽医杂志,2011,47(3):9-12.
[9]郭小权,胡国良,曹华斌,等.高能低蛋白日粮致脂肪肝出血综合征鸡抗氧化能力和肝损伤的研究[J].中国兽医学报,2010,30(6):829-832.
[10]Botte W,Tang Z,Iqbal M,et al.Association of Mitochondrial function with feed efficiency within a single genetic line of male broilers[J].Poult Sci,2002,81(4):546-555.
[11]Botte W,Tang Z,Iqbal M,et al.Association of muscle mitochondrial function and ROS production with feed efficiency[J].Free Radicals Biol Med,2000,29:2l-25.
[12]生宝亮,徐刚,陈德伟,等.大鼠实验性高原肺水肿T-AOC、MDA、SOD、CAT 和IL-6 的表达[J].第三军医大学学报,2012,34(23):2364-2367.
[13]刘朝明,杨红,石达友,等.氨基胍对内毒素血症山羊心肌线粒体自由基代谢的影响[J].江西农业大学学报,2009,31(1):8-12.
[14]王凡,刘海芳,晋冬梅,等.镉污染对鲤鱼过氧化氢酶活性的影响[J].水产科学,2010,29(9):550-552.
[15]胡蓉,段辉国,唐正义.镉和铅对鲫鱼肝胰脏过氧化氢酶活性的影响[J].生命科学研究,2011,15(2):165-169.
[16]刘祥梅,吴宇强,严秋,等.力竭运动后24h 大鼠肾组织NO 含量的变化[J].北京体育大学学报,2008,31(10):1375-1380.
[17]刘华锋,陈孝文.一氧化氮与肾损伤的研究进展[J].国外医学.泌尿系统分册,2000,20(5):198-200.

