双菌共固定化耦合催化发酵生产红色染色剂的研究
刘志强 ,赵军子 ,李,王克明
(1.浙江大学 生命科学学院,浙江 杭州 310058,2.浙江科技学院 生物与化学工程学院,浙江 杭州 310012)
在世界范围内,由于环境质量的恶化和生态平衡的失调,人们已由过去广泛对空气、水污染的关注和重视逐渐扩展为对凡可能对人体健康有影响的各个方面的关注。因此,近年来掀起了一场世界性的“回归自然”、“绿色消费”的浪潮。在这一浪潮的冲击下,世界各国都在积极开展生产有利于环境保护,有益于人体健康的各种绿色商品,如绿色食品、绿色化妆品、绿色纺织品等。微生物生产天然染色剂,既高产又绿色环保,有着广阔前景。红曲霉发酵的研究以固态和液态发酵的研究较多[1-2]。采用固定化细胞技术可大大提高红曲色素发酵产量[3-5]。近年有报道红曲霉发酵过程添加酵母发酵液促进红曲色素产量的报道[6-8]。本研究以固定化双菌耦合发酵生产红曲红色素进行了探索。
1 材料与方法
1.1 试剂
海藻酸钠(Merck CO.Inc);酵母膏(Difcp laboratories);其余试剂均为分析纯。
1.2 菌株和培养基
1.2.1 菌种
红曲霉(Monascus M101)经诱变所得的高产变异菌株,酵母(Saccharomyces cerevisiae)均由浙江科技学院生物工程实验室保藏。
1.2.2 斜面培养基及培养条件
红曲霉的培养:
麦芽汁琼脂斜面培养基 (浓度均为质量分数):葡萄糖1%,酵母膏0.3%,麦芽汁粉0.2%,蛋白胨0.3%,琼脂2%,pH 6,灭菌.接种后30℃培养5~6 d。
发酵培养基:葡萄糖7%,蛋白胨3%,NaNO30.2%,MgSO4·7H20 0.1%,pH 自然,115℃,25 min灭菌。
酵母的培养:
麦芽汁琼脂斜面培养基 (浓度均为质量分数):葡萄糖1%,酵母膏0.3%,麦芽汁粉0.2% ,蛋白陈 0.3%,琼脂 2%,pH 6,灭菌、接种后 30℃培养 1~2 d。
发酵培养基:同红曲霉发酵培养基。
培养条件:从活化2 d的麦芽汁斜面上挑取酵母接种到液体培养基中,于30℃,120 r/min摇床培养 1~3 d。
1.3 实验方法
1.3.1 固定化细胞粒子的制备
取培养5 d的红曲霉菌斜面,取用10 mL的无菌水洗下表面的孢子,置于装有玻璃珠的50 mL无菌水三角烧瓶中,在120 r/min的条件下振荡1 h。取培养2 d的酿酒酵母斜面(与红曲菌差时培养)加入10 mL无菌生理盐水制备酵母菌悬液后。将两种菌的菌悬液(孢子浓度为6×106/mL左右)分别与灭过菌的4%海藻酸钠溶液混匀后分别滴入5%CaCl2无菌溶液中,于4℃下钙化2 h制成直径为3-4 mm的球形粒子并以无菌生理盐水洗涤2-3次备用。
1.3.2 固定化细胞粒子的培养
钙化后的两种微生物固定化粒子加于增殖培养基。置于30℃,160 r/min的条件下的摇床中进行增殖培养2~3 d。
1.3.3 分析检测定方法[8,12]
发酵液过100目筛,准确吸取5 mL发酵液于试管中,加入95%乙醇,振荡提取1 h后3000 r/mim,离心30 min,取上清液5 mL于试管中加水稀释。稀释液用721分光光度计用0.5 cm比色皿测420 nm和520 nm的吸光度。色价计算公式如下:
色价(U/mL)=OD420×稀释倍+OD520×稀释倍
水溶性色素的分析
发酵液经纱布过滤,将滤液3000 r/min离心30 min,取上清液5 mL于试管中,加水稀释。稀释液用721分光光度计于0.5 cm比色皿测420 nm和520 nm的吸光度。色价计算公式如下:
色价(U/mL)=OD420×稀释倍+OD520×稀释倍
2 结果与讨论
红曲霉发酵产色素过程中对其影响素因素较多[1-3,6,8]。本试验在对红曲霉菌细胞固定化发酵培养条件优化中侧重研究酵母与红曲霉共固定化混合发酵促进色素产生的影响:共固定化细胞粒子中红曲霉菌与酿酒酵母的菌量配比及共固定化细胞重复发酵产色素的稳定性方面考进行考察。
2.1 红曲霉菌固定化细胞的发酵条件研究
2.1.1 红曲霉菌固定化细胞的发酵最适pH值的确定
红曲在培养基中能充分繁殖并生成大量的色素,培养基适宜pH值是至关重要的[1,10-11]。首先进行红曲霉菌固定化细胞的发酵最适pH值的试验。将发酵培养基的初始pH值分别设定为3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0 进行发酵实验,结果如表1。

表1 红曲霉固定化细胞发酵培养基适宜pH值情况
由表1可看出发酵培养基初始pH值为5~6时,红曲霉固定化细胞发酵色素产量较高。故以下实验发酵培养基的初始pH值均调为5~6。
2.1.2 红曲霉菌固定化细胞发酵适宜温度的确定
温度是影响微生物的生长与代谢的重要因素。为了考察培养红曲霉菌发酵产色素的适宜温度,实验分别设定了 20℃,25℃,30℃,32℃,35℃,40℃的发酵温度进行发酵试验,实验结果如表2。

表2 红曲霉固定化细胞发酵适宜温度情况
由表2的实验结果表明,当温度为30℃时,红曲色素产量高,因此以下实验发酵温度为30℃。
2.1.3 红曲霉固定化细胞发酵适宜通气量的确定
红曲为好气性菌,它的耗氧量随着它的生理状态的不同而异,其细胞的生长与色素的形成都需要有足够的氧气供给[3,9]。为达到最高的色素产量与最低的动力消耗,优化适宜的溶解氧的供给是极为必要的。为此,在通入恒定压力的压缩空气,分别以 0.1 vvm,0.15 vvm,0.25 vvm,0.35 vvm,0.5 vvm进行培养试验。
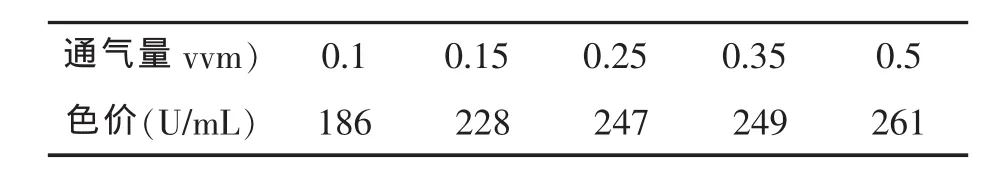
表3 红曲霉固定化细胞发酵适宜通气量情况
由表3的结果可知,随着通气量的增加,红曲的代谢速度加快,菌体量和色素产量增加。但是当通气量由0.35 vvm增加至0.5 vvm时色素产量增加幅度并不大,故通气量以选用0.35 vvm为宜。
2.1.4 红曲霉固定化细胞发酵适宜细胞接入量的确定
接种量的多少对微生物的发酵有着重要影响。为了考察接种量对红曲霉发酵中菌体生长和色素产量的影响,分别设定了红曲霉固定化细胞粒子的接入量为 10%,15%,20%,25%,30%的红曲霉固定化细胞粒子,发酵周期为60 h。
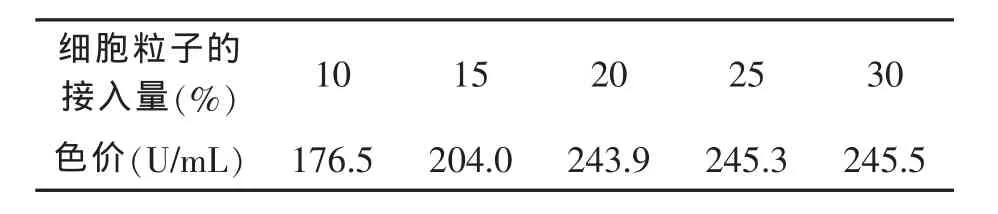
表4 红曲霉固定化细胞粒子的接入量情况
由表4的结果可知,随着固定化细胞粒子接入量的加大,发酵液中色素浓度的积累加快。当固定化细胞粒子接入量由20%增为25%时,色价由243.9 U/mL增加至245.3 U/mL,可见随着固定化细胞接入量的增加到一定值,红曲霉产色素的色价增加并不十分显著,加大接种量会增加菌种制备的工作量和降低生物反应器的有效工作体积。因此,红曲霉固定化细胞发酵生产红曲色素时固定化细胞粒子的接入量选取为20%为宜。
从上述的红曲霉菌的固定化细胞培养的各项单因素实验可看出,红曲霉菌固定化细胞发酵培养的适宜条件为:pH为6左右,接种量20%左右,发酵温度为30℃左右,通气量为0.35 vvm左右。
2.2.1 红曲霉菌与酵母菌共固定化细胞的发酵培养
在红曲霉菌与酵母菌混合共固定化细胞的发酵培养适宜条件的基础上,进行了双菌混合菌体量配比比例对发酵产色素的影响实验,设定发酵培养基初始pH为6,接种量20%,发酵温度为30℃,通气量为0.35 vvm。红曲霉菌与酵母菌混合比 例 设 为 :1:0,1:1,1.5:1,2:1,2.5:1,3:1,3.5:1,4:1,4.5:1,5:1进行双菌共固定化耦合发酵考察实验,结果见表5。
表5的实验结果表明,红曲霉菌与酵母菌混合固定化细胞粒子中,酵母菌的代谢分泌产物对红曲霉菌形成色素有刺激促进作用。随着固定化粒子内红曲霉菌菌量与酵母菌菌量的混合比例在一定的范围内递增这种刺激促进作用增大。从红曲霉菌与酵母菌共固定化细胞的双菌混合配比对发酵产色素实验结果可以看出,红曲霉菌与酵母菌混合比例为1:0时色价为238 U/mL;而红曲霉菌与酵母菌混合菌量比为1:1时,红曲霉产色素的色价仅为73 U/mL;而当红曲霉菌与酵母菌混合菌量配比4:1时红曲霉产色素的色价为389 U/mL,而后随红曲霉菌与酵母菌混合配比量的继续加大,当菌体量配比为5:1时色价反而下降为237 U/mL。上述实验结果表明,红曲霉菌与酵母菌混合比例为1:1时,可能由于酵母菌的菌体量过大其代谢产物分泌量也较大。过量的代谢分泌产物对红曲霉菌产色素产生非但没有促进反而产生抑制效应;而当两种微生物的菌体量的混合配比量为5:1时,红曲霉产色素的色价降低为237 U/mL,这可能是由于红曲霉菌与酵母菌混合固定化细胞粒子中的酵母菌体量过少其代谢产物量不足,导致刺激促进作用削减。从上述实验结果可看出红曲霉菌与酵母菌混合固定化细胞粒子中红曲霉菌菌体量与酵母菌体菌量的混合配比为4:1时酵母菌的代谢分泌产物对红曲菌产色素的刺激促进作用的强弱适中。

表5 红曲霉菌与酵母菌配比混合固定化细胞培养的情况
2.2.2 红曲霉菌与酵母菌混合固定化细胞粒子的重复发酵
固定化细胞技术的主导优势所在就是固定化细胞粒子可重复使用。固定化细胞发酵性能的稳定及固定化细胞粒子机械强度是考核固定化细胞性能的重要指标。对红曲霉菌与酵母菌混合共固定化细胞进行了20批次的重复发酵实验,考察其产色素稳定情况,结果如表6所示。
从表6的实验结果可以看出,采用红曲霉菌与酵母菌混合共固定化发酵红曲色素,固定化细胞经20批次重复发酵,红曲霉菌与酵母菌混合固定化细胞产色素一直稳定在较高水平。同时从实验看出,以4%浓度的海藻酸钠作为固定化凝胶,固定化细胞粒子的机械强度效果较好。
3 讨论
由实验结果可看出:①采用固定化红曲霉菌细胞发酵红曲色素比红曲霉菌游离细胞发酵红曲色素产量有大幅度提高[3-5]。红曲霉菌与酵母菌混合固定化细胞发酵过程中,红曲霉菌产红曲色素比红曲霉菌单菌固定化发酵产红色素提高了60%,说明红曲霉菌与酵母菌混合固定化细胞耦合发酵是提高天然染色剂红曲色素生产产量的可行而有效的途径。②采用红曲霉菌与酵母菌混合固定化耦合发酵红曲色素产量相较于红曲霉菌单细胞固定化发酵的大幅提高,说明了红曲霉菌与酵母菌混合共固定化发酵红曲色素的发酵过程中酵母菌的代谢分泌产物对红曲霉菌细胞能刺激促进红曲霉菌红色素的形成。推测可能是酵母生长代谢过程中所分泌的几丁质酶等可能是主要刺激因子[12]。本实验的结果表明通过红曲霉菌与酵母菌混合固定化细胞耦合发酵,提高天然染色剂红曲色素产量的关键点是要控制适宜的两种微生物的菌体量配比比例。③由于采用细胞包埋固定化法固定红曲霉菌与酵母菌,发酵液中游离菌丝减少,所以发酵液黏度低,有利于氧气及营养物的传递,更重要的是便于色素的分离和提取,有利于下游工序的操作进而降低成本[1-2,5]。

表6 双菌混合固定化细胞重复发酵产色素及固定化机械强度情况
[1]张名光,常韩生,林长勇.红曲菌生产红曲色素的研究[J].食品与发酵工业,1982(6):1-68.
[2]傅亮,周卫兵,高孔荣.红曲色素高产菌株发酵特性的研究[J].食品科学,1996,17(3):6-9.
[3]王克明.复合载体固定化细胞红曲色素发酵条件的研究[J].中国酿造,2005(6):30-39.
[4]王克明,王雪筠.流加糖发酵提高红曲色素产量的研究[J].中国调味品,1995(6):1-10.
[5]王克明.PVA固定化生产红曲色素的研究[J].烟台大学学报,1998(11):306-309.
[6]王克明,钟建江.利用纷丝废液固定化红曲发酵红曲色素的讲究[J].菌物系统,2003(22):136-139.
[7]Shin C S,Kim H J,Kim M J,et al.Morphological change and enhanced pigment production of Monascus when cocultured with Saccharomyces cerevisiae or Aspergillus oryzae[J].Biotechnology and bioengineering,1998,59(5):576-581.
[8]张泳权,张亮瑜,谈家林.红曲色素的分析测定[J].食品与发酵工业,1985(6):34-37.
[9]Evans P J,Wang H Y.Pigment production from immobilized Monascus sp.utilizing polymeric resin adsorption[J].Applied and environmental microbiology,1984,47(6):1323-1326.
[10]Wong H C,Koehler P.Production and isolation of an antibiotic from Monascus purpureus and its relationship to pigment production[J].Journal of Food Science,1981,46(2):589-592.
[11]Wang H C.Regulation of growth and antibiotic from Monascuspurreus by carbon and nitrogen concentration[J].Mycologia,1981,(73):649-658.
[12]天津轻工学院等.工业发酵分析[M].北京:工业出版社,1980:1-421.

