传统农家大酱中耐盐性乳酸菌的分离与鉴定*
徐鑫,王茜茜,王晓蕊,薛亚婷,乌日娜
(沈阳农业大学食品学院,辽宁沈阳,110866)
大酱是以大豆为主要原材料,利用米曲霉、酵母菌、乳酸菌等微生物,经过几个月的自然发酵,最终形成的半流动状态的发酵性食品[1]。大酱又称黄豆酱、大豆酱、黄酱,我国北方地区称大酱。其色泽为红褐色或棕褐色,鲜艳,有光泽;有明显的酱香和醋香,咸淡适口,呈黏稠适度的半流动状态。豆酱不仅可以作为调味品,而且富含丰富的营养物质。由于经过发酵,所以极易被人体吸收。事实上,它不单是一种调味品,而且是一种副食品,在人们的日常饮食中占有重要地位,尤其在东北地区,是一种深受广大人民欢迎的传统型发酵食品。大豆酱的风味非常独特,其风味的形成主要是由发酵过程中微生物的生物化学反应引起的,与风味形成有关的微生物群落主要是酵母菌和乳酸菌。
乳酸菌(lactic acid bacteria)是一类革兰氏阳性,过氧化氢酶反应阴性的杆菌或球菌,它不形成芽孢、不运动,能发酵碳水化合物产生50%以上乳酸的一类细菌的总称[2]。基于形态学、不同生长温度、葡萄糖发酵方式、产生乳酸的构型、酸或碱的耐受性以及高盐浓度下的生长能力对乳酸菌菌属进行分类。目前,乳酸菌在分类学上大致可以分为23个属,包括乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、双歧杆菌属(Bifidobacterium)、肠球菌属(Enterococcus)、肉食杆菌属(Carnobacterium)、链球菌属(Streptococcus)、明串珠菌属(Leuconostoc)、气球菌属(Aerococcus),片球菌属(Pediococcus)、漫游球菌属(Vagococcus)、奇异菌属(Atopobium)、李斯特氏菌属(Listeria)、真丝菌属(Eubacterium)、芽孢杆菌属(Bacillus)中的少数种、芽孢乳杆菌属(Sporolactobacillus)、丹毒丝菌属(Erysipelothrix)、四联球菌属(Tetragenococcus)、环丝菌属(Brochothix)、魏斯氏菌属(Weissella)、糖球菌属(Saccharococcus)、孪生菌属(Gemella)、酒球菌属(Oenococcus)、营养缺陷菌属(Abiotrophia)[3]。
乳酸菌不仅有利于食品发酵,改善风味,提高营养价值等功能,而且其作为存在人体内的益生菌,还能对人体的生理功能起到有益的调节作用[4]。近年来对乳酸菌的研究表明,乳酸菌有很多特殊的保健功能,如改善肠道功能、产细菌素、抗肿瘤、增强免疫力、抗氧化能力、降低胆固醇、产生相关酶类等有益功能。
乳酸菌发酵食品是一种国内外消费者喜爱的营养保健食品。发酵大酱用的生产菌株是乳酸菌,大酱中含有较高浓度的盐,在生产过程中乳酸菌的生长会受到盐浓度的影响而受到抑制。筛选出专用于发酵大酱的乳酸菌种对于在发酵大酱生产中缩短生产周期、提高食品安全性和稳定产品质量起着关键性的作用。
本实验旨在从农家大酱中筛选出耐盐性较好的乳酸菌菌株,并采用16S rDNA的方法对该菌株进行鉴定,意在实现农家大酱的安全化、工业化生产,并为构建东北地区乳酸菌菌种资源库做出贡献。
1 材料与方法
1.1 材料
1.1.1 样品
农家大酱:采自辽宁沈阳、大连、抚顺,本溪共15个样品。
1.1.2 培养基与试剂配制
MRS培养基配方:葡萄糖20.0 g/L,MnSO4·4H2O 0.25 g/L,牛肉浸膏8 g/L,MgSO4·7H2O 0.58 g/L,蛋白胨8 g/L,吐温·80 1 g/L,酵母粉4 g/L,柠檬酸钠2 g/L,三水乙酸钠5 g/L,K2HPO42 g/L,临用前添加1%CaCO3,121℃高压灭菌20 min。
10×TE缓冲液:1 mol/L Tris-HCl Buffer(PH:7.4、7.6、8.0)100 mL,0.5 mol/L 的 EDTA 20 mL(pH:8.0),定容 1L,121℃、20 min 灭菌备用。
1 mol/L Tris-HCL(pH 8.0):称取121.1g Tris溶于800 mL无菌水中,加浓HCl调pH到8.0,定容至1L,高压灭菌。
0.5 mol/L EDTA(pH 8.0)186.1g EDTA-Na·2H2O溶于800 mL无菌水中,需用磁力搅拌器剧烈搅动,用NaOH调pH值到8.0(约20g),定容至1L,高压灭菌。
10%SDS:称取SDS 10g于100~200 mL烧杯中,加80 mL双蒸水中60℃加热溶解,用 HCl调 pH至7.2,定容至100 mL,室温保存。灭菌10 mol/L CTAB(十六烷基三甲基溴化铵):10g CTAB溶于80 mL无菌水中,定容至100 mL,高压灭菌。
0.7 mol/L NaCl:4.095 g NaCl溶于80 mL无菌水中,定容100 mL,高压灭菌。
酚、氯仿、异戊醇:Tris-饱和酚从4℃冰箱中取出,上层为保护液,取下层黄色酚相使用。按比例与氯仿、异戊醇混合,放入4℃冰箱存放。
1.1.3 仪器与设备
LDZX-50KBS型立式压力蒸汽灭菌锅,上海申安医疗器械厂;UV-4802紫外可见分光光度计,尤尼柯(上海)仪器有限公司;生物洁净工作台,苏州市华宇净化设备有限公司;Centrifuge 5418R小型台式冷冻离心机,(德国)Eppendorf;DNP-9080型生化培养箱、恒温水浴锅,上海精宏试验仪器有限公司;VS-1型涡旋仪,上海泸西分析仪器厂有限公司;尼康生物显微镜,南京江南光电(集团)股份有限公司;ND-100型微量紫外分光光度计,上海美析仪器有限公司;DW-86L486型超低温保存箱,青岛海尔特种电器有限公司;CDS8000型UPV凝胶成像分析系统、PTC-200型梯度基因扩增仪、电泳仪,美国伯乐公司。
1.2 方法
1.2.1 农家大酱的采样
将农民家庭以传统方法制作的大酱,在其发酵容器中充分搅拌后,取20g左右大酱加入封口袋中封存,将收集的样品放入提前准备好的冰盒内冷却,间隔一段时间需要更换一次冰袋,使大酱保存在较低温度状态下带回实验室,然后放入 -20℃冰箱冻存,尽快进行乳酸菌的分离,防止菌体死亡。
1.2.2 乳酸菌的分离纯化
称取1 g大酱样品,加入含有10 mL生理盐水的灭菌试管中,按照10倍梯度稀释法稀释大酱样品至10-8g/mL。分别取 10-6g/mL、10-7g/mL、10-8g/mL 3个梯度样品100 μL,采用涂布法将样品接种于MRS琼脂培养基上,将培养皿放入BBL厌氧培养罐中,在罐中加入保险粉以除去氧气。分别将培养罐置于20、30、37℃ 3个梯度的培养箱中厌氧培养48h。待菌落形成后,用接种环挑取疑似乳酸菌菌落形态的单个菌落,接种于 MRS液体培养基中,置于37℃培养箱中培养24 h。对菌体采用平板划线法进行纯化,仔细观察菌落形态以及革兰氏染色后的细胞形态特征,在显微镜油镜下挑选视野清晰且形态典型的菌体,进行拍照记录,并同时进行过氧化氢酶试验。凡是革兰氏染色呈阳性、过氧化氢酶试验为阴性的菌株,均暂定为乳酸菌,并进一步培养穿刺保存。
1.2.3 耐盐性乳酸菌筛选
将初步鉴定得到的疑似乳酸菌保存菌株用接种针挑去部分菌体,接种于5 mL已灭菌的MRS培养基中,于37℃培养箱中培养24 h,作为活化1代菌。用移液枪吸取200 μL一代菌接种于5 mL已灭菌的MRS培养基中,于37℃培养箱中培养24 h,作为活化2代菌。以此方法将菌株活化至3代,第3代培养12 h,此时菌株的活性最好。吸取混匀后的3代菌液100 μL分别加入 5 mL NaCl浓度分别为 4%、6%、8%、10%、14%、16%、20%的 MRS液体培养基中,37℃培养24h。培养液用涡旋仪混匀后,以空白MRS液体培养基调零,在波长600 nm处,测OD值。
1.2.4 乳酸菌的生理生化鉴定
取革兰氏阳性和过氧化氢酶阴性菌落按照东秀珠、蔡妙英[5]的常见细菌系统鉴定手册方法,对菌株进行生理生化试验。
1.2.5 分离株的保存
采用真空冷冻干燥法[6]对菌体进行冻干保存。
1.2.6 供试菌液的制备
将采用真空冷冻干燥法冻干保存的菌种,接种于MRS液体培养基中,37℃培养24 h,活化3代。经革兰氏染色镜检确定为纯菌后,取第3代MRS液体培养物,12 000 r/min离心10 min,弃掉上清液,在沉淀中加入5 mL灭菌生理盐水,12 000 r/min、10 min(4℃)离心洗涤菌体,重复离心洗涤菌体2次。最后加入5 mL灭菌生理盐水,用涡旋仪振荡混匀,即为供试菌液。
1.2.7 总DNA的提取
采用优化后的CTAB法[7]提取DNA。
1.2.8 乳酸菌基因组DNA纯度检测
分别取1 μL上述制备的乳酸菌基因组DNA原液,用ND-1000型微量紫外分光光度计检测乳酸菌基因组DNA的浓度以及在吸光度为260、280时的OD值。
1.3 PCR扩增
1.3.1 扩增引物
16S rDNA扩增引物采用通用引物[8-9],正向引物为27f(对应于Escherichia coli 8-27位碱基):5'-AGAGTTTGATCCTGGCTCAG-3';反向引物为 1495r(对应于 Escherichia coli 1495-1515位碱基):5'-GGCTGCTGGCACGTAGTTAG-3',由上海美吉生物医药科技有限公司合成。PCR扩增片段约为1 500 bp。
1.3.2 扩增体系以及循环参数
将上述制备的基因组 DNA作为PCR扩增的模板,采用20μL反应体系(表1)进行 PCR扩增。
PCR反应条件为:95℃ 预变性5 min;95℃ 变性30 s,55℃ 退火 30 s,72℃ 延伸 1 min 30 s,循环 24次;72℃ 末端延伸10 min;10℃ 保温。
1.3.3 PCR产物检测
预先制备1.0%的琼脂糖凝胶(含溴化乙锭),扩增反应完毕后,取5 μL的 PCR产物与 1μL Loading buffer混合,将样品加样于琼脂糖凝胶点样孔中进行电泳,电压5 V/cm,电泳液为1×TAE。大约20 min后,电泳结束,紫外灯下观察。如果 PCR成功,则可见到约为1 500 bp的条带。
1.3.4 16S rDNA序列测定及分析
将扩增成功的PCR产物用保温盒(内含冰袋)寄到上海美吉生物医药科技有限公司测序,测得菌株16S rDNA基因序列后,将基因序列在NCBI上使用BLAST进行同源性比对,同时从GenBank数据库中获得公认标准序列数据,并用MAGE软件包以Neighbor Join法制作系统发育树[10]。

表1 PCR扩增体系Table 1 PCR amplification system
2 结果与分析
2.1 农家大酱中乳酸菌的初步鉴定
2.1.1 农家大酱筛选后的菌落形态观察结果
从15个样品中分离获得典型的菌株62株,从沈阳大酱样品中筛选出14株菌株,按照大酱采集地编号为SY1~SY14;从大连大酱样品中筛选出16株菌株,按照大酱采集地编号为DL1~DL16;从抚顺大酱样品中筛选出15株菌株,按照大酱采集地编号为FS1~FS15;从本溪大酱样品中筛选出17株菌株,按照大酱采集地编号为BX1~BX14。菌株在MRS固体培养基上,为白色或乳白色,圆形菌落,表面光滑有光泽,中间凸起,边缘整齐,如图1所示。

图1 5株乳酸菌菌落形态学特征Fig.1 Colony morphological characteristics of 5 LAB strains
2.1.2 农家大酱中乳酸菌初步鉴定结果
对从农家大酱中分离得到的62株疑似乳酸菌菌株进行纯化,对纯化后菌株进行革兰氏染色。显微镜油镜下观察显示,在这些菌株中有革兰氏阳性菌36株,包括球状菌株16株,杆状菌株20株。结果如图2所示。

图2 5株乳酸菌株的革兰氏染色菌体形态Fig.2 Morphology after gram stain of 5 LAB strains
对36株革兰氏阳性菌进行过氧化氢酶试验,发现10株疑似乳酸菌呈阳性反应,另外有26株为阴性反应。通过革兰氏染色和过氧化氢酶试验从62株疑似乳酸菌株中获得革兰氏阳性、过氧化氢酶阴性的菌株26株,结果见表2。
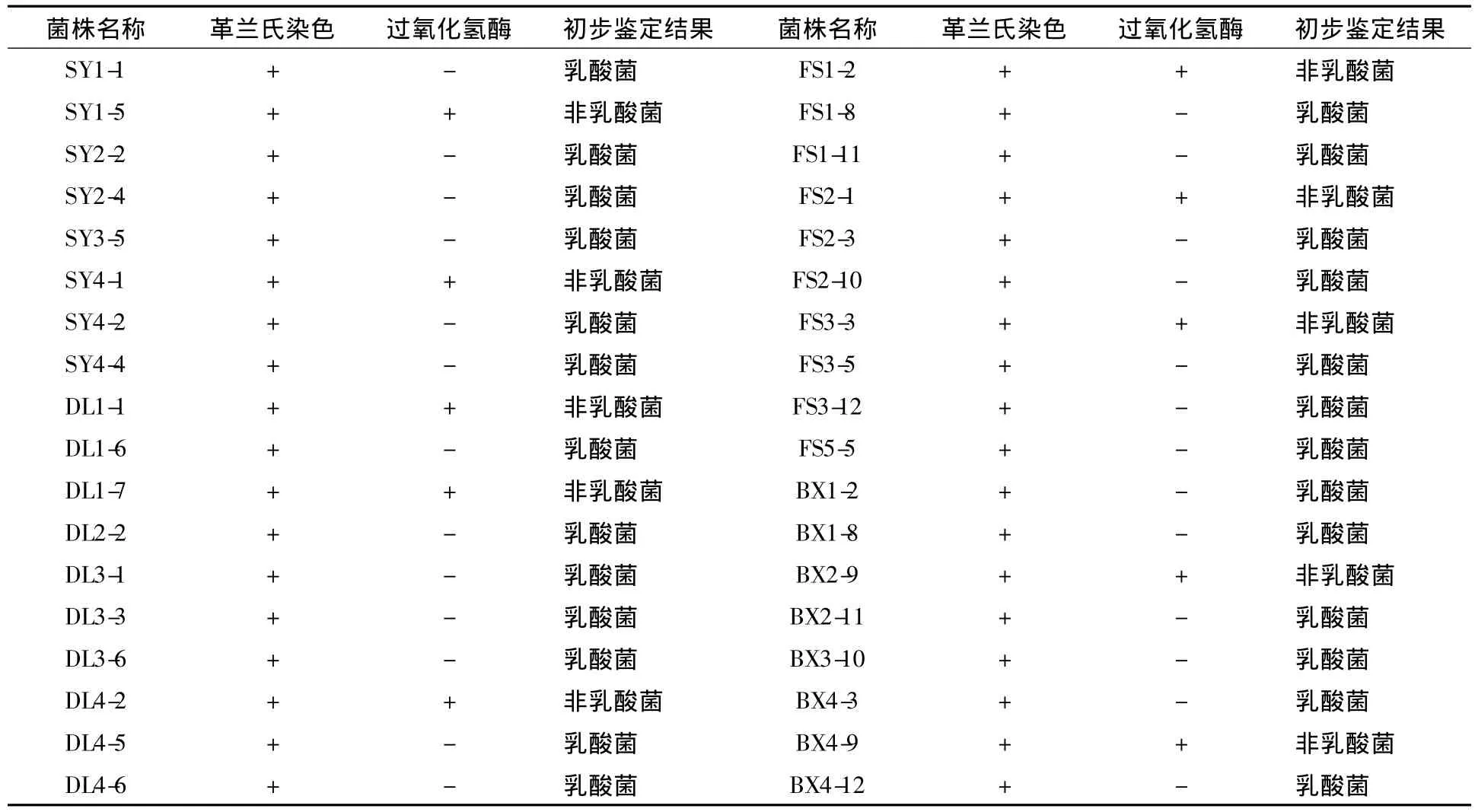
表2 从农家大酱中分离得到的菌株初步鉴定结果Table 2 Preliminary identification result of the isolated strains from soybean paste
2.1.3 耐盐性乳酸菌的筛选
在大酱发酵过程中,NaCl含量在8%左右。高浓度的NaCl能够抑制某些致病和腐败微生物的生长繁殖,但也会对乳酸菌的代谢活动产生影响[11]。乳酸菌的生长受到抑制,对最终大酱质量有很大影响,所以耐盐的乳酸菌对大酱品质的好坏起着决定性作用[12]。文中对筛选出的26株疑似乳酸菌在不同 盐浓度的MRS液体培养基中生长状况进行研究分析,同时以吸光值变化作为菌株的生长指标,研究其对不同 NaCl浓度的耐受能力,结果见表3。
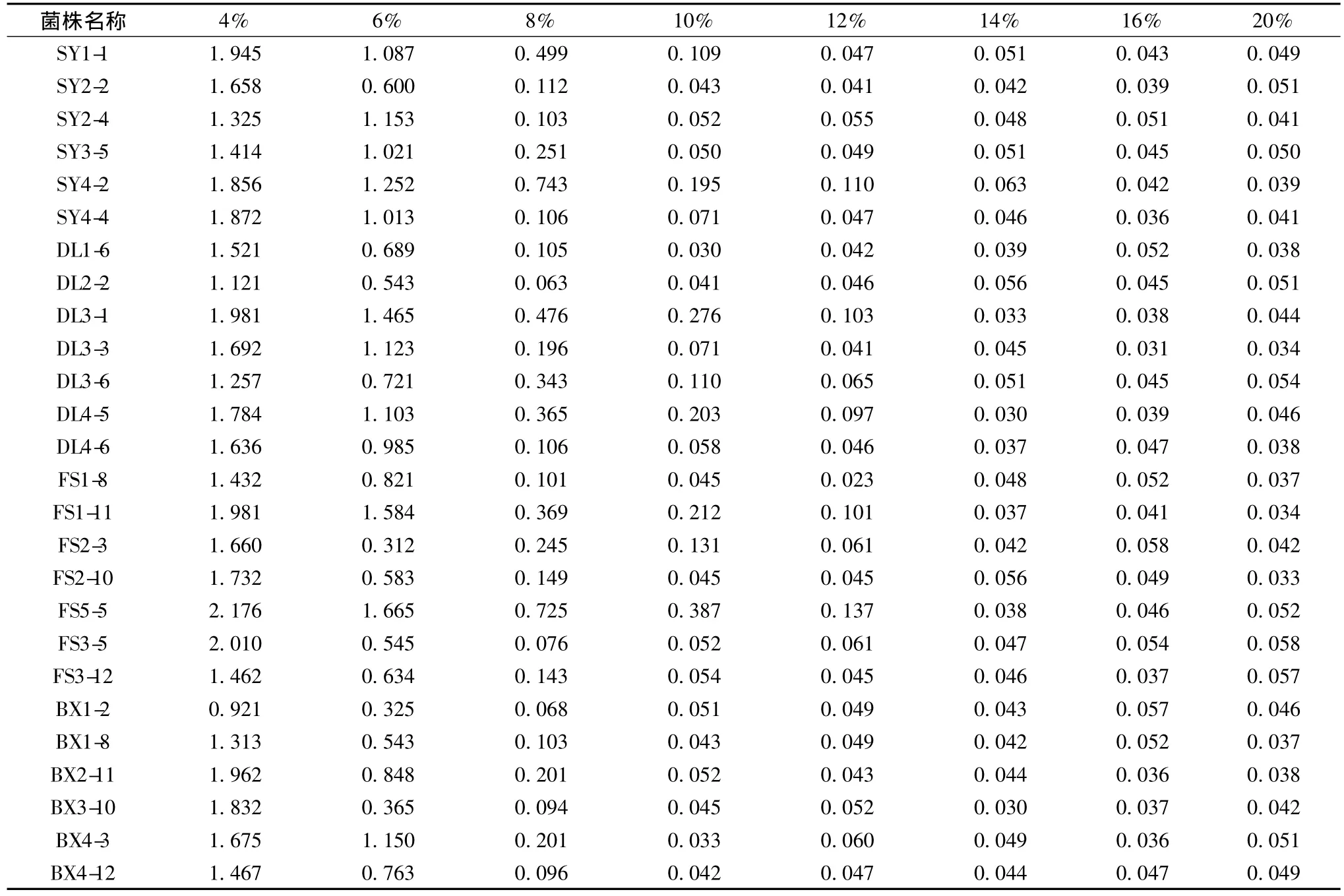
表3 26株乳酸菌株在不同NaCl浓度下生长情况Table 3 Growth situation of 26 LAB strains under different concentration of NaCl
由表3中数据可以看出,随着培养基中 NaCl浓度不断升高,26株乳酸菌的OD600值在逐渐变小。在NaCl浓度为4% 的MRS培养基中,26株乳酸菌基本不受影响,生长状况良好,OD600值在 0.921~2.176之间;NaCl浓度为6%的MRS培养基中,部分菌株生长状况受到影响,OD600值在0.312~1.584之间;当NaCl浓度上升到8%时,大部分乳酸菌的生长受到了抑制,其中菌株 SY1-1、SY3-5、SY4-2、DL3-1、DL3-6、DL4-5、FS1-11、FS2-3、FS5-5 的 OD600值相对较高,表明这7株菌有一定的耐受能力;当 NaCl浓度为10%时,只有菌株 SY4-2、DL3-1、DL4-5、FS1-11、FS5-5的 OD600值在0.195以上,依然可以生长;当 NaCl浓度增加到12%时26株乳酸菌OD600值降低较为明显,菌株 SY4-2、DL3-1、DL4-5、FS1-11、FS5-5 的 OD600值在0.100左右;当 NaCl浓度上升到14% ~20%时,26株乳酸菌生长 OD600值一直维持在0.030~0.060之间,考虑到接种的影响,我们可以初步断定26株菌几乎不生长。因此,筛选得到5株具有较高耐盐能力的乳酸菌,即菌株 SY4-2、DL3-1、DL4-5、FS1-11、FS5-5,这5株菌的耐盐浓度可以达到12%左右。
2.1.4 生理生化试验结果
对筛选出的5株疑似乳酸菌菌株进行生理生化试验,结果见表4。
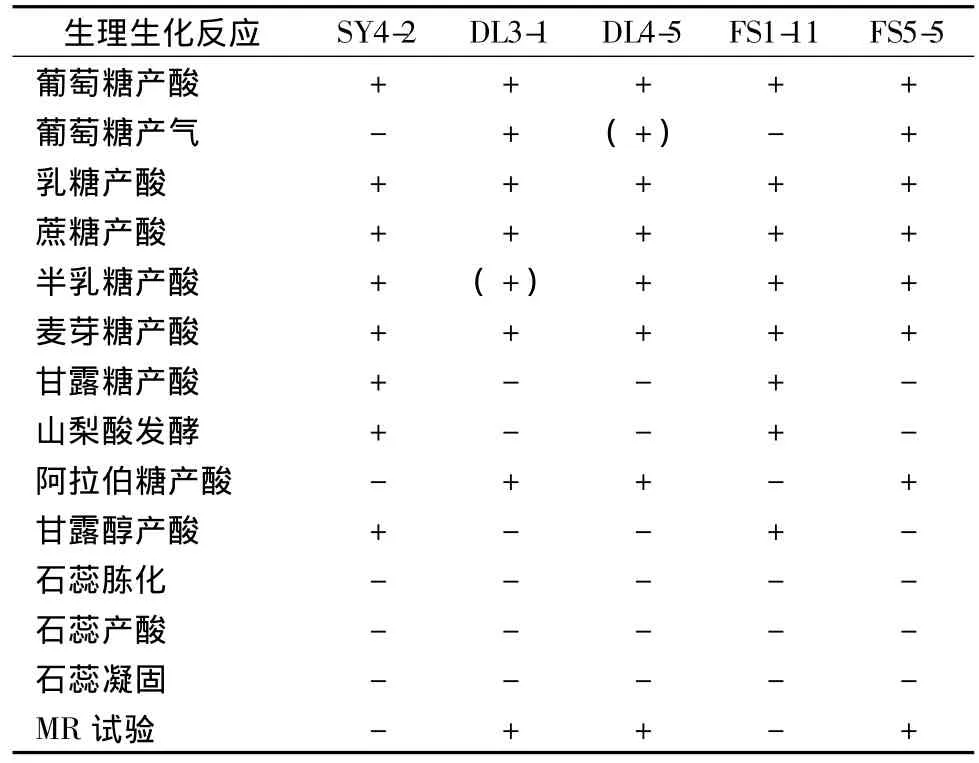
表4 5株乳酸菌的生理生化特征Table 4 Physiological and biochemical characteristics of 5 LAB strains

注:“+”为阳性反应;“-”为阴性反应;“(+)”为弱阳性反应;“(-)”为弱阴性反应。
综上所述,根据菌株的形态学特征并参照《伯杰细菌鉴定手册》第八版[13],对5株乳酸菌的生理生化实验结果进行分析。结果表明,菌株 DL3-1、DL4-5、FS5-5均属于乳杆菌属(Lactobacillus sp.),菌株SY4-2、FS1-12属于肠球菌属(Enterococcus sp.)。
2.2 16S rDNA基因序列同源性分析结果
2.2.1 乳酸菌基因组DNA提取结果
实验中采用优化后的CTAB法提取供试菌株基因组DNA,分别用ND-1000型微量紫外分光光度计检测DNA纯度及含量。基因组DNA检测结果如表5所示。
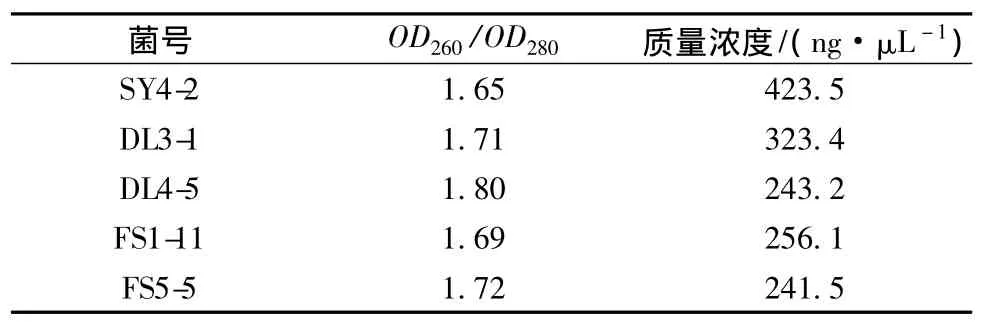
表5 基因组DNA检测结果Table 5 Genome DNA test results
从表5得知,CTAB法提取的基因组DNA浓度最低的是 FS5-5,为 241.5 ng/μL,最高为 SY4-2,为423.5 ng/μL。OD260/OD280值均在1.70附近。说明基因组DNA受到微量蛋白质或酚类物质的影像,但是能满足后续16S rDNA扩增和测序的需要。
2.2.2 16S rDNA区域PCR扩增检测结果
用质量分数为1.0%的琼脂糖凝胶,对5株供试菌株的基因组DNA的PCR扩增产物做琼脂糖凝胶电泳检测,通过凝胶成像分析系统得到5株菌株的16S rDNA PCR扩增的琼脂糖凝胶电泳图,如图3所示。
从图3看出,在约1 500 bp处出现荧光条带,2号菌的条带稍暗,但并不影响结果。说明PCR扩增成功,能满足后续16S rDNA测序的需要。
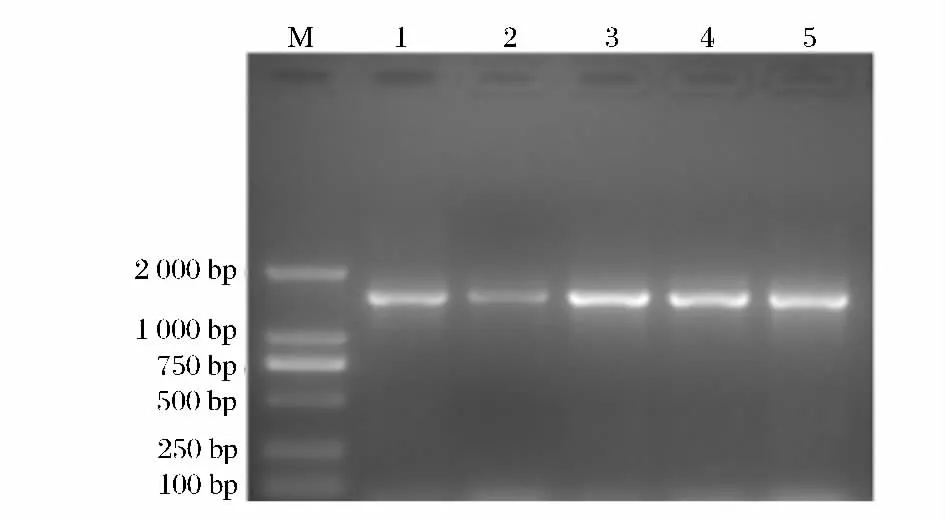
图3 16S rDNA PCR扩增后的琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis map of 16S rDNA amplification products
2.2.3 测序结果及系统发育树的构建
将PCR扩增成功的DNA样品送至上海美吉生物医药科技有限公司进行测序。测得16S rDNA基因序列分析显示,菌株SY4-2的16S rDNA基因序列长度有1 379bp核苷酸;菌株DL3-1的16S rDNA基因序列长度有1 417bp核苷酸;菌株DL4-5的16S rDNA基因序列长度有1 419bp核苷酸;菌株FS1-11的16S rDNA基因序列长度有1 413bp核苷酸;菌株FS5-5的16S rDNA基因序列长度有1 432bp核苷酸。将测序获得的基因序列与NCBI中相关乳酸菌菌株的16S rDNA基因序列进行同源性分析,并用MEGA软件以Neighbor Join法绘制系统发育树[14]。结果如图4所示。
如图4所示,从总体上可将这10株乳杆菌分为两大群,即 FS5-5、Lactobacillus plantarum YML007、Lactobacillus plantarum IMAU32388、DL4-5、DL3-1 和Lactobacillus plantarum P10为第一群,其余乳杆菌菌株组成第二群。第一群中,菌株FS5-5、DL4-5、DL3-1与 Lactobacillus plantarum YML007、Lactobacillus plantarum IMAU32388处于同一分支,同源性较高。在第二群中,菌株FS1-11与所在分支的Enterococcus faecium S4-4系统位置最近,同源性可以达到99%,还有Enterococcus faecium和SY4-2与其在同一分支。综上所述,我们可以鉴定菌株DL3-1、DL4-5、FS5-5为植物乳杆菌,SY4-2、FS1-12为屎肠球菌。
3 结论与讨论
3.1 结论
本研究采用传统微生物的分离培养方法对农家大酱中的乳酸菌进行了分离。利用NaCl作为外界胁迫条件,对筛选出的乳酸菌进行耐盐性实验,挑选出5株耐盐性较好的菌株。对这5株菌提取DNA,并通过PCR技术将其扩增,采用16S rDNA技术对这5株菌进行鉴定。
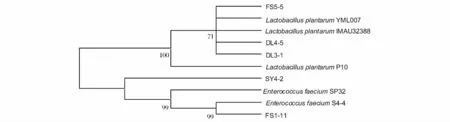
图4 菌株的系统发育树Fig.4 Phylogenetic tree of strain
(1)从15个样品中分离获得典型的菌株62株,菌株在MRS固体培养基上,为白色或乳白色,圆形菌落,表面光滑有光泽,中间凸起,边缘整齐。通过革兰氏染色与过氧化氢酶试验,从62株疑似乳酸菌的菌株中筛选出革兰氏阳性、过氧化氢酶阴性的乳酸菌菌株26株。
(2)利用NaCl作为外界胁迫条件,当 NaCl浓度增加到 12%时,菌株 SY4-2、DL3-1、DL4-5、FS1-11、FS5-5的 OD600值在0.100左右。与其他菌株相比,这5株菌具有较好的耐盐特性。耐盐浓度可以达到12%左右。对耐盐性较好的5株菌株进行生理生化实验,根据菌株的形态学特征并参照《伯杰细菌鉴定手册》第八版[13],对5株乳酸菌的生理生化实验结果进行分析。结果表明,菌株 DL3-1、DL4-5、FS5-5均属于乳杆菌属(Lactobacillus sp.),菌株 SY4-2、FS1-12属于肠球菌属(Enterococcus sp.)。
(3)对这5株菌提取DNA并经过PCR扩增,最后采用16S rDNA的方法进行鉴定。结果显示5株菌中,DL3-1、DL4-5、FS5-5 为植物乳杆菌,SY4-2、FS1-11为屎肠球菌。
3.2 讨论
大酱作为东北地区典型的发酵性食品而受到人们的欢迎。随着科技的发展,工业化生产的市售大酱进入人们的视野,但是,人们还是喜欢自家手工制作的农家大酱,因为其中有特殊的味道。工业化生产的市售大酱由于需要灭菌而使大酱中的微生物含量较少,本实验采用农家大酱作为原材料也是出于这方面原因。大酱中含NaCl浓度大约8%左右,乳酸菌长时间生长在盐浓度下会发生应激反应,从而使自己更有利的存活下去,这样乳酸菌会对NaCl具有一定程度的耐受性,也更有利于筛选出耐盐性较好的乳酸菌。在大酱的发酵过程中,耐盐性较好的乳酸菌会更适应大酱中的盐环境,从而更好地生长,可以大大缩短大酱的生产周期,稳定产品的质量。
对于基因组的提取,目前采用较多的2种方法为试剂盒法与CTAB法。试剂盒法提取基因组DNA,DNA浓度和纯度较高,提取效率高,可直接用于PCR扩增、测序等,但造价相对昂贵些,适用于少量DNA样品的提取。CTAB法提取基因组DNA,出于安全等多方面因素的考虑,可能在一定程度上影响提取DNA的纯度以及稳定性而使DNA中含有少量的蛋白质、RNA等杂质,但是不会影响后续试验的进行,而且此方法造价低,能满足一般分子生物学实验的需要。为了更好地获得DNA,一方面考虑尽量去除杂质、蛋白和脂类,CTAB在高离子强度的溶液中可以与蛋白质、多糖等物质结合,而不与DNA结合,这里还可以添加一些还原剂比如β-巯基乙醇来避免褐化物质对DNA的影响;另一方面考虑加强DNA的沉淀效果,氯仿-异戊醇可以进一步使蛋白质变性分层并去除脂类,最后用低温预冷的无水乙醇或者异戊醇来沉淀DNA。
本文从农家大酱中获得了耐盐性较好的乳酸菌菌株,但应用菌株对产品品质的提升还需深入研究。下一步工作应该围绕着应用耐盐乳酸菌的发酵性能来改善农家大酱产品品质。同时耐盐性乳酸菌之所以能够耐盐,它的耐盐机理是什么也是要研究的重点。乳酸菌作为益生菌的最大群体,其分布较为广泛,性能优良的乳酸菌更是人们所需要的。它不仅可以提高食品的品质,而且可以促进人体健康,为人类做出贡献。
[1] 赵建新.传统豆酱发酵过程分析与控制发酵的研究[D].无锡:江南大学,2011.
[2] Khalid K.Anoverview of lactic acid bacteria[J].International Journal of Biosciences,2011,1(3):1-13.
[3] Shrestha H,Nand K,Ratie.Microbiological profile of murcha starters and physicochemical characteristics of poko,a rice based traditional fermented food product of Nepal[J].Food Biotechnology,2002,16(1):1-15.
[4] 罗靓芷,武俊瑞,刘佳艺,等.臭鳜鱼中优良乳酸菌的分离筛选与鉴定[J].食品与发酵工业,2013,39(10):132-136.
[5] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:北京科学出版社,2001:269-292.
[6] 熊涛,徐立荣,范镭,等.蔬菜发酵专用乳酸菌的选育[J].食品科学,2008,29(6):264-267.
[7] 王笋,吕嘉枥,辛博,等.西北地区泡菜中乳酸杆菌的生物学特性[J].中国调味品,2014,39(3):15-18.
[8] Cindy D C Gomez-Balderas,Nelly Cochet,Valérie Bert.16S rDNA analysis of bacterial communities associated with the hyper accumulator Arabidopsis halleri grown on a Zn and Cd polluted soil[J].European Journal of Soil Biology,2014,60:16-23.
[9] 夏雪娟,陈芝兰,陈宗道.16S rDNA序列分析法快速鉴定西藏地区传统乳制品中的乳酸菌[J].食品科学,2013,34(14):245-249.
[10] 曲玲童.锦州腌渍小黄瓜中耐盐性乳酸菌的分离鉴定与性能研究[D].锦州:渤海大学,2012.
[11] TANG S K,LI W J,WANG D,et al.Studies of the biological characteristics of some halophilic and halotolerant actinomycetes isolated from saline and alkaline soils[J].Actinomycetol,2003,17:6-10.
[12] Amarela Terzic-Vidojevic,Sanja Mihajlovic,Gordana Uzelac,et al.Characterization of lactic acid bacteria isolated from artisana Travnik young cheeses,sweet creams and sweet kajmaks over four seasons[J].Food Microbiology,2014,39:27-38.
[13] R.E.布坎南,N.E.吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:797-827.
[14] 张洁,徐桂花,尤丽琴.16S rDNA序列分析法鉴定乳酸菌[J].农产品加工·创新版,2009,170(4):47-69.

