日本木瓜和皱皮木瓜过氧化物酶的酶学性质比较*
宋双双,刘峰,刘伟,王晓,Dan Staerk,李圣波,崔莉
1(山东省分析测试中心,山东 济南,250014)2(山东农业大学食品科学与工程学院,山东泰安,271018)
3(山东亚特生态技术有限公司,山东临沂,276017)
日本木瓜[Chaenomeles japonica(Thunb.)Lindl]是蔷薇科(Rosaceae)木瓜属植物,又名倭海棠,原产于日本,中国江苏、浙江、台湾、陕西庭院习见栽培[1-2],其果实为药材的习用品[3],具有化湿和胃,舒筋活络的功效[4]。皱皮木瓜又名汤木瓜、宣木瓜等,是蔷薇科贴梗海棠[Chaenomeles spiciosa(Sweet)Nakai]的近成熟果实,主要产于安徽、浙江、湖北、四川等地[5],功效同日本木瓜[6]。目前对于日本木瓜的研究较少,仅有化学成分的研究[3],关于其果实内的氧化、抗氧化酶类的相关研究鲜见报道。皱皮木瓜中抗氧化酶类的相关报道主要有SOD的分离纯化[7],氧化酶类有多酚氧化酶(PPO)的性质研究[8]等。对于木瓜中的过氧化物酶(POD),仅见番木瓜中POD的纯化及性质研究[9],关于日本木瓜和皱皮木瓜中POD的酶学特性的研究均未见报道。
POD广泛存在于动植物和微生物体内,是一种以血红素为辅基的氧化酶[10],可催化由过氧化氢参与氧化各种还原剂[11]的反应,是果实成熟和衰老的生理指标,参与果实酶促褐变,对果实的色泽及成分含量等造成不良影响。目前,对果蔬POD的纯化及酶学性质研究较广泛,但是对于大部分原料,其不同品种间的POD酶学性质的比较研究还较少。本文通过比较日本木瓜和皱皮木瓜中POD的酶学性质,为进一步深入研究两者POD的结构差异,为提高木瓜加工产品的品质等提供理论基础。
1 仪器与材料
1.1 材料
木瓜果实由山东亚特生态技术有限公司提供,选择大小均一、完整无机械伤、无病虫害的果实,-20℃贮藏。编号A为YATS 115(皱皮木瓜),编号B为西府海棠(日本木瓜)。
1.2 试剂
Tris、愈创木酚、聚乙烯吡咯烷酮、Triton X-100、柠檬酸钠、Na2HPO4、NaH2PO4、MgCl2·6H2O、ZnSO4·7H2O、MnCl2·4H2O、Na2SO3、DTT、曲酸、谷胱甘肽(还原型)、吐温 -80、SDS、偏重亚硫酸钠、EDTA-2Na、环庚三烯酚酮(tropolone),所用试剂均为分析纯。
1.3 仪器
GENESYS 10S UV-VIS紫外可见分光光度计,Thermo;HH-S2数显恒温水浴锅,金坛市医疗仪器厂;Thermo Multifuge X1R离心机,Thermo;人工气候箱,宁波莱福科技有限公司;BAS124S万分之一天平,赛多利斯科学仪器(北京)有限公司。
2 实验方法
2.1 POD粗酶液的提取
A、B 各取 10 g,以 1∶1.5(g∶mL)料液比加入Tris-Hcl缓冲液(20 mmol/L,pH 7.5),加 0.1%(w/v)聚乙烯吡咯烷酮和0.3%(v/v)Triton X-100,低温下研磨,研磨液4℃于10 000 r/min离心20 min,上清液即为所需粗酶液,于4℃冰箱中保存备用。
2.2 POD活性的测定
测定溶液体系为3 mL,20 mmol/L Tris-HCl缓冲液pH 7.5,其中2.95 mL底物含有10 mmol/L愈创木酚和10 mmol/L H2O2,0.05 mL酶液。于25℃反应20 min,在470 nm处测定吸光度变化值。以每分钟每毫升反应体系OD值改变0.01为1个酶活力单位(U)[12]。
2.3 POD酶学性质的测定
2.3.1 最适温度和温度稳定性
将反应底物分别置于 4、10、15、20、25、30、35、40、45、50、55 ℃ 的水浴锅中保温 5 min,加入木瓜的粗酶液,测定吸光度。以最适温度的酶活性为100%,其余温度下测定的酶活性与之的比值即为相对酶活性[13]。
不同品种木瓜的粗酶液分别保存于10、20、30、40℃ 条件下,待 20、40、60 min取出并测定酶活性[14]。以每个温度下的初始酶活性为100%,不同时间测定的酶活性与之相比即为相对酶活性。
2.3.2 最适pH值和pH值稳定性
测定不同品种木瓜的粗酶液在不同pH值(3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9)的缓冲液中的酶活性[15]。以最适条件下的酶活性为100%,其余pH值条件下测定的酶活性与之的比值即为相对酶活性。
将木瓜的粗酶液分别在不同pH值的缓冲液(3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9)中 4 ℃ 保存6 h,测定酶活性。以最适条件下的酶活性为100%。
2.3.3 金属离子的影响
分别配制终浓度为含有1、5、10 mmol/L金属离子的底物溶液,加入POD酶液,测定酶活力,以不含金属离子时的酶活力为100%,分析不同的金属离子对POD酶活性的影响。
2.3.4 POD米氏常数的测定
在25℃的条件下,分别改变底物愈创木酚和H2O2的浓度,考察底物浓度对木瓜POD催化速度的影响,采用双倒数作图法(Lineweaver-Burk 法)[16],分别求出木瓜POD对于愈创木酚和H2O2的米氏常数Km值。
2.3.5 抑制剂和表面活性剂的影响
将各种抑制剂及表面活性剂与底物混合成终浓度分别为1、5、10 mmol/L的溶液,加入酶液,测定吸光度变化。以不含抑制剂及表面活性剂时的酶活性为100%。
2.4 数据分析
采用DPS软件和Excel 2003对实验数据进行统计学分析。
3 结果与分析
3.1 POD最适温度
POD活性受温度的影响很大,在最适温度范围内,POD活性可以达到最大。由图1可以看出,温度对品种A、B的影响呈现完全不同的趋势。当反应温度低于30℃时,B的酶活性随着温度的升高而增大;超过30℃时,随着温度的升高酶活性下降直至失活。当反应温度超过20℃,品种A的酶活性随着温度的升高而下降。

图1 不同品种木瓜POD的最适温度Fig.1 The optimum temperature of Chaenomeles peroxidase
3.2 POD的温度稳定性
POD在一定的温度范围内可以长时间地保持活性。由图2可知,日本木瓜和皱皮木瓜在30℃以内都能较好地保持活性。不同来源的POD耐热性不同,水果和蔬菜中的 POD是一种较耐热的酶类[17-18]。Ekrem和HU在各自的文章中提到甘瓠和莴苣茎中的POD的热耐受性都很好,能在60℃保持一定的活性[14,19],刘金磊和赵岩分别对苦瓜和洋葱的POD进行了研究,发现两者的POD也都对温度具有较高的稳定性及耐受性[20,21],但本文中的 2 种木瓜的POD对温度的耐受性比较弱,与目前报道的大多数POD的热稳定性不同,其中,日本木瓜对热的耐受性强于皱皮木瓜,日本木瓜B在50℃条件下保存20 min会失活,这与菜花中POD的热稳定性相似[17]。
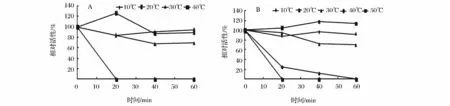
图2 不同品种木瓜POD的温度稳定性Fig.2 Temperature stability of Chaenomeles peroxidase
3.3 最适pH值
从图3中可以看出,2个品种的POD活性均随着pH值的增加呈现先增加后降低的趋势,两者都具有两个最适pH值,其中,日本木瓜B的两个最适pH值差别不是很明显,在pH值为5~6时,都具有较高的活性。
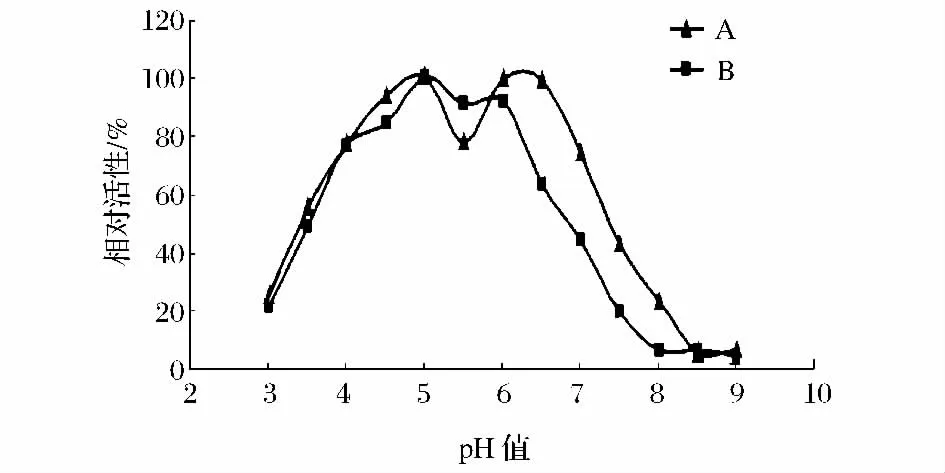
图3 不同品种木瓜POD的最适pH值Fig.3 The optimum pH of Chaenomeles peroxidase
3.4 pH值稳定性
由图4可以看出,皱皮木瓜和日本木瓜中POD的pH值稳定性差别很大,其随pH值变化的趋势也不同。A的POD在pH值5.5~8.5时稳定性较好,一直能保持80%以上的活性,在酸性条件下保存相对不稳定。而日本木瓜B的POD在酸性条件下比较稳定,在4~5.5活性迅速从85%以上降低至50%。

图4 不同品种木瓜POD的pH值稳定性Fig.4 pH stability of Chaenomeles peroxidase
3.5 金属离子的影响
金属离子可以在一定程度上影响POD的活性,表1所示的金属离子中,只有Ca2+可促进POD活性,其余的金属离子都对POD的活性起不同程度的抑制作用。其中,Ca2+对皱皮木瓜A中POD的活性的促进作用显著高于B,而Yihong Hu在对莴苣茎中POD的酶学性质研究中提到Ca2+对POD起抑制作用,可以抑制60%左右的酶活性[14],可见不同来源的POD可能结构存在较大差异,导致金属离子对其有完全相反的作用。Zn2+在低浓度时对A和B的抑制作用相同,在10mmol/L时,对 A、B的作用相反,Mn2+的抑制作用比较明显,10 mmol/L Mn2+抑制 A、B几乎50%的POD酶活,Mn2+对A中POD的抑制能力随着浓度的增大而增强,但对B中POD的抑制能力与浓度并不存在线性相关性。其他3种金属离子对A和B的抑制效果没有显著差异。

表1 不同金属离子对POD活性的影响Table 1 Influence of metalions on Chaenomeles peroxidase activity
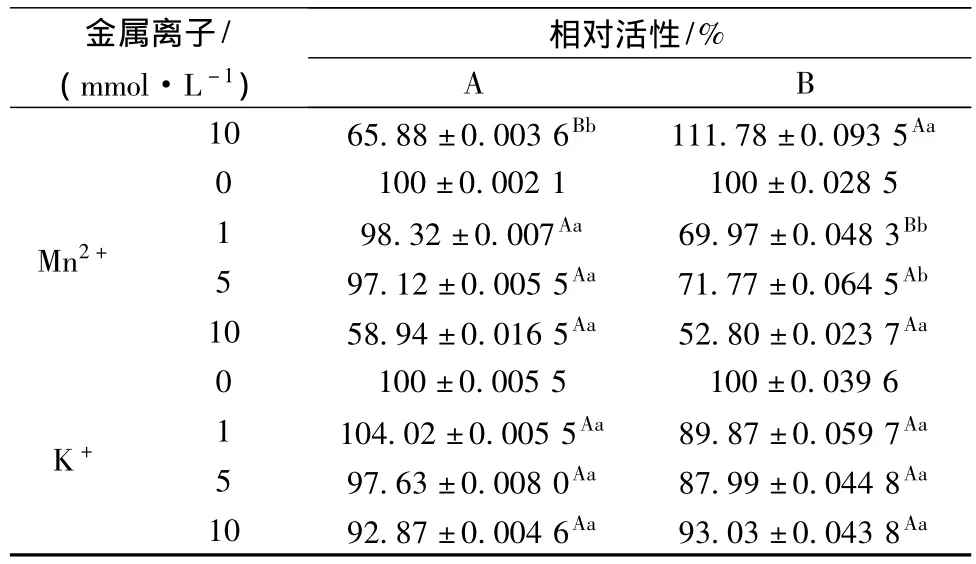
续表1
3.6 米氏常数的测定
分别以1/[S]为横坐标,1/V为纵坐标,采用双倒数作图法,得线性方程,如图6所示,2种木瓜中POD催化愈创木酚和H2O2的酶促褐变反应均符合米氏方程,进而求得2种木瓜的POD的Km值。Km值的大小可近似地表示酶与底物的亲和力,Km值越大表示酶与底物的亲和力越小,反之,则表示亲和力越大[16]。可见,皱皮木瓜A中的POD与愈创木酚的结合能力强于日本木瓜。
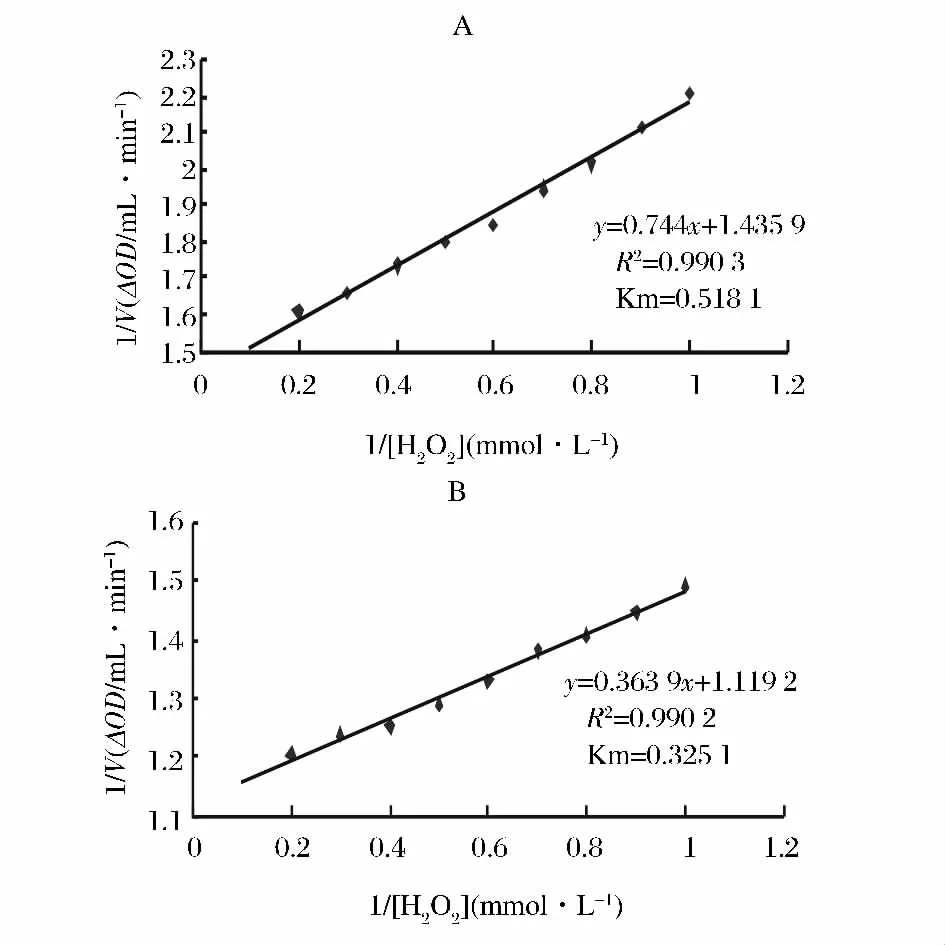
图5
3.7 抑制剂和表面活性剂的影响
抑制剂和表面活性剂具有还原性,可以抑制POD催化氧化愈创木酚。不同的化合物或不同浓度的同种化合物对不同品种木瓜POD活性的影响差别很大。如表2所示,1 mmol/L的抗坏血酸、柠檬酸、谷胱甘肽(还原型)、Na2S2O5及高浓度的EDTA-2Na对品种B的POD活性都起促进作用,实验中的所有化合物均对A的POD活性有抑制作用,且抑制能力随着浓度的增大而增强,其中,柠檬酸、吐温-80对A的抑制作用显著强于B。

图6 POD酶促反应双倒数作图Fig.6 Lineweaver-Burk plot of Chaenomeles peroxidase
SDS对2种木瓜中POD活性的抑制作用最强,在低浓度(1 mmol/L)时即可完全抑制POD活性,多项有关酶活动力学的研究[22-23]均表明SDS对辣根、葡萄等多种来源的POD活性有很强的促进失活作用,本研究在木瓜中也得到同样的结果,SDS是一种变性剂,能够破坏蛋白质分子中的疏水键和氢键,进而改变酶的空间构象,导致酶活性降低[12],可见表面活性剂SDS是过氧化物酶类重要的钝化剂。由表2可以看出,大部分抑制剂和表面活性剂对品种B的POD的抑制能力都弱于品种A,可见抑制剂和表面活性剂对日本木瓜的抑制能力低于皱皮木瓜。
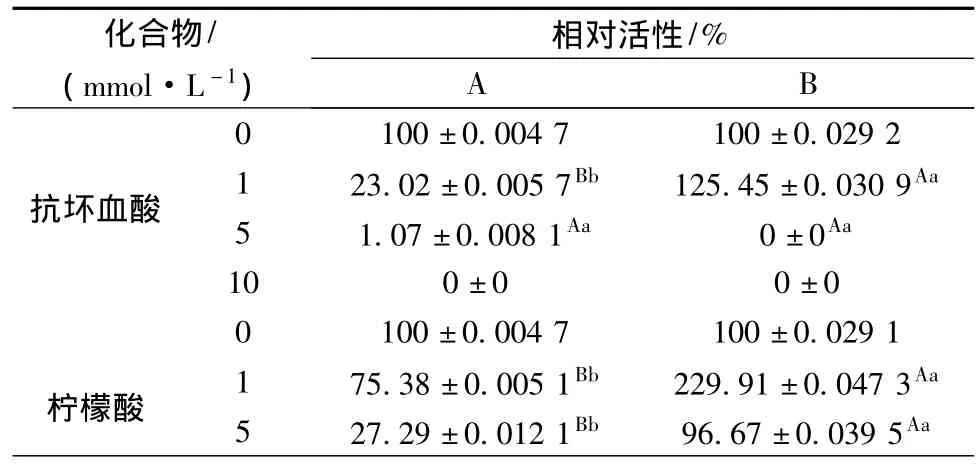
表2 抑制剂和表面活性剂对POD活性的影响Table 2 Influence of inhibition dose and surfactant on peroxidase activity

续表2
4 结论与讨论
皱皮木瓜和日本木瓜的POD的最适温度分别为15℃、30℃,二者都在30℃以内能较好地保持活性。两种POD都有两个最适pH值,日本木瓜的两个最适pH值差别不明显;皱皮木瓜的POD的pH值稳定性范围为5.5~8.5,日本木瓜的POD在酸性条件下比较稳定。金属离子对B两种木瓜的影响基本相同,Ca2+对两种POD活性都有促进作用,对两种POD抑制能力最强的化合物是SDS,其次为抗坏血酸。
日本木瓜和皱皮木瓜的POD都含有两个最适pH值,可能与POD酶的空间构象有关,或者可能存在两种同工酶,具体原因有待于日后深入研究。本研究中两种木瓜的POD对温度的耐受性都比较弱,仅在30℃以内能较好的保持活性,因此,这两个品种的木瓜的POD要在低温下保存,这两种木瓜POD的热稳定性比目前报道的大多数果蔬中POD差,可能是因为原料来源造成的,目前使用等电聚焦技术研究已证明不同POD同功酶的耐热性存在差异[17],含有不同的同工酶也可能是一个原因,有待进一步研究验证。Ca2+对两个POD活性都起促进作用,在加工生产中应避免木瓜产品与Ca2+接触。抑制剂和表面活性剂对两个品种的POD的作用规律基本相同,还原性强的化合物对POD都有很强的抑制作用,其他表面活性剂对POD的活性也有很强的抑制作用,可以应用于加工生产过程中。
[1] 郑万钧.中国树木志(第二卷)[M].北京:中国林业出版社,1985:102.
[2] 余德浚.中国果树分类学[M].北京:农业出版社,1979:164-168.
[3] 鲁宁琳,范昆,王来平,等.木瓜的种质资源分类及功效[J].落叶果树,2008,(6):29-31.
[4] 尹虹.日本木瓜的化学成分研究[D].沈阳:沈阳药科大学,2011:4.
[5] 肖培根,李大鹏,杨世林,等.新编中药志第二卷[M].北京:化学工业出版社,2002:107.
[6] 国家药典委员会.中国药典(一部)[M].北京:中国医药科技出版社,2010:57.
[7] 柳建平.皱皮木瓜超氧化物歧化酶分离纯化研究[J].安徽农业科学,2009,37(1):222-223.
[8] 张国庆,董明,李娜,等.宣木瓜多酚氧化酶酶学特性与抑制剂研究[J].食品科学,2011,32(10):288-291.
[9] Veda P.Purification and characterization of peroxidase from Panaya(Carica papaya)fruit[J].Appl Biochem Biotechnol,2012,167:367-376.
[10] Dunford H B,Stillman J S.On the function and mechanism of peroxidase[J].Coord Chem Rev,1976,19:187-251.
[11] Hamid M,Khalil-ur-Rehman.Potential applications of peroxidases[J].Food Chemistry,2009,115(4):1 177-1 186.
[12] 敬海明,邓玉,成丽丽,等.韭菜过氧化物酶的分离纯化及性质[J].食品科学,2012,33(15):226-230.
[13] 刘婕,王文,卢奎,等.皱皮木瓜多糖的提取及其抗氧化活性研究[J].河南工业大学学报(自然科学版),2011,32(1):48-52.
[14] HU Yihong,WU Juan,LUO Ping,et al.Purification and partial characterization of peroxidase from lettuce stems[J].African Journal of Biotechnology,2012,11(11):2 752-2 756.
[15] Thimmaraju Rudrappa,Venkatachalam,Roohie Kaunain,et al.Purification and characterization of an intracellular peroxidase from genetically transformed roots of red beet(Beta vulgaris L.)[J].Food Chemistry,2007,105:1 312-1 320.
[16] 罗万春,薛超彬.昆虫酚氧化酶及其抑制剂[M].北京:科学出版社,2010:33-36.
[17] 韩涛,李丽萍.果实和蔬菜中的过氧化物酶[J].食品与发酵工业,2000,26(1):69-73.
[18] 杨志萍,姚卫蓉,钱和,等.桂花中过氧化物酶热稳定性的研究[J].现代食品科技,2009,25(4):385-387.
[19] Ekrem K,Ercan B,Ahmet G A,et al.Purification and characterization of peroxidase from sweet gourd(Cucurbita moschata Lam.Poiret)[J].International Journal of Food Properties,2012,15(5):1 110-1 119.
[20] 刘金磊,苏涛,李典鹏,等.苦瓜过氧化物酶的提取分离及性质测定[J].广西科学,2007,14(4):407-410.
[21] 赵岩,韩硕.洋葱过氧化物酶活性测定及性质分析[J].安徽农业科学,2011,39(3):1275-1277.
[22] Fortea M I,Lopez-Miranda S,Serrano-Martnez A.Kinetic characterisation and thermal inactivation study of polyphenol oxidase and peroxidase from table grape[J].Food Chemistry,2009,113:1 008-1 014.
[23] Nazari K,Mahmudi A,Shahrooz M,et al.Suicide-peroxide inactivation of horseradish peroxidase in the presence of Sodium n-Docecyl Sulphate:A study of the enzyme deactivation kinetics[J].Journal of Enzyme Inhibition,2005,20:285-292.

