猪骨免疫活性肽的分离纯化
曾珍,李诚,付刚,杨勇,何利,陈姝娟
(四川农业大学食品学院,四川雅安,625014)
我国的猪骨资源丰富,但是对猪骨的深加工利用只有1%左右[1]。猪骨中含有丰富的蛋白质,从中获得生物活性肽越来越受到研究者的关注。例如,有研究人员研究了具有降血脂作用的猪骨胶原肽[2]和提高机体抗氧化能力的猪骨肽[3]。然而利用猪骨制备免疫活性肽还未见报道。免疫调节活性肽在生物体内主要是通过抑制和刺激某些免疫反应来达到预防和控制疾病的目的[4],如增强免疫细胞功能[5]、增强抗体合成和细胞因子的调节[6]。近年来的研究进一步挖掘出了免疫活性肽巨大的潜力,不少研究者将其运用到保健医疗领域。如有研究者分离出具有抗肿瘤功效的免疫活性肽[7];某些免疫活性肽能够刺激胰岛素释放,具有治疗糖尿病的潜力[8];某些具有免疫调节活性的肽同时还具有抗炎作用[9];甚至有研究指出,免疫活性肽因其副作用小,可以成为抗生素的安全替代品[10]。免疫活性肽的来源也很广泛,可从食物的蛋白质里制备出来,如羊胎盘[11]、玉米[12]、小球藻[13]、鳕鱼[14]等等。
酶解液是一种混合液,不同分子质量的肽组分其生物活性也不同。超滤是以压力为推动力的膜分离技术之一,采用超滤可以将不同分子质量的肽组分分离开来以获得生物活性最高的肽段。凝胶层析和离子交换层析是被广泛用于分离生物活性肽的2种分离纯化技术,前者是按被分离物质分子质量的大小不同进行分离,而后者是利用多肽在同一pH值条件下所带净电荷的不同从而导致了多肽与离子交换树脂的亲和能力不同这一特点进行分离[15]。不少研究者采用凝胶层析及离子交换层析相结合的方式对多肽进行分离。如赵元晖等人采用先凝胶柱层析而后离子交换层析的方法对海地瓜水解产物进行分离纯化,得到了一种新的强活性的ACE抑制肽[16];刘小红等人采用先离子交换层析而后凝胶层析的方法对猪骨降血压肽进行分离纯化[17]。
本文选择猪骨Alcalase碱性蛋白酶酶解液作为潜在的免疫调节肽资源,运用超滤研究不同分子质量肽段的免疫活性,然后采用先凝胶过滤层析而后进行离子交换层析的方式进行分离,以探索出分离纯化猪骨免疫活性肽的方法。
1 材料与方法
1.1 材料与试剂
鲜猪骨(猪后腿股骨头)市售;昆明种小鼠5周龄,体重18 g,雌性,由四川农业大学兽医院提供。
Alcalase碱性蛋白酶(11.5×104U/g),丹麦NOVO公司;SP-Sephadex C-25,Pharmacia公司;Sephadex G-25,Pharmacia公司;其他试剂均为分析纯。
1.2 主要仪器
BR4i型多功能冷冻离心机,法国THERMO JOUAN公司;iMark酶联免疫检测仪,美国伯乐公司;311型CO2培养箱,美国Thermo Scientific公司;HH-4数显恒温水浴锅,金坛市富华仪器有限公司;PHS-3C酸度计,方舟科技公司;POWERDRY PL3000冻干机,Thermo;DYCZ-24D垂直式电泳仪,北京市六一仪表厂;超滤离心管(膜截留分子质量10 ku、5 ku、3 ku、2 ku),Sartorius。
1.3 方法
1.3.1 分离纯化猪骨免疫活性肽的工艺流程
制备酶解液→超滤→凝胶过滤层析→离子交换层析
1.3.2 分离纯化猪骨免疫活性肽的操作要点
1.3.2.1 酶解液的制备
参照曾珍的方法[18]制备酶解液:将新鲜猪骨宰碎、蒸煮、干燥之后制成猪骨粉,采用Alcalase碱性蛋白酶酶解猪骨粉,酶解完成后离心过滤取上清液。
1.3.2.2 超滤
将猪骨酶解液通过10 ku的超滤离心管进行超滤离心,将分子质量低于10 ku的酶解液通过5 ku的超滤离心管进行超滤离心,接着将分子质量低于5 ku的酶解液用3 ku的超滤离心管进行超滤离心,然后将分子质量低于3 ku的酶解液用2 ku的超滤离心管进行超滤离心。经过一系列的超滤离心一共得到5个组分,分别为分子质量>10 ku(记为组分1)、10 ku>分子质量>5 ku(记为组分2)、5 ku>分子质量>3 ku(记为组分3)、3 ku>分子质量>2 ku(记为组分4)、分子质量<2 ku(记为组分5),收集这5个组分进行冷冻干燥,将5个组分配成肽浓度为5 mg/mL的样品,分别测定各样品对小鼠脾淋巴细胞的增殖率,收集小鼠脾淋巴细胞增殖率最高的组分,备用。
1.3.2.3 凝胶过滤层析
sephadex G-25(细)层析柱(Ф1.6×60),上样量为2.5 mL,洗脱液为超纯水,进样流速和洗脱流速为1 mL/min,用自动部分收集器收集每管2 mL,用紫外检测器测其在214 nm下的OD值,将分离开的组分配制成不同浓度测定其对小鼠脾淋巴细胞增殖率。
1.3.2.4 透析
在4℃的条件下,将样品放入透析袋使用磁力搅拌器进行透析,每3h更换1次超纯水,共更换4次。
1.3.2.5 离子交换层析
填料为 SP-sephadex C-25,上样量为1 mg/mL,缓冲液为:pH=4.0、0.02 mol/L醋酸钠缓冲液,0~1.0 mol/L NaCl溶液梯度洗脱,进样流速和洗脱流速为1.0 mL/min,用自动部分收集器收集,每管2 mL,用紫外检测器测其在214 nm下的OD值,将分离开的组分配制成不同浓度,测定其对小鼠脾淋巴细胞的增殖率。
1.3.3 指标测定
1.3.3.1 小鼠脾淋巴细胞增殖率检测方法
(1)无菌小鼠脾淋巴细胞制备:小鼠禁食12 h,摘眼球放血后脱颈处死,浸泡在75%的乙醇中3~5 min,于超净工作台上无菌打开腹腔,取出小鼠脾脏置于含有无菌Hanks液的平皿中,去除外周结缔组织,并用无菌Hanks液清洗脾脏,去除血液。用无菌注射器芯挤压研磨,制成细胞悬液。用Hanks液洗3次,然后1 500 r/min离心8 min,弃去上清液。然后将细胞悬浮于2 mL的RPMI 1640完全培养液中。调整细胞浓度为 2.0 ×106个/mL[19-20]。
(2)MTT法测定脾淋巴细胞增殖。设实验组和对照组。在96孔板中每孔加入已制备好的小鼠脾细胞悬液100 μL。对照组中加入RPMI 1640完全培养液 100 μL,实验组加入 100 μL 酶解液,置于 37℃下5%CO2培养箱中培养68h,再加入 MTT 50 μL,4 h 培养结束后,每孔加入1mL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。室温下放置15 min后,用酶联免疫检测仪,以570 nm波长测定光密度值[21]。

1.3.3.2 肽浓度的测定
分光光度法(GB 5009.5-2010)。
2 结果与分析
2.1 猪骨蛋白酶解产物超滤的分离结果
超滤分离各组分对脾淋巴细胞的增殖率见表1。由表1可以看出,超滤以后的酶解液对小鼠脾淋巴细胞增殖作用大小为组分5>组分4>组分3>组分2>组分1。研究结果表明,组分5即分子质量低于2 ku的组分脾淋巴细胞增殖率最高,因此将组分5继续进行分离纯化。

表1 超滤组分的脾细胞增殖率Table 1 The proliferation rate on spleen cell of ultrafiltration components
2.2 sephadex G-25凝胶过滤结果
分子质量低于2 ku的组分经过凝胶层析分离结果如图1所示,由图1可以看出酶解液被分离成4个组分A1~A4。4个组分对脾淋巴细胞的增殖活性影响如图2所示。由图2可以看到,随着分离组分作用剂量的增加,脾细胞增殖率显著增加,且呈现一定的剂量关系,其中A2组分增殖活性最强,且剂量关系最明显,当浓度在100 μg/mL时,脾淋巴细胞的增殖率为109.83%。因此,将峰A2继续分离。
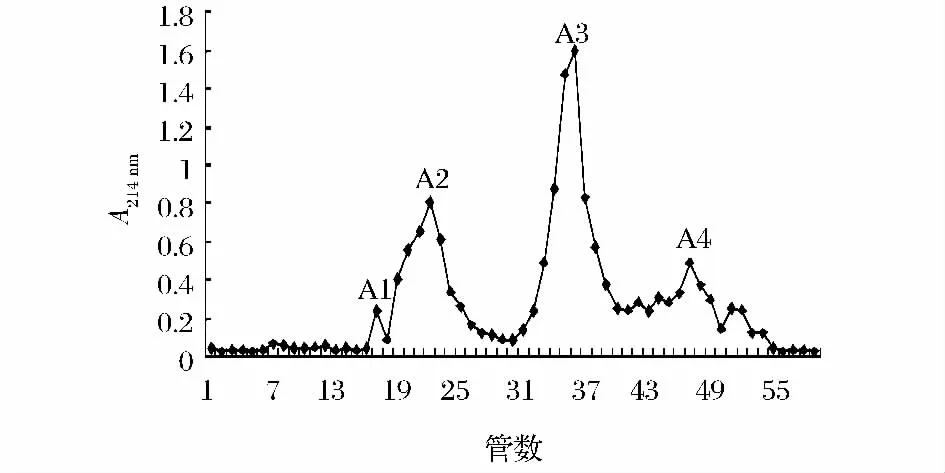
图1 酶解液的凝胶层析sephadex G-25洗脱曲线Fig.1 The gel filtration exchange chromatography of hydrolysates

图2 凝胶柱层析洗脱组分的脾细胞增殖活性Fig.2 The proliferation rate on spleen cell of gel filtration chromatography components
2.3 SP-sephadex C-25离子交换结果
A2经SP-sephadex C-25离子交换层析柱分离结果如图3所示。由图3可以看到,A2被分离成9个组分B1~B9。9个组分对脾淋巴细胞的增殖活性影响如图4所示。由图4可以看到,不同浓度的分离组分对脾淋巴细胞均有一定的增殖能力,其中B4组分增殖活性最强,同时B4组分剂量关系最明显,当浓度在100 μg/mL时,脾淋巴细胞的增殖率为114.30%。
3 讨论与结论
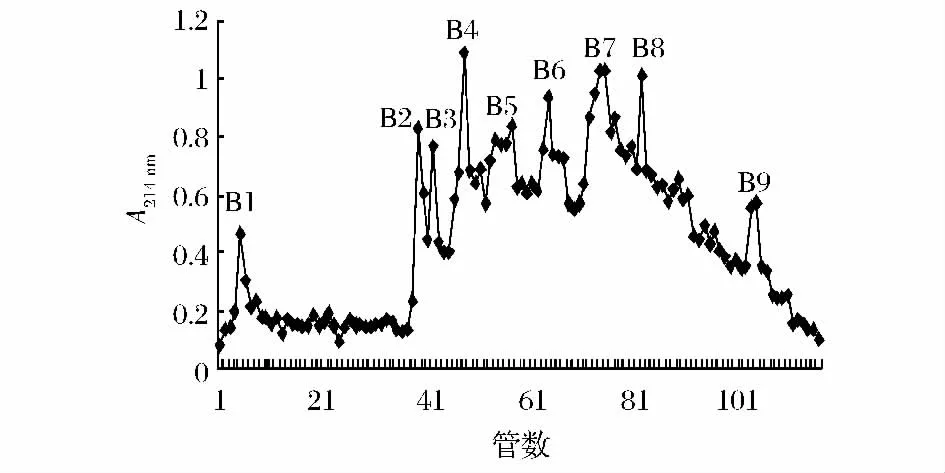
图3 A2的离子交换层析SP-sephadex C-25洗脱曲线Fig.3 The ion exchange chromatography of A2
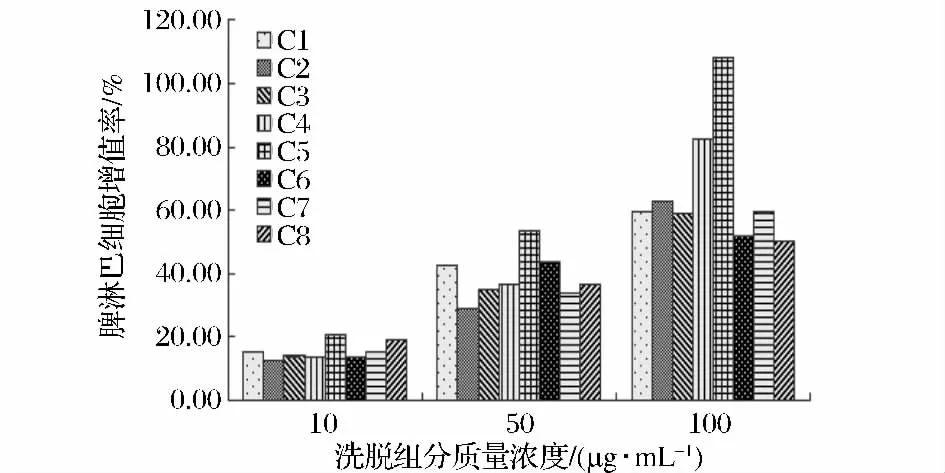
图4 离子交换层析洗脱组分的脾细胞增殖活性Fig.4 The proliferation rate on spleen cell of A2 ion chromatography components
一般来说,分子质量越低的生物活性肽其生物学活性越强,这是因为短肽的分子质量越低,其肽段长度越短,空间结构越小,越容易进入机体脾淋巴细胞内部,从而实现一系列的生物学功能。He等人将油菜籽蛋白酶解物分离成了不同肽组分:<1 ku、1~3 ku、3~5 ku、>5 ku,通过研究不同组分的生物活性发现,<3 ku的多肽比>3 ku的多肽降低了表面的疏水力,从而表现出更高的氧自由基清除能力[22]。张宇昊等人对花生酶解液进行超滤,得到了<1 ku、1~5 ku、>5 ku的3种不同分子质量范围的短肽,研究其ACE抑制活性发现,低于1 ku的花生短肽其ACE抑制活性最强,而>5 ku的花生短肽其ACE抑制活性最差[23]。王炳祥等人研究了分子质量分别为10.139、8.166、7.447、6.761 ku 等4 种山羊胎盘肽的抗氧化活性,结果表明,分子质量为6.761 ku的小肽具有的抗氧化力最强[24]。本实验中超滤得到的>10 ku、5~10 ku、3~5 ku、2~3 ku和 <2 ku等5组猪骨肽,分子质量低于2 ku的小肽增殖活性最强,与上述研究人员的研究结果一致。目前越来越多的研究人员联合使用凝胶过滤层析和离子交换层析对生物活性肽进行色谱分离。本研究中采用先凝胶过滤层析后离子交换层析的方式进行分离是考虑到Sephadex G-25具有脱盐的作用,多肽先脱盐再经SP-Sephadex C-25的分离,而SP-Sephadex C-25的母体Sephadex具有分子筛效应,使它在分离物质的同时,具有离子交换作用和分子筛效应,从而使分离效果得到了加强。许多研究者也是采用先凝胶过滤层析后离子交换层析的顺序进行分离纯化多肽。LIU等人采用凝胶过滤色谱、离子交换色谱来分离胃蛋白酶和木瓜蛋白酶酶解水母蛋白中的ACE抑制肽[25]。赵元晖等人采用先Sephadex G-25凝胶柱层析而后SP-Sephadex C-25的方法对海地瓜水解产物进行分离纯化,得到了一种新的强活性的ACE抑制肽[26]。张晓丽等人采用先Sephadex G-25凝胶柱层析而后SP-Sephadex C-25对土鳖虫复合多肽进行分离纯化,得到具有较强溶栓活性的多肽组分[27]。
猪骨免疫活性肽的分离纯化方法为:首先对猪骨蛋白的酶解产物进行超滤分离,然后对分子质量低于2 ku的组分进行凝胶过滤层析分离,最后对凝胶层析分离后得到活性最高的组分进行离子交换层析分离。当最终分离得到的免疫活性肽的质量浓度在100μg/mL时,对小鼠脾细胞增殖率为114.30%。
[1] 蓝德安.应用现代生物技术 开拓鲜骨深加工新领域[J].肉类研究,2005,10(10):21-22.
[2] 林云鉴,乐国伟,施用晖,等.猪骨胶原蛋白肽缓解高脂饮食诱导小鼠肝脏氧化应激的基因芯片分析[J].天然产物研究与开发,2012,24(4):454-459.
[3] 朱琳玲.骨胶原肽对高脂膳食小鼠抗氧化能力及皮肤和骨骼胶原代谢的影响[D].无锡:江南大学,2012.
[4] Robert E W Hancock,Hans-Georg Sah.Antimicrobial and hostdefense peptides as new anti-infective therapeutic strategies[J].Nature Biotechnology,2006,24(12):1 551-1 557.
[5] Richard J Fitzgerald,Brian A Murray.Bioactive peptides and lactic fermentations[J].International Journal of Dairy Technology,2006,59(2):118-125.
[6] Rainer Hartmann,Hans Meisel.Food-derived peptides with biological activity:from research to food applications[J].Current Opinion in Biotechnology,2007,18(2):163-169.
[7] SUN Hong-xiang,CHEN Li-qing,ZHANG Juan,et al.Anti-tumor and immunomodulatory activity of peptide fraction from the larvae of Musca domestica[J].J Ethnopharmacol,2014,153(3):831-839.
[8] Michael Conlon J,Milena Mechkarska,Miodrag L Lukic,et al.Potential therapeutic applications of multifunctional host-defense peptides from frog skin as anti-cancer,anti-viral,immunomodulatory,and anti-diabetic agents[J].Peptides,2014,57(7):67-77.
[9] Ka-Yee Choi,Leola N Y Chow,Neeloffer Mookherjee.Cationic host defence peptides:multifaceted role in immune modulation and inflammation[J].J Innate Immun,2012,4(4):361-370.
[10] Dominic Agyei,Michael K,Danquah.Rethinking foodderived bioactive peptides for antimicrobial and immunomodulatory activities[J].Trends in Food Science &Technology,2012,23(2):62-69.
[11] 刘隆兴,任兴宏,汤禾静,等.羊胎盘免疫活性小分子肽的分离纯化[J].食品科学,2013,34(22):273-276.
[12] FENG Li-na,LIANG Chen,LIANG Rui-liang,et al.Pilot-scale production of low molecular weight peptides from corn wet milling byproducts and the antihypertensive effects in vivo and in vitro[J].Food Chemistry,2011,124(3):801-807.
[13] Humberto J Morris,Olimpia V Carrillo,Ángel Almarales,et al.Protein hydrolysates from the alga Chlorella vulgaris 87/1 with potentialities in immunonutrition[J].Biotecnología Aplicada,2009,26(2):162-165.
[14] HOU Hu,FAN Yan,LI Ba-fang,et al.Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J].Food Chem,2012,134(2):821-828.
[15] 张建荣,马俪珍,梁鹏.鲶鱼骨蛋白酶解物中抗菌活性物质的初步分离纯化[J].食品与发酵工业,2009,35(2):48-52
[16] 赵元晖,李八方,马敬军,等.海地瓜蛋白水解物中ACE抑制肽的分离纯化及合成[J].高等学校化学学报,2012,33(2):308-312.
[17] 刘小红,李诚,付刚,等 猪股骨头胶原蛋白降血压肽的分离纯化[J].食品科学,2014,35(6):50-53.
[18] 曾珍,李诚,付刚,等.不同蛋白酶的猪、兔骨酶解液对小鼠脾淋巴细胞增殖作用的比较[J].食品与生物技术学报,2014(2):181-188.
[19] 刘建文,殷明,季光,等.药理实验方法学一新技术与新方法[M].北京:化学工业出版社,2008:128-131.
[20] 司书毅,张月琴.药物筛选——方法与实践[M].北京:化学工业出版社,2007:341.
[21] 中华人民共和国卫生部.保健食品检验与评价技术规范(2003年版)[M].北京:中华人民共和国卫生部,2003:20-25.
[22] He R R,Alashi A,Malomo S A,et al.Antihypertensive and free radical scavenging properties of enzymatic rapeseed protein hydrolysates[J].Food Chemistry,2013,141(1):153-159.
[23] 张宇昊,马良,王强.花生短肽降血压活性研究[J].食品科学,2008,29(6):399-403.
[24] 王炳祥,顾国生,李鑫雨,等.山羊胎盘小肽的分离及对小鼠抗氧化能力的影响[J].西南农业学报,2011(1):315-318.
[25] LIU Xin,ZHANG Mian-song,JIA Ai-rong,et al.Purification and characterization of angiotensin I converting enzyme inhibitory peptides from jellyfish Rhopilema esculentum[J].Food Research International,2013,50(1):339-343.
[26] 赵元晖,李八方,马敬军,等.海地瓜蛋白水解物中ACE抑制肽的分离纯化及合成[J].高等学校化学学报,2012(2):308-312.
[27] 张晓丽,李坤.土鳖虫多肽的分离纯化及溶栓活性[J].中国实验方剂学杂志,2013,19(14):53-55.

