产鼠李糖脂生物表面活性剂大肠杆菌的构建与优化
巩志金,彭彦峰,张煜婷,宋国田,陈五九,贾士儒,王钦宏
产鼠李糖脂生物表面活性剂大肠杆菌的构建与优化
巩志金1,2,彭彦峰2,张煜婷2,宋国田1,2,陈五九2,贾士儒1,王钦宏2
1 天津科技大学生物工程学院,天津 300457 2 中国科学院天津工业生物技术研究所 中国科学院系统微生物工程重点实验室,天津 300308

巩志金, 彭彦峰, 张煜婷, 等. 产鼠李糖脂生物表面活性剂大肠杆菌的构建与优化. 生物工程学报, 2015, 31(7): 1050–1062.Gong ZJ, Peng YF, Zhang YT, et al. Construction and optimization of Escherichia coli for producing rhamnolipid biosurfactant. Chin J Biotech, 2015, 31(7): 1050–1062.
目前鼠李糖脂生物表面活性剂主要由条件致病的铜绿假单胞菌生产获得,从而影响工业应用。为了开发一种相对安全的鼠李糖脂生产菌,将带有不同强度组成型合成启动子的鼠李糖基转移酶基因 (Rhamnosyltransferase gene,) 以单、中、高3种拷贝数分别在大肠杆菌ATCC 8739中异源表达,实现了不同产量的鼠李糖脂异源合成。对基因和基因簇 (TDP-L-鼠李糖合成的基因簇) 进一步利用合成启动子进行组合调控,筛选获得了最优生产鼠李糖脂工程菌——大肠杆菌TIB-RAB226。对大肠杆菌TIB-RAB226进行发酵温度优化,鼠李糖脂产量达到124.3 mg/L,是优化前的1.17倍。通过分批补料发酵,12 h时鼠李糖脂产量达到209.2 mg/L。对发酵产物进行高效液相色谱-质谱联用技术分析,共检出相对含量变化的5类质核比不同的鼠李糖脂同系物。本研究可为异源合成产鼠李糖脂提供重要参考。
鼠李糖脂,鼠李糖基转移酶,基因簇,组成型合成启动子,组合调控,大肠杆菌
鼠李糖脂是一种由多种同族结构组成的阴离子生物表面活性剂,其亲水基团一般由1−2分子的鼠李糖环构成,疏水基团则由不同碳链的β-羟基烷酸构成,分子式可表述为Rhl-Cx、Rhl-Cx-Cy、Rhl-Rhl-Cx或Rhl-Rhl-Cx-Cy (Rhl为鼠李糖;x、y通常为8–14)[1]。鼠李糖脂能显著降低流动相之间的界面张力,具有优良的去垢、乳化和絮凝能力,并且无毒及可生物降解,在采油工业、化妆品、环境修复中具有巨大的应用潜力[2]。另外,通过微生物发酵生产鼠李糖脂并水解得到鼠李糖,有望替代天然植物中提取获得的鼠李糖,成为食用型甜味剂鼠李糖的潜在来源[3]。
目前,工业上主要采用铜绿假单胞菌发酵法生产鼠李糖脂[4],而铜绿假单胞菌(俗称绿脓杆菌) 被认为是三种最强人类条件致病菌之一,限制了其在工业生产中的应用[5]。因此,人们期望利用相对安全的工业微生物进行鼠李糖脂的生产,降低其在生产中的潜在危害,拓展相关产品的应用范围[6]。如利用伯克氏菌[7]、绿针假单胞菌[8]等非条件致病菌生产鼠李糖脂,但由于这些微生物遗传背景相对不清晰且缺乏简便的遗传操技术,很难进一步提高鼠李糖脂的产量,无法满足生产要求。而大肠杆菌作为一种遗传背景清晰、技术操作成熟、工业应用广泛的模式生物,具有完整的TDP-L-鼠李糖和β-羟基烷酸 (HAAs)合成途径 (图1),被认为是更具改造潜力的良好宿主菌。Wang等利用转座体介导的染色体整合的方法,将合成鼠李糖脂的关键基因整合入大肠杆菌BL21 (DE3) 基因组,并成功进行异源表达,在IPTG的诱导下生产鼠李糖脂,产量达到约 80 mg/L[9]。Cabrera-Valladares等将基因导入大肠杆菌W3110未得到鼠李糖脂,将基因和(铜绿假单胞菌鼠李糖合成基因簇) 基因簇一起导入时,鼠李糖脂产量达到120.6 mg/L,证明了TDP-L-鼠李糖是鼠李糖脂异源生产的一个主要影响因素[10]。虽然鼠李糖脂在大肠杆菌中生产取得了一定程度的成功,但由于其前体物质主要来自大肠杆菌的核心代谢途径 (图1),导致细胞不易于过量生产鼠李糖脂[5,11]。因此,需要通过代谢工程的策略进一步提高其前体物的表达量和平衡代谢流量,提高鼠李糖脂的产量[12]。
本研究中我们构建了产鼠李糖脂的大肠杆菌,并利用组成型合成启动子对相应的关键基因进行了组合调控,鼠李糖脂产量得到较大提高,而且不用诱导表达,避免使用相对昂贵的诱导剂。研究首先将鼠李糖脂合成的关键基因在ATCC 8739中进行表达优化,然后利用合成启动子与基因簇进行组合调控,得到最优鼠李糖脂生产菌TIB-RAB226。最后,对工程菌TIB-RAB226进行了发酵温度的优化和分批补料发酵,进一步提高了鼠李糖脂的产量。对发酵产物进行高效液相色谱-质谱联用 (LC-MS) 技术分析,发现工程大肠杆菌产生的鼠李糖脂含有多种不同类型和相对丰度的鼠李糖脂同系物 (Congener)。

图1 工程大肠杆菌鼠李糖脂生物合成途径
1 材料与方法
1.1 材料
1.1.1 菌株
TIB-R02基因组DNA用作克隆基因的模板。ATCC 8739是构建产鼠李糖脂大肠杆菌的出发菌株。本研究所用菌株如表1所示。
1.1.2 主要试剂
氨苄青霉素、氯霉素、硫酸卡那霉素购自上海生工生物工程服务有限公司;质粒小量快速提取试剂盒购自美国Axygen 公司;DNA 回收试剂盒购自康为世纪公司;TransStart Fast Pfu DNA 聚合酶、DNA marker、pEASY-Blunt Zero Cloning Kit试剂盒购自北京全式金生物技术有限公司;限制性内切酶、T4 DNA 连接酶、T4 多聚核苷酸激酶购自NEB公司;苏丹红II、液体石蜡油、鼠李糖标准品购自国药集团化学试剂有限公司;其他试剂均为分析纯。
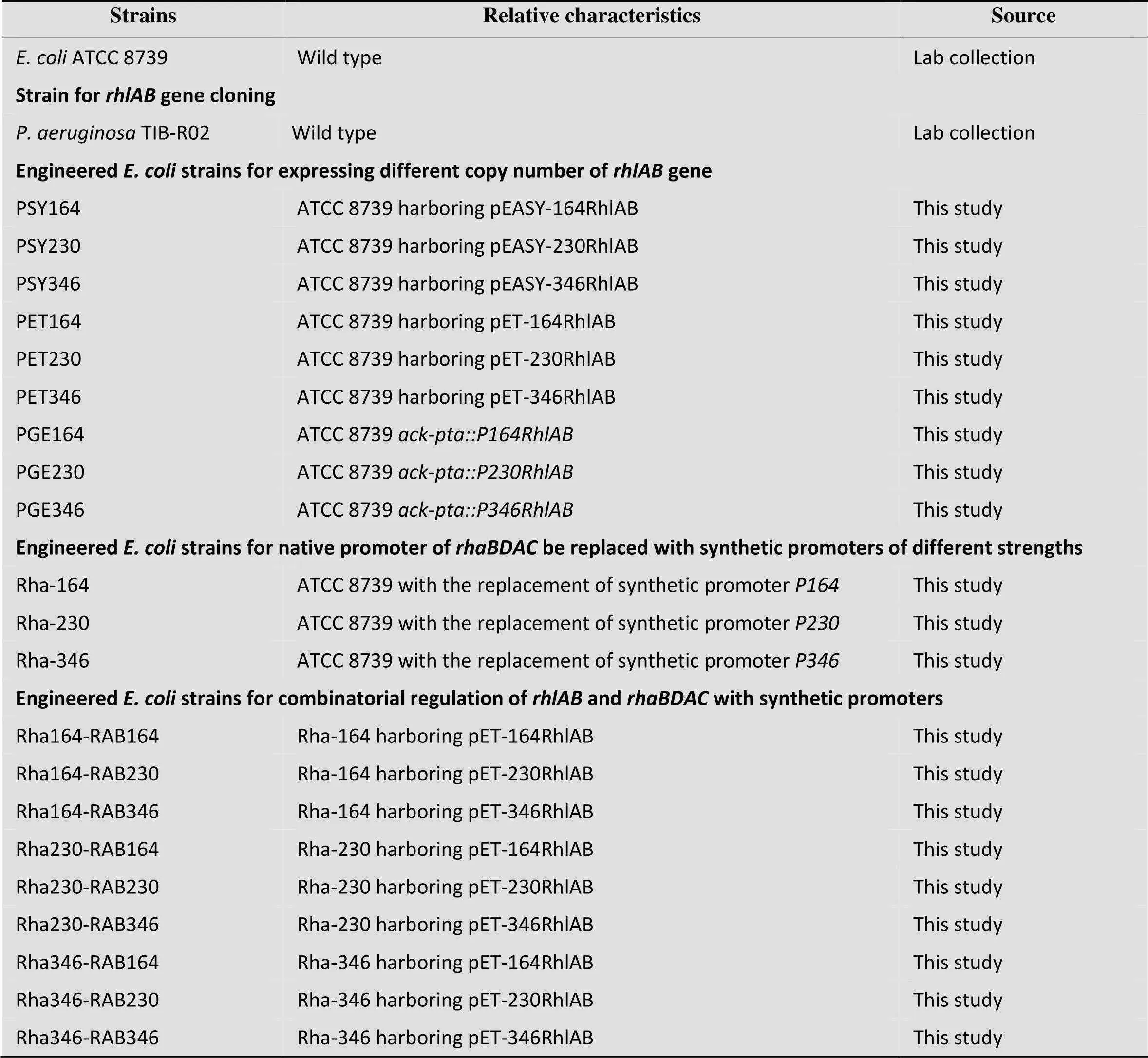
表1 本研究的菌株
1.2 方法
1.2.1 培养基
每升LB培养基包括10 g胰蛋白胨, 5 g酵母提取物和10 g氯化钠 (固体LB加入1.5%的琼脂粉);鼠李糖脂发酵培养基为添加氨苄青霉素、硫酸卡那霉素和后期补加1%() 葡萄糖的LB 培养基;氨苄青霉素、硫酸卡那霉素、氯霉素终浓度分别为100 μg/mL、50 μg/mL和34 μg/mL。
1.2.2 鼠李糖脂检测
采用排油圈法[13]对鼠李糖脂含量进行检测,并对方法简单改进。玻璃平皿 (D=9 cm) 中加入25 mL的液体LB,液面稳定后加入1 mL苏丹红Ⅱ染红的液体石蜡。待石蜡铺开至半径为20 mm时,加入10 μL鼠李糖脂发酵液并记录最大排油圈半径。根据排油圈半径(mm) 与鼠李糖脂浓度(g/L) 之间的线性关系=0.097 4+ 0.12,计算发酵液中鼠李糖脂的含量。本实验所使用的排油圈法已经与苔黑酚-浓硫酸显色法[9]进行对比验证,两种方法结果一致。
1.2.3 质粒及重组片段的构建
本研究所使用的质粒、引物分别见表2和表3。分别构建含不同表达强度组成型合成启动子的高拷贝数质粒pEASY-XRhlAB (X代表P164、P230和P346 3种低、中、高不同表达强度的组成型启动子,启动子序列见表3[14]) 和中等拷贝数质粒pET-XRhlAB,作为鼠李糖基转移酶基因的质粒表达载体,构建方法如下:1) pEASY-XRhlAB质粒的构建:以TIB-R02基因组DNA为模板,通过PCR扩增获得带有不同表达强度组成型启动子的XRhlAB DNA片段 (分别以P164A-5/T7tB-3,P230A-5/ T7tB-3和P346A-5/T7tB-3为引物对)。将纯化后的XRhlAB DNA片段与pEASY-Blunt Zero连接后得到pEASY-XRhlAB表达载体。2) pET-XRhlAB质粒的构建:以pEASY-XRhlAB为模板,通过PCR扩增获得带有HⅠ和RⅠ酶切位点的XRhlAB基因片段,与pET-30a(+) 载体一起经酶切、连接后得到pET-XRhlAB表达载体。
整合到基因组中的XRhlAB DNA片段构建如下:用上述相同方法获得XRhlAB片段,将XRhlAB片段纯化、磷酸化处理后与pEASY-ap (带有两端各500 bp同源臂序列质粒) 质粒连接获得带有500 bp同源臂的质粒pEASY-XRhlAB-ap。以pEASY-XRhlAB-ap和pEASY-cat-SacB-ap (两端各带有500 bp同源臂序列,同源臂之间含有抗性基因簇的质粒) 为模板,用引物P1和P2分别扩增获得带同源臂XRhlAB-ap和cat-SacB-ap的DNA片段。cat-SacB-ap、XRhlAB-ap DNA片段分别用于第一步和第二步同源重组的片段,将XRhlAB DNA片段整合进大肠杆菌基因组,代替基因。
用于基因簇启动子替换的片段构建如下:以质粒pEASY-cat-SacB-ap为模板利用引物Sens-cat-Sacb/Anti-cat-Sacb 进行扩增,获得带有50 bp同源臂的rha-cat-SacB DNA片段,用于第一步同源重组。直接通过基因合成带有上述不同组成型启动子和50 bp同源臂的P164-rha、P230-rha和P346-rha片段用于第二步同源重组。
1.2.4 工程菌的构建
将pET-XRhlAB质粒转入ATCC 8739得到3种中等拷贝数质粒表达基因的工程菌PET164、PET230、PET346;将pEASY-XRhlAB质粒转入ATCC 8739得到3种高拷贝数质粒表达基因的工程菌PSY164、PSY230、PSY346;另外,通过两步同源重组的方法[16-17]将XRhlAB DNA片段整合到ATCC 8739基因组替换基因,得到3株以单拷贝数表达基因的工程菌PGE164、PGE230和PGE346。上述9株菌用于基因异源表达合成鼠李糖脂的研究。

表2 本研究所用的质粒
将ATCC 8739基因组中基因簇的原始启动子用上述不同强度的启动子替换,构建以不同强度表达基因簇的工程菌Rha-164、Rha-230及Rha-346。将质粒pET- 164RhlAB、pET-230RhlAB 及pET-346RhlAB分别导入菌株Rha-164、Rha-230及Rha-346,得到9种组合菌株(Rha164-RAB164、Rha164- RAB230、Rha164-RAB346、Rha230-RAB164、Rha230-RAB230、Rha230-RAB346、Rha346- RAB164、Rha346-RAB230和Rha346-RAB346),用于基因和基因簇组合调控 研究。
1.2.5 工程菌的筛选及发酵温度优化
将构建的工程菌接种于含氨苄青霉素、硫酸卡那霉素的LB试管中,200 r/min、30 ℃培养24 h,通过鼠李糖脂产量对菌株进行筛选。利用筛选得到的最优工程菌TIB-RAB226进行发酵温度的优化,将菌株TIB-RAB226依次接种于温度为26、28、30、32、34和36 ℃的摇瓶培养基中,200 r/min,培养12 h,检测菌体生长及鼠李糖脂产量确定最优的发酵 温度。
1.2.6 鼠李糖脂的补料发酵及产物分析
为了进一步提高鼠李糖脂的产量,采用摇瓶补料的方式对菌株TIB-RAB226进行补料发酵实验。将种子液培养至600=3,以5%的接种量接种至LB培养基,28 ℃、 200 r/min培养16 h,每2 h测定细胞生长密度、鼠李糖脂产量及pH,并在8 h时进行补加1%葡萄糖补料实验。将发酵产物用萃取液 (氯仿:乙醇=2:1) 萃取后吹干有机溶剂得到鼠李糖脂样品,用于高效液相色谱-质谱联用 (LC-MS) 分析。LC-MS分析方法参照Wang等[9]所用方法并简单修改,色谱柱为Genmini C18柱 (100 mm×3.0 mm, 3 μm),流动相A为水:乙腈=98:2,B为水:乙腈=10:90,A和B中均含1%乙酸。梯度洗脱条件为0−1 min,8%;1−51 min,60%;51−61 min,60%;61−62 min,8%;62−67 min,8%。流速为0.5 mL/min,进样体积为10 μL。质谱条件:对鼠李糖脂样品采用阴离子模式,电喷雾毛细管喷口电离电压4.2 kV,雾化气和干燥气均为氮气,喷雾气压力为1.0 Pa,干燥气温度180 ℃、流速为5.0 L/min,质谱扫描范围为100−1 000 (m/z)。

表3 本研究所用的引物
The underlined is the sequence of synthetic promoter corresponding to the primer name.
2 结果与分析
2.1 rhlAB基因的异源表达合成鼠李糖脂
基因编码的鼠李糖基转移酶既能够催化生成β-羟基烷酸 (HAAs),又能将HAAs 与TDP-L-鼠李糖结合生成鼠李糖脂,是生产鼠李糖脂的关键酶 (图1)。同时,基因的拷贝数和启动子强度是影响工程菌代谢产物生产的重要因素。本实验以不同拷贝数形式表达带有3种表达强度启动子的基因,通过基因拷贝数和启动子强度对基因的表达进行调控,获得合适的表达形式。实验结果如图2所示,对照组发酵液中未检测到鼠李糖脂 (数据未列出)。不同拷贝数之间的菌株产量差别明显;相同拷贝数之间以不同强度启动子表达基因的菌株产量差别较小。以上研究表明基因拷贝数在基因表达调控中占主导作用,而启动子强度的影响较小。含中等拷贝数质粒表达基因的菌株,鼠李糖脂产量明显高于以单拷贝数在基因组中表达基因的菌株和以高贝数质粒表达基因的菌株,表明中等拷贝数的pET-30a(+) 质粒更适合与不同强度的组成型启动子结合表达基因,实现鼠李糖脂在大肠杆菌中的异源合成。因此,选择带不同启动子强度表达基因的中等拷贝数质粒pET-164RhlAB、pET-230RhlAB和pET-346RhlAB作为基因的表达载体并进行进一步的表达调控。
2.2 rhlAB基因与rhaBDAC基因簇的启动子组合调控
基因簇控制表达的TDP-L-鼠李糖是鼠李糖脂合成的主要前体物质和限制因素,本实验中我们用不同强度启动子表达基因簇,并将其与带不同启动子的基因进行组合调控,实验结果如图3所示,对照菌株为PET164、PET230及PET346,鼠李糖脂平均产量分别为71、62和56 mg/L。在相同条件下含P230启动子的基因簇分别与pET-164RhlAB、pET-230RhlAB和pET-346RhlAB质粒进行组合调控得到的菌株Rha230-RAB164、Rha230-RAB230和Rha230- RAB346鼠李糖脂产量均高于其他组合调控的菌株,说明P230启动子更适合替代基因簇原始启动子与pET-164RhlAB、pET-230RhlAB、pET-346RhlAB质粒进行基因的组合调控,来提高鼠李糖脂的产量。9种组合菌株中Rha230-RAB346的产量最高,达到 106.6 mg/L。因此,选择含P230启动子的基因簇和含P346启动子的中等拷贝数质粒pET-346RhlAB的菌株Rha230-RAB346进行下一步优化实验,并将Rha230-RAB346命名为大肠杆菌TIB-RAB226。
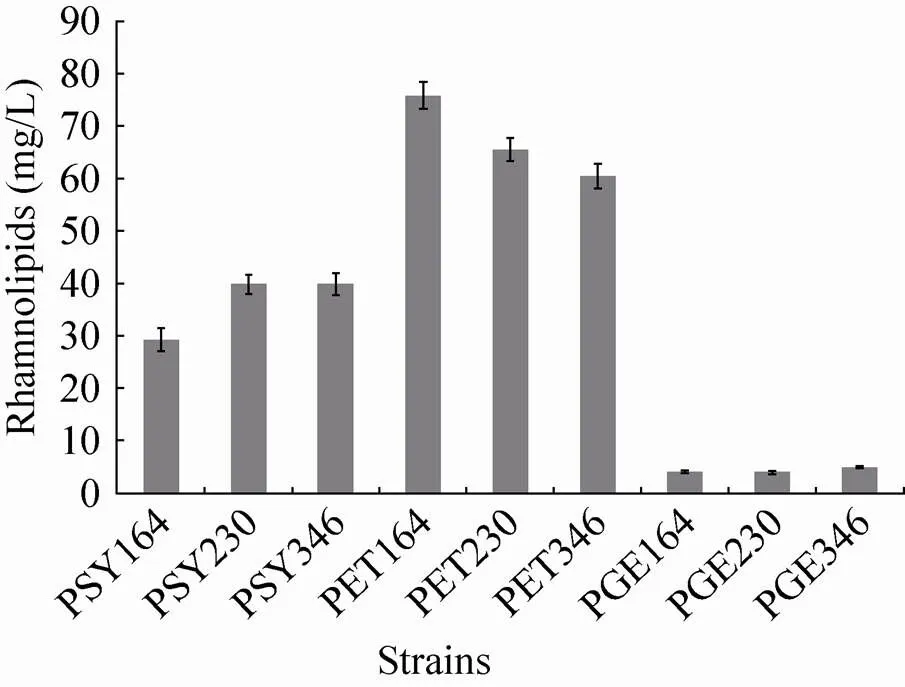
图2 rhlAB基因以不同形式在大肠杆菌表达时鼠李糖脂的产量
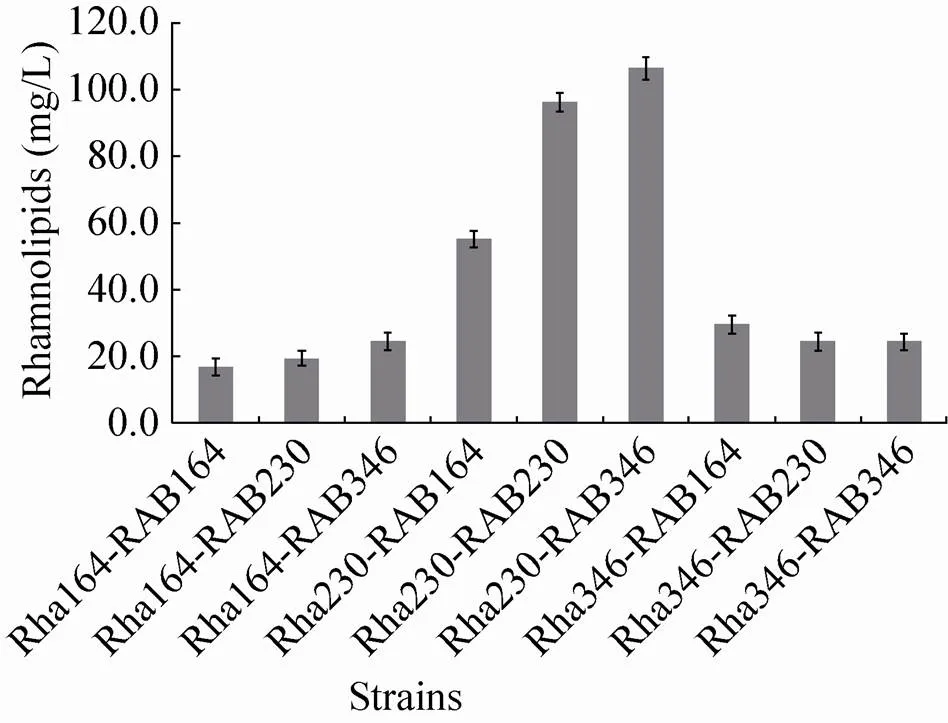
图3 不同强度启动子组合调控对大肠杆菌合成鼠李糖脂产量的影响
2.3 产鼠李糖脂大肠杆菌TIB-RAB226发酵温度优化
虽然宿主、载体和克隆基因是影响重组菌产物合成的主要因素,但是其所处的环境条件也是一个不可忽略的因素,尤其是环境温度的变化,不仅影响代谢过程中各种关键酶的活性及副产物的积累,而且还与质粒拷贝数的变化息息相关。因此,在发酵过程中需要采用一定的温度控制策略来改善代谢产物的合成与积累[18]。我们对大肠杆菌TIB-RAB226的发酵温度进行了优化,结果表明最适鼠李糖脂生产温度为28 ℃,鼠李糖脂最高产量可达到124.3 mg/L (图4),与30 ℃相比产量提高1.17倍。当温度进一步升高或低于28 ℃时,鼠李糖脂的产量都逐渐下降,36 ℃时鼠李糖脂产量下降为 64.1 mg/L,与28 ℃时最高产量相比下降约46.1%,降幅明显。
2.4 产鼠李糖脂大肠杆菌TIB-RAB226的分批补料发酵
为了进一步优化鼠李糖脂的合成,对大肠杆菌TIB-RAB226进行了分批补料发酵实验,测定了生产过程中细胞密度、鼠李糖脂产量及pH变化情况,结果如图5所示。发酵前8 h菌体在LB培养基中生长,鼠李糖脂产量和菌体生物量同步增加,pH逐渐变碱性。当培养至8 h左右细胞生长开始进入稳定期,pH由7.0升至8.5,细胞生长趋于稳定,600=3.47,鼠李糖脂的生产速率减小,产量达到111.7 mg/L。此时向培养基中补加1%的葡萄糖并继续发酵生产。在8−12 h阶段鼠李糖脂产量快速增加,在12 h左右鼠李糖脂达到最高产量209.2 mg/L,是补料前的1.87倍。此时,由于补加葡萄糖后发酵液中逐渐积累副产物乙酸导致pH降至6左右,工程菌生长缓慢并停止合成鼠李糖脂。发酵至16 h时细胞生物量达到600=10.1,并趋于稳定,pH降至5左右,此时乙酸积累达到1.7 g/L,导致菌体生长基本停止,无法进行进一步的补料实验。因此,要进一步改善鼠李糖脂的合成,需要对工程菌进行进一步的遗传改造,阻断副产物乙酸的合成与积累。

图4 不同温度对工程菌鼠李糖脂合成的影响
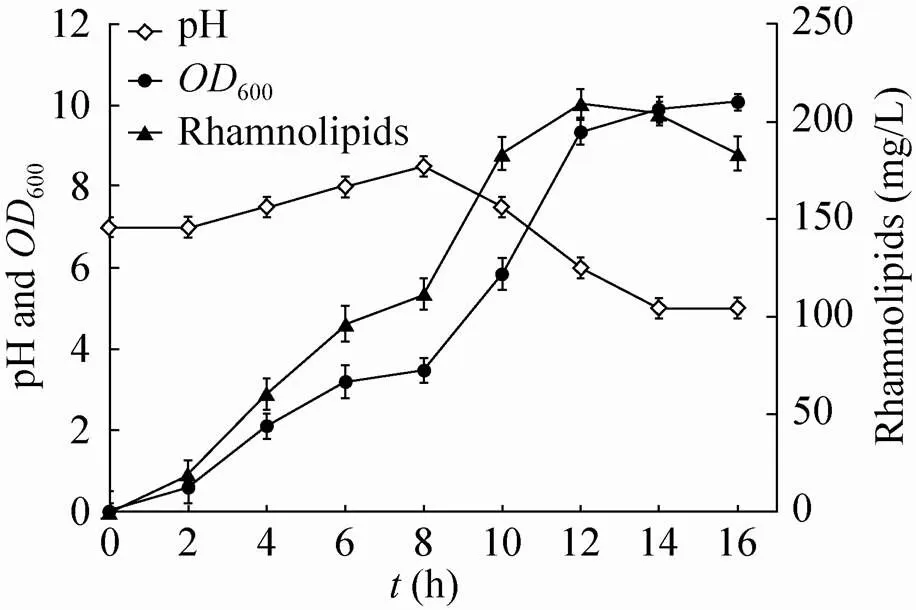
图5 大肠杆菌TIB-RAB226的分批补料发酵生产
2.5 LC-MS对产物中鼠李糖脂的结构分析
对工程菌生产的鼠李糖脂分离纯化进行了LC-MS分析,结果显示大肠杆菌合成的鼠李糖脂含有5类质核比(/) 的鼠李糖脂同系物 (图6),其中/为333.1908和503.3215鼠李糖脂分别在30.8 min和61.9 min 被分离,为Rhl-C10和Rhl-C10-C10。另外,/为531.4、475.3、529.3的离子峰分别在34.3、52.4和 55.9 min 被分离,根据相关研究结果[9,19-20],上述3种离子峰可能是另外3类单鼠李糖脂同系物,且均各含有2种分子量相同的鼠李糖脂同系物,分别为Rhl-C12-C10或Rhl-C10-C12,Rhl-C8-C10或Rhl-C10-C8,Rhl-C10-C12:1或Rhl-C12:1-C10。另外,根据LC-MS总离子流图的峰面积,估算该大肠杆菌合成的5类鼠李糖脂同系物的相对含量如图6所示,其中Rhl-C10-C12:1或Rhl-C12:1-C10组分的比例最大,相对丰度达到约55%。
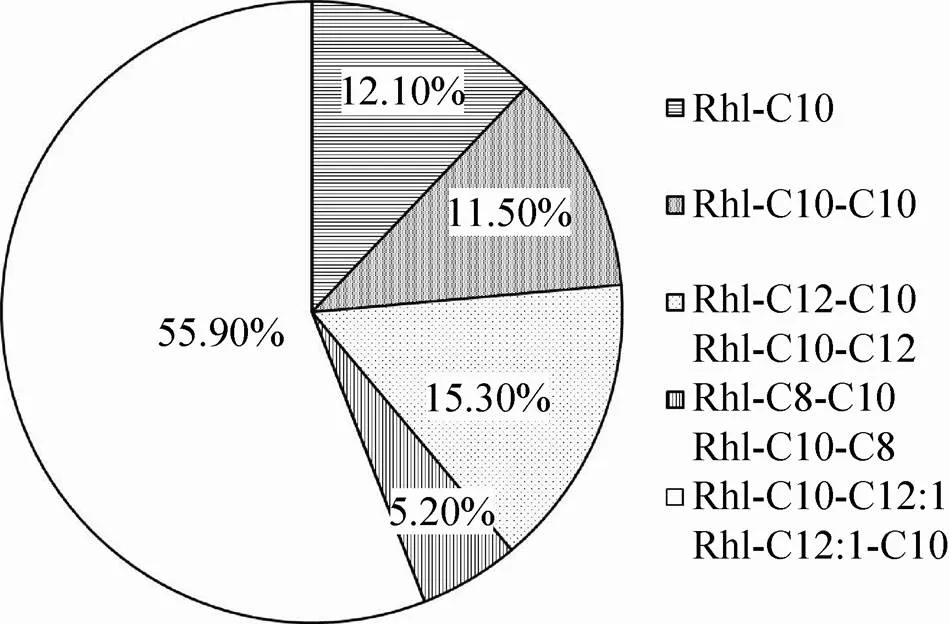
图6 大肠杆菌TIB-RAB226合成的鼠李糖脂同系物的相对含量
3 讨论
目前,主要通过铜绿假单胞菌发酵法生产鼠李糖脂[4],但是铜绿假单胞菌较强的条件致病性限制了其在工业生产中的应用。人们也尝试通过很多非致病微生物来生产鼠李糖脂[6,21],而大肠杆菌作为一种“一般认为安全 (GRAS)”的模式生物,具有清晰的遗传背景、成熟的遗传操作技术及广泛的工业应用,是异源合成鼠李糖脂合适的选择。我们将鼠李糖脂合成的关键基因在ATCC 8739中成功异源表达,并对相关基因利用不同强度的组成型合成启动子进行组合调控,得到一株鼠李糖脂产量较高的大肠杆菌工程菌TIB-RAB226。利用LB培养基并补加1%葡萄糖发酵,在12 h左右鼠李糖脂产量达到最高的209.2 mg/L。与之前报道的利用大肠杆菌产鼠李糖脂的文献[4-5]相比,鼠李糖脂的产量大幅提高。并且由于利用了组成型合成启动子进行关键基因的组合调控,使得该工程菌在生产鼠李糖脂时不需要相对昂贵的IPTG诱导物,为简化生产和降低成本奠定了基础。
基因的拷贝数是影响基因异源表达的主要因素[22-23]。在我们的研究中,基因以单拷贝数形式在大肠杆菌中表达时,鼠李糖脂的产量很低,可能的原因是当在基因组中单拷贝数表达基因时产生的鼠李糖基转移酶较少,导致其催化产生的鼠李糖脂较少。含中等拷贝数表达基因的菌株鼠李糖脂产量明显高于高拷贝数表达基因的菌株,推断一个可能的原因是以高拷贝数质粒表达外源基因时,目的基因表达量可能不再由质粒的拷贝数决定,而是由转录和翻译水平决定,导致拷贝数与表达量之间为非正相关关系,鼠李糖脂的产量不高。另一个可能的原因是基因以高拷贝数在大肠杆菌表达时会增加菌体的代谢负担,导致产率和转化率降低,不利于鼠李糖脂的积累。
在和组合调控中,与带中等强度的启动子表达时获得了最高鼠李糖脂产量,这有两种可能的原因:一、在此组合调控条件下,TDP-L-鼠李糖的产生与消耗达到动态平衡,更有利于鼠李糖脂的生产;二、在表达使用P230启动子合成TDP-L-鼠李糖的量最高,更适应合成鼠李糖脂的需要,这些可以通过分析基因的转录表达、前体物TDP-L-鼠李糖和HAA的量等来进一步研究。通过发酵温度的优化发现基因在大肠杆菌表达实现鼠李糖脂合成的最适温度为28 ℃,我们推测一方面可能是在此温度下鼠李糖脂合成相关途径的代谢流量更加平衡,另一方面可能是鼠李糖脂及其前体合成相关酶活性提高,更有利于鼠李糖脂的合成。LC-MS分析显示我们的大肠杆菌 TIB-RAB226合成的均为单鼠李糖脂,这与之前的报道一致[6,24],原因是大肠杆菌中缺乏鼠李糖基转移酶2基因 () 无法将TDP-L-鼠李糖结合到单环鼠李糖脂中形成双环的鼠李糖脂。不过来自我们的工程大肠杆菌的产物中,其同系物的相对丰度与Wang等[9]的还有一定的差异,Wang等在发酵产物中未检测到Rhl-C10-C12:1或Rhl-C12:1-C10类型的鼠李糖脂,而Rha-C10-C10类型的鼠李糖脂含量较高,这可能是由出发宿主菌的不同造成的。
另外,β-羟基烷酸 (HAAs) 的代谢通量也会直接影响鼠李糖脂的生物合成,是鼠李糖脂合成的另一个关键前体物质,其代谢合成主要受脂肪酸合成途径 (FAS-II) 和β-氧化途径的影响[25-26],我们下一步工作将对β-羟基烷酸合成途径中相关酶进行代谢调控,进一步提高大肠杆菌合成鼠李糖脂的能力。
[1] Abdel-Mawgoud AM, Lepine F, Deziel E. Rhamnolipids: diversity of structures, microbial origins and roles. Appl Microbiol Biotechnol, 2010, 86(5): 1323−1336.
[2] Ławniczak Ł, Marecik R, Chrzanowski Ł, et al. Contributions of biosurfactants to natural or induced bioremediation. Appl Microbiol Biotechnol, 2013, 97(6): 2327−2339.
[3] Linhardt RJ, Bakhit R, Daniels L, et al. Microbially produced rhamnolipid as a source of rhamnose. Biotechnol Bioeng, 1989, 33(3): 365−368.
[4] Rodrigo SR, Alyson GP, Bianca CN, et al. Gene regulation of rhamnolipid production in-a review. Bioresour Technol, 2011, 102(11): 6377−6384.
[5] Han L, Liu P, Peng Y, et al. Engineering the biosynthesis of novel rhamnolipids infor enhanced oil recovery. J Appl Microbiol, 2014, 117(1): 139−150.
[6] Müller MM, Hausmann R. Regulatory and metabolic network of rhamnolipid biosynthesis: traditional and advanced engineering towards biotechnological production. Appl Microbiol Biotechnol, 2011, 91(2): 251−264.
[7] Häußler S, Domke T, Nimtz M, et al. Purification and characterization of a cytotoxic exolipid of. Infect Immun, 1998, 66(4): 1588−1593.
[8] Gunther IV, Nuñez A, Fett W, et al. Production of rhamnolipids by, a nonpathogenic bacterium. Appl Environ Microbiol, 2005, 71(5): 2288−2293.
[9] Wang Q, Fang X, Bai B. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnol Bioeng, 2007, 98(4): 842−853.
[10] Cabrera-Valladares N, Richardson AP, Olvera C, et al. Monorhamnolipids and 3-(3-hydroxya lkanoyloxy) alkanoic acids (HAAs) usingas a heterologous host. Appl Microbiol Biotechnol, 2006, 73(1): 187−194.
[11] Ochsner UA, Hembach T, Fiechter A, et al. Production of rhamnolipid biosurfactants. Adv Biochem Eng Biotechnol, 1996, 53: 89−118.
[12] Müller MM, Kügler JH, Henkel M. Rhamnolipids-next generation surfactants? J Biotechnol, 2012, 162(4): 366−380.
[13] Bi SN, Wang YJ, Zuo YH. Improvement and application of oil spreading to detect biosurfactant. J Heilongjiang Bayi Agric Univ, 2009, 21(6): 58−60 (in Chinese).毕思宁, 王彦杰, 左豫虎. 生物表面活性剂排油圈检测方法的改进和应用. 黑龙江八一农垦大学学报, 2009, 21(6): 58−60.
[14] Lu J, Tang J, Liu Y, et al. Combinatorial modulation ofandgene expression for improved alternative glucose utilization. Appl Microbiol Biotechnol, 2012, 93(6): 2455−2462.
[15] Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes inK-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12): 6640−6645.
[16] Zhang X, Jantama K, Moore JC, et al. Production of L-alanine by metabolically engineered. Appl Microbiol Biotechnol, 2007, 77(2): 355−366.
[17] Jantama K, Zhang X, Moore JC, et al. Eliminating side products and increasing succinate yields in engineered strains ofC. Biotechnol Bioeng, 2008, 101(5): 881−893.
[18] Zhao CG, Xie XX, Cheng LK, et al. Effect of temperature on the process ofL-tryptophan fermentation. Lett Biotechnol, 2009, 20(4): 534−537 (in Chinese).赵春光, 谢希贤, 程立坤, 等. 温度对大肠杆菌L-色氨酸发酵过程的影响. 生物技术通讯, 2009, 20(4): 534−537.
[19] Lotfabad TB, Abassi H, Ahmadkhaniha R, et al. Structural characterization of a rhamnolipid-type biosurfactant produced byMR01: enhancement of di-rhamnolipid proportion using gamma irradiation. Colloids Surf B Biointerfaces, 2010, 81(2): 397−405.
[20] Zhong H, Zeng GM, Yuan XZ, et al. Adsorption of dirhamnolipid on four microorganisms and the effect on cell surface hydrophobicity. Appl Microbiol Biotechnol, 2007, 77(2): 447−455.
[21] Dubeau D, Déziel E, Woods D, et al.harbors two identicalgene clusters responsible for the biosynthesis of rhamnolipids. BMC Microbiol, 2009, 17(9): 263−275.
[22] Lin Y, Sun X, Yuan Q, et al. Extending shikimate pathway for the production of muconic acid and its precursor salicylic acid in. Metab Eng, 2014, 23: 62−69.
[23] Youngquist JT, Schumacher MH, Rose JP, et al. Production of medium chain length fatty alcohols from glucose in. Metab Eng, 2013, 20: 177−186.
[24] Jeiry T, Ana EE, Gloria S. Rhamnolipids: production in bacteria other than. Eur J Lipid Sci Technol, 2010, 112(10): 1082−1087.
[25] Abdel-Mawgoud AM, Lépine F, Déziel E, et al. A stereospecific pathway diverts β-oxidation intermediates to the biosynthesis of rhamnolipid biosurfactants. Chem Biol, 2014, 21(1): 156−164.
[26] Déziel E, Lépine F, Milot S, et al.is required for the production of a novel biosurfactant promoting swarming motility in: 3-(3-hydroxyalkanoyloxy) alkanoic acids (HAAs), the precursors of rhamnolipids. Microbiology, 2003, 149(8): 2005−2013.
(本文责编 陈宏宇)
Construction and optimization offor producing rhamnolipid biosurfactant
Zhijin Gong1,2, Yanfeng Peng2, Yuting Zhang2, Guotian Song1,2, Wujiu Chen2, Shiru Jia1, and Qinhong Wang2
1 College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China 2 Key Laboratory of Systems Microbial Biotechnology, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
Rhamnolipid biosurfactant is mainly produced bythat is the opportunistic pathogenic strain and not suitable for future industrial development. In order to develop a relatively safe microbial strain for the production of rhamnolipid biosurfactant, we constructed engineeredstrains for rhamnolipid production by expressing different copy numbers of rhamnosyltransferase () gene with the constitutive synthetic promoters of different strengths inATCC 8739. We further studied the combinatorial regulation ofgene andgene cluster for dTDP-l-rhamnose biosynthesis with different synthetic promoters, and obtained the best engineered strain—TIB-RAB226. Through the optimization of culture temperature, the titer of rhamnolipd reached 124.3 mg/L, 1.17 fold higher than that under the original condition. Fed-batch fermentation further improved the production of rhamnolipid and the titer reached the highest 209.2 mg/L within 12 h. High performance liquid chromatography-mass spectrometry (LC-MS) analysis showed that there are total 5 mono-rhamnolipid congeners with different nuclear mass ratio and relative abundance. This study laid foundation for heterologous biosynthesis of rhanomilipd.
rhamnolipid, rhamnosyltransferase,gene cluster, constitutive synthetic promoter, combinatorial regulation,
November 25, 2014;
January 21, 2015
National High Technology Research and Development Program of China (863 Program) (No. 2014AA022104), Industrial Biotechnology Program of Tianjin Municipal Science and Technology Commission (No. 12ZCZDSY13000).
:Yanfeng Peng. Tel/Fax: +86-22-84861950; E-mail: peng_yf@tib.cas.cn Qinhong Wang. Tel/Fax: +86-22-84861950; E-mail: wang_qh@tib.cas.cn
国家高技术研究发展计划(863计划) (No. 2014AA022104),天津市科学技术委员会工业生物技术专项 (No. 12ZCZDSY13000)资助。

