微分干涉差显微成像方法高通量分析单个苏金云芽孢杆菌HD-1芽孢萌发
陈越彭立新王晓春黎永青刘军贤王桂文(广西师范大学物理科学与技术学院,桂林54004)(广西科学院生物物理实验室,南宁50007)(美国东卡罗来那大学物理系,美国北卡罗来那州格林维尔NC7858)
研究报告
微分干涉差显微成像方法高通量分析单个苏金云芽孢杆菌HD-1芽孢萌发
陈越1,2彭立新2王晓春2黎永青3刘军贤*1王桂文*21(广西师范大学物理科学与技术学院,桂林541004)2(广西科学院生物物理实验室,南宁530007)
3(美国东卡罗来那大学物理系,美国北卡罗来那州格林维尔NC27858)
苏云金芽孢杆菌(Bt)休眠的芽孢具有极强的抗逆境能力,在合适的条件下很快萌发。本研究采用倒置显微镜建立微分干涉差(DIC)显微成像方法,高通量实时监测大量单个HD-1芽孢的萌发过程,并运用拉曼光谱进行对比。结果显示,萌发过程DIC图像亮度变化动态与芽孢吡啶二羧酸的含量变化有对应性;6 s的时间分辨率即可较好地呈现芽孢的萌发动态;以10mmol/L丙氨酸为营养萌发剂,Bt芽孢在Tris-HCl (pH 8.3)和Hepes(pH 7.4)缓冲液中的萌发动态基本相同;Bt芽孢在非营养萌发剂月桂胺中萌发极其缓慢,而在外源2,6-吡啶二羧酸钙下萌发极其迅速。结果表明,应用DIC显微成像技术可实现高通量实时观测大量单个Bt芽孢萌发的动态过程,为了解Bt芽孢的萌发机制和异质性提供了极大便利。
苏云金芽孢杆菌;微分干涉差显微术;拉曼光谱;芽孢萌发;单细胞分析
1 引 言
芽孢是细菌的特殊休眠体,拥有独特的成分和结构,具有极强的抗热、抗辐射和抗化学药物的能力[1,2]。遇到合适的条件,芽孢可以很快萌发,恢复到生长状态。芽孢萌发并恢复新陈代谢特征是芽孢开始营养生长的关键一步,一旦萌发就失去了原有的抗逆能力,更容易被杀死[2,3]。
对细菌芽孢萌发机理的研究多集中于对枯草芽孢杆菌(Bacillus subtilis)和产气荚膜梭菌(Clostridium perfringens)[4~6]。苏金云芽孢杆菌(Bacillus thuringiensis,Bt)是目前世界上生产规模最大、应用最广泛的生物农药[7,8]。虽然起主要作用的是伴随芽孢形成而产生的伴孢晶体蛋白,但Bt芽孢可以单独或通过晶体对昆虫起毒性作用[9],甚至有增强效应[10]。早期对Bt芽孢萌发的研究集中在Bt芽孢在昆虫肠道内的萌发规律[11,12],并陆续在萌发条件[13]和基因调控[14,15]等领域开展研究。Bt既是广泛应用的生物农药,也是与炭疽芽孢杆菌(B.anthracis)及蜡样芽孢杆菌(B.cereus)遗传关系密切的物种。研究Bt芽孢萌发机制与萌发规律,可以更好地了解Bt农药制剂施用过程Bt芽孢在田间、昆虫肠道的存活规律,提高Bt制剂的杀虫效果,为Bt农药制剂生产服务,加深对细菌芽孢萌发机制的认识。
对Bt芽孢萌发的研究多应用常规的分光光度计检测600 nm波长处的光密度变化[13],仅得到反映群体芽孢平均萌发情况的萌发率,不能了解单个芽孢的萌发信息。文献[16]应用拉曼光谱观测单个Bt芽孢的萌发过程,并发现其芽孢萌发存在异质性,但是其分析效率较低。文献[17]应用微分干涉差(Differential interference contrast,DIC)显微镜或者相差显微镜成像等方法观测枯草芽孢杆菌(B.subtilis)的芽孢萌发过程,可以实时同步观察大量芽胞的动态萌发,但尚未有应用于Bt芽孢萌发研究的报道。
本研究将DIC显微成像方法应用于Bt芽孢,高通量监测大量单个HD-1芽孢的萌发进程,并通过拉曼光谱方法对萌发过程同步跟踪。结果表明,单个芽孢萌发过程芽孢折光率的变化与孢内大量的2,6-吡啶二羧酸(DPA)与Ca2+的络合物CaDPA的释放过程相对应,通过DIC强度的变化可以监测Bt芽孢的萌发进程,而且可以了解常规方法无法观测的芽孢皮层水解的过程。DIC显微成像技术可以高通量实时观测大量单个Bt芽孢萌发动态,为了解Bt芽孢的萌发机制和异质性提供了极大便利。
2 实验方法
2.1 实验材料
蛋白胨和酵母提取物(英国Oxiod公司),月桂胺和DPA(美国Sigma公司),其它试剂均为国产分析纯或者生物纯试剂。苏金云芽孢杆菌(B.thuringiensis)HD-1菌株(中国普通微生物菌种保藏管理中心)。
种子培养基(LB):蛋白胨10 g,酵母提取物5 g,NaCl 10 g,pH 7.4~7.6。
液体培养基(CCY):0.5mmol/LMgCl2·6H2O,0.01mmol/LMnCl2·4H2O,0.05mmol/L FeCl3· 6H2O,0.05mmol/L ZnCl2,0.2mmol/L CaCl2·6H2O,13mmol/L KH2PO4,26mmol/L K2HPO4,谷氨酰胺20 mg,酸水解干酪素1 g,酶水解干酪素1 g,酵母提取物0.4 g,甘油0.6 g,以去离子水定容至1000 mL。在121℃高温灭菌20min。
萌发剂:10mmol/L丙氨酸,0.8mmol/L月桂胺,45mmol/L CaDPA。
缓冲液:25mmol/L(pH 7.4)Hepes缓冲液,25mmol/L Tris-HCl(pH 8.3)。
2.2 芽孢制备
菌株在LB固体培养基活化24~36 h,挑取单菌落,转接入LB液体培养基,200 r/min过夜培养;按1% 的比例转入产孢培养基(CCY),200 r/min培养48~60 h。镜检芽孢率达到99%后,5000 r/min离心收集、纯化芽孢,无菌水洗涤10次,4℃避光保存备用。培养温度均为30℃。
2.3 芽孢萌发
将待分析的Bt芽孢用无菌水稀释为108个/mL,经过70℃水浴30min、0℃冰浴15min的热激处理后,吸取2μL滴加在盖玻片上,真空干燥,将盖玻片固定在自制的恒温平台上。参考芽胞萌发的常规条件[5,13],观察营养萌发剂和非营养萌发剂诱发的Bt芽孢萌发过程。营养萌发剂是指可以作为细胞生长的营养物质的一类萌发剂,非营养萌发剂则不能作为细胞生长的营养物质,如盐类、表面活性剂等。(1)营养萌发 加入预热萌发剂(含10mmol/L丙氨酸的25mmol/L 4-羟乙基哌嗪乙磺酸的(Hepes)缓冲液(pH 7.4)或者Tris-HCl缓冲液(pH 8.3)),培养温度37℃;(2)非营养萌发 待分析芽孢不经过热激处理,顺序加入45mmol/L CaDPA或者0.8mmol/L月桂胺和25mmol/L Hepes缓冲液(pH 7.4),培养温度分别为30℃和45℃。根据实验需要,每1 s、6 s或12 s采集一幅DIC图像,45mmol/LCaDPA的萌发过程观察50min,其它实验持续观察2 h。
2.4 显微拉曼光谱收集
应用单细胞激光拉曼光谱系统[18,19]聚焦在单个芽孢上采集拉曼光谱。激光强度为5 mW,从加入萌发剂开始连续采集拉曼光谱,每个光谱的积分时间为15 s,直到芽胞萌发后30~50min。
2.5 微分干涉差显微成像测定
微分干涉差显微术是以平面偏振光为光源,光线经过棱镜折射后分成两束,当光通过细胞时,光的相位发生变化,通过细胞厚而精密的部位(如核)时光速变慢,与通过邻近薄的部位(如胞质)的光之间产生相位偏移,当两束光线再联合起来时产生干涉效应,显示活细胞的细节。芽孢的核心是一个CaDPA的巨型仓库,并且水的含量非常少,折射率高,DIC显微镜将其转换成一个振幅图像,可通过CCD将其记录下来。在萌发过程中,芽孢内部物质(其中主要的大分子为CaDPA)大量的释放并与周围水分子进行置换,折射率发生变化[20]。
将DIC显微镜(Olympus IX81,日本Olympus公司)稍加改造,并接入高性能CCD(CoolSNAP cf2,美国Photometrics公司),实现同步监测芽孢萌发过程的拉曼光谱和DIC图像(图1)。通过自编VC程序,每隔一定的时间自动采集一幅DIC图像,图像采集过程通过显微镜自带的稳焦模块保持图像始终处于同一焦平面上。图像处理:基于芽孢的相衬图像的强度比背景高(图2D),用Matlab软件编写程序,设置强度阈值将图像转换成二进制的黑白图像;以单个芽孢为中心,计算芽孢范围内20个像素位点白色区域的平均强度,作为芽孢图像信号积分,依时间函数绘制成芽孢萌发过程的实时DIC信号强度变化曲线(图2)。
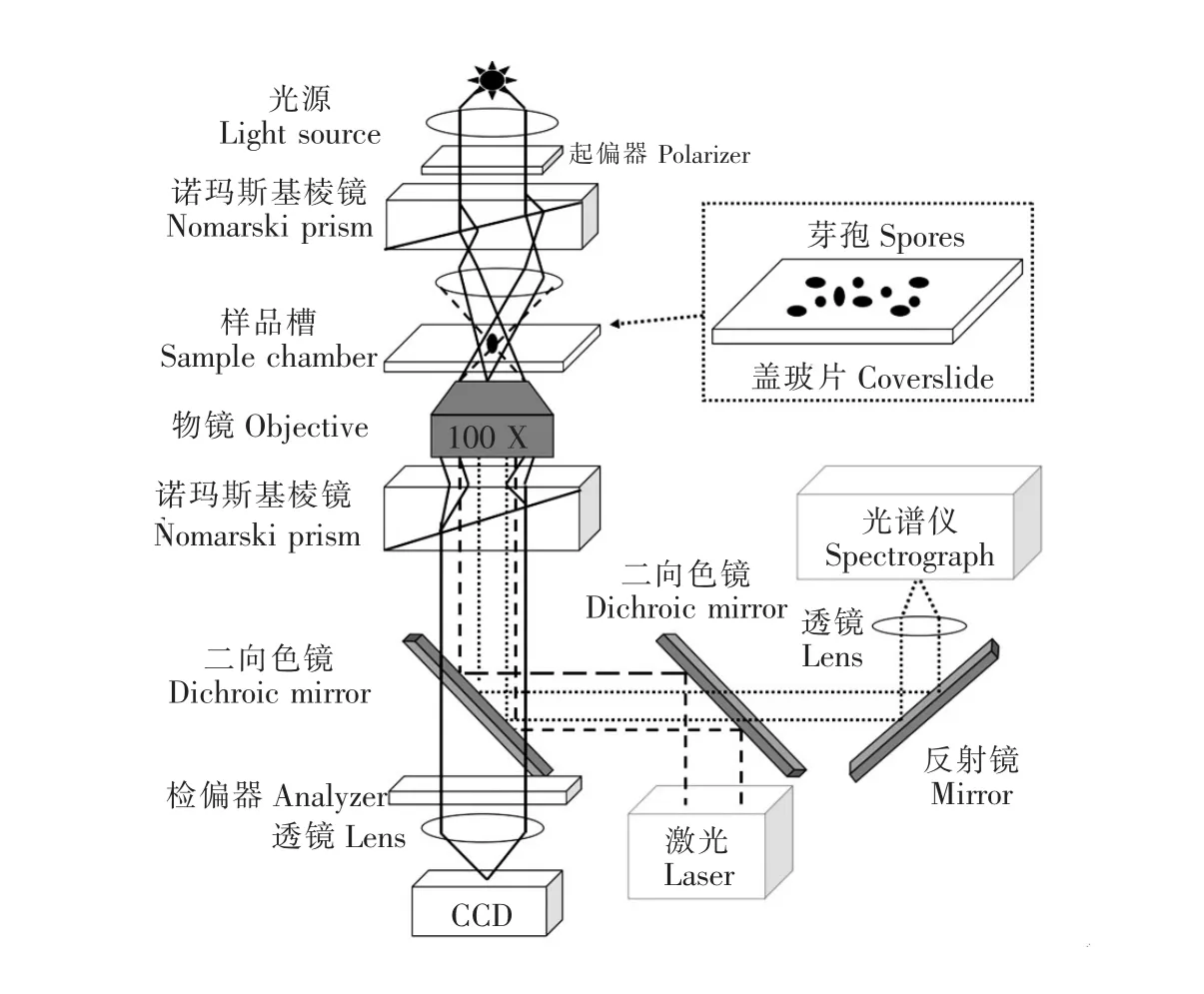
图1 实验中所用微分干涉差显微成像系统和拉曼光谱系统示意图Fig.1 Setup schematic of differential interference contrast(DIC)microscopy imaging system and Raman spectroscopy system used in this work.
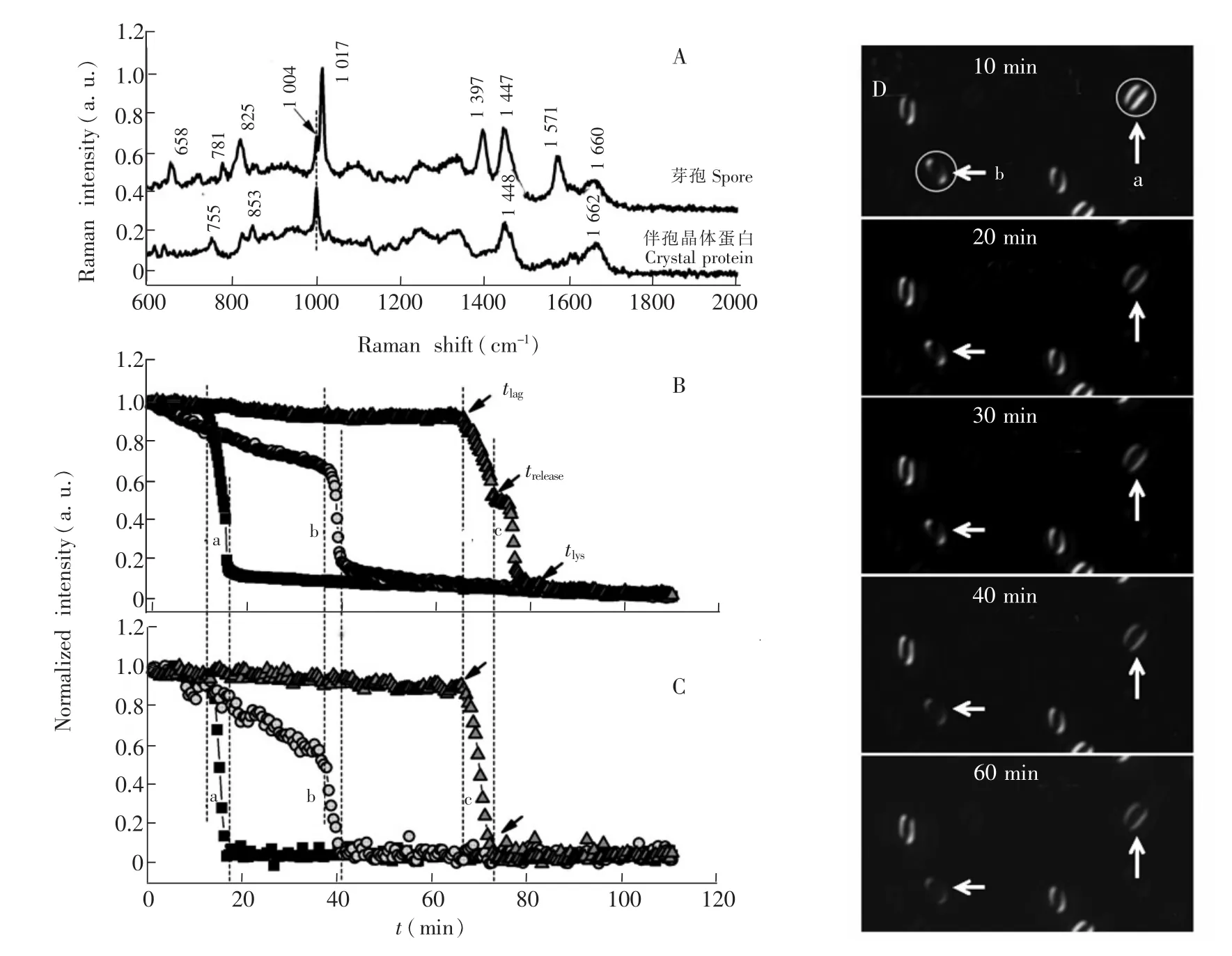
图2 单个芽孢与伴孢晶体蛋白的拉曼光谱(A);DIC显微成像技术(B)与实时拉曼光谱(C)同步分析a,b,c 3个Bt芽孢萌发的动态过程;D是图B和图C中a,b两个芽孢的DIC图像变化过程。Fig.2 Raman spectra of single spore and crystal protein from B.thuringiensis(Bt)(A).Simultaneous monitoring of the germination of three individual Bt spores by DICmicroscopy imaging(B)and Raman spectroscopy(C).(D),DIC images of germination process of spore a and b showing in Fig.B and C
3 结果与分析
3.1 DIC与拉曼光谱同步监测单个芽孢萌发
芽孢萌发过程中经历3个明显阶段:萌发迟滞期、孢内CaDPA释放阶段和肽聚糖皮层溶解阶段[5]。图2是应用DIC显微成像和共焦显微拉曼实时同步分析同一Bt芽孢的萌发动态过程。伴随着芽孢的形成,生成的伴孢晶体蛋白是Bt生物农药的关键成分,大小与芽孢类似,但显示出显著不同的拉曼光谱特征峰(图2A),其中1017 cm-1是芽孢CaDPA的特有峰,其峰面积可定量芽孢的CaDPA总量[16]。图2B是芽孢萌发过程DIC图像亮度变化动态,设定芽孢与萌发剂开始接触的时间为0,孢内CaDPA开始快速释放的时间为迟滞时间tlag,孢内CaDPA释放完毕的时间为trelease,芽孢皮层完全溶解的时间为tlys,定义CaDPA释放需要的时间为Δtrelease=trelease-tlag,皮层溶解所需时间为Δtlys=tlys-trelease。图2D显示对应的芽孢图像,每个芽孢被小的暗条分成两个亮的部分,这是由于芽孢中心相位梯度形成,DIC图像越亮,CaDPA的含量越高。
为了确认芽孢萌发过程DIC图像亮度与孢内CaDPA释放的对应关系,通过显微拉曼光谱同时记录同一芽孢的DIC图像和拉曼光谱,计算芽孢的CaDPA特征峰1017 cm-1的峰高,画出其变化曲线(图2C)。在CaDPA开始大量释放前(tlag),芽孢的DIC图像亮度和1017 cm-1峰已经逐渐降低;tlag后, DIC图像亮度和1017 cm-1峰强度都快速降低,直到孢内CaDPA完全释放(trelease),1017 cm-1峰完全消失;之后DIC图像亮度随着芽孢皮层溶解缓慢下降,并逐渐保持基本不变。因此,在Bt芽孢萌发过程中,孢内CaDPA释放过程(即trelease时间点前)DIC图像亮度与CaDPA的含量变化高度一致,可以通过DIC强度的变化监测Bt芽孢的萌发进程,而且可以获知常规方法无法获知的芽孢皮层水解的过程。
3.2 单个Bt芽孢萌发细节
对比了DIC成像在1,2,6,9和12 s等不同的时间分辨率下监测同一单个Bt芽孢的萌发动态, 图3中是2,6和12 s的动态曲线,每个点代表一个图像采集时间点。2,6和12 s的分辨率均可以显示整个芽胞萌发动态,2 s的时间间隔非常短暂,记录的点非常紧凑,有时不能很好地判断萌发各阶段的准确时间点,且记录的数据量很大;而12 s的时间分辨率的时间间隔略大,芽孢肽聚糖皮层溶解过程的萌发细节不明显,容易被忽略;6 s的时间分辨率可清晰地展示每个阶段的萌发细节。表1统计了30个芽孢在不同时间分辨率下的萌发参数,t-测验显示无显著差异。对比不同时间分辨率下的萌发曲线,结合萌发参数统计,时间分辨率6 s即可准确定位CaDPA的快速释放过程,适合观察芽孢萌发动态细节。

表1 Bt芽孢不同时间间隔下得到的萌发参数*Table 1 Germination parameters of B.thuringiensis spores recorded at different time intervals
3.3 高通量实时分析大量单个Bt芽孢萌发
在上述实验基础上,应用DIC成像实时监测了大量Bt芽孢在不同的萌发剂和萌发条件下的萌发过程。在显微镜同一视野下同时监测并记录300~700个芽孢的萌发过程,监测时间为120min。每隔5~10min统计一次已经萌发的芽孢数,得到的群体曲线见图4A。在10mmol/L营养萌发剂丙氨酸激发下,Bt芽孢在Tris-HCl缓冲液(pH 7.4)和Hepes缓冲液(pH 8.3)中的群体萌发过程基本相同,加入萌发剂后,芽孢就陆续开始萌发,多数芽胞在20min内萌发,而95%以上的芽孢在60min内萌发,但仍然约有1%的孢子在120min的观察期内未萌发;而在45mmol/L非营养萌发剂CaDPA下,芽孢萌发极快,95%以上的芽孢在10min内萌发,约有0.2%孢子在120min的观察期内未萌发;同样是非营养萌发剂,Bt芽孢经月桂胺诱发,在120min的观察期内仅有约4%芽孢萌发。原因可能是两者所诱发的芽胞萌发机制不同,外源CaDPA通过激活皮层水解酶CwlJ水解位于芽孢皮层的肽聚糖,进而引起孢内CaDPA的释放[3],而月桂胺则可能是直接或间接打开释放CaDPA的通道[21]。
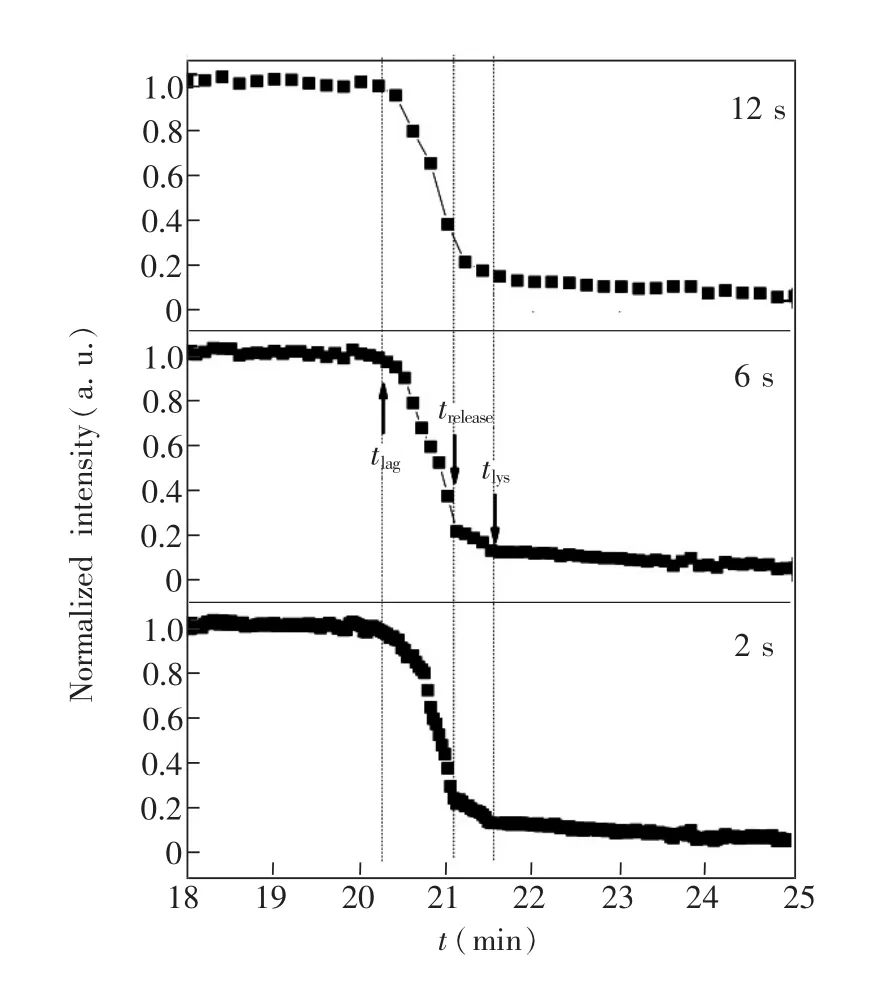
图3 同一Bt芽孢不同时间间隔(2 s,6 s,12 s)的萌发过程动态曲线Fig.3 Germination dynamics of single B.thuringiensis spore recorded in the time intervals of2 s,6 s and 12 s
图4(B~D)是随机选择的6个单个芽孢的萌发动态,将其DIC初始强度归一为1,萌发后DIC强度的最低值,归一为0。由图4可见:(1)在同样的萌发条件下,芽孢萌发的动态过程是类似的,显著不同的是芽孢DIC强度快速降低的开始时间(即孢内CaDPA开始快速释放的时间,tlag);(2)在tlag时间点前,芽孢的亮度变化很小,约下降5% ~10%,说明在tlag前,孢内CaDPA仅有少量释放;(3)tlag时间点后,芽孢的亮度快速下降,到trelease(CaDPA快速释放阶段结束,图2)时,芽孢的亮度约为初始的70%~80%;(4)trelease后,芽胞图像亮度降低约5% ~10%,这是芽胞皮层水解的过程。
随机选择约 50个芽孢,统计 tlag,trelease,tlys, Δtrelease和 Δtlys等萌发参数。 由表 2可知,(1)在10mmol/L丙氨酸触发下,Bt芽孢在Tris-HCl缓冲液(pH 7.4)和Hepes缓冲液(pH 8.3))下的萌发参数基本相同;(2)与图4B和4C显示的萌发动态过程类似,在同样的萌发条件下,芽孢快速释放孢内DPA的过程基本相同,Δtrelease值为1.0~1.6min,其标准差(SD值)约为0.6min;(3)在同样的萌发条件下,芽孢萌发的异质性表现在tlag值显著不同,在10mmol/L丙氨酸激发下,其SD值约为10min;相应地,受tlag值的异质性影响,芽胞萌发的trelease,tlys值也差异显著;(4)在外源CaDPA的触发下,芽孢皮层溶解的过程(即Δtlys)比丙氨酸触发快。
上述结果表明,采用单个视野的DIC成像方法可以同时观察300~700个芽胞的萌发过程。如果采用自动转换平台,每6 s采集一帧图像,考虑视野转换和曝光所需的时间,在6 s时间内可以循环采集4个视野的图像,则在同一次实验中可以观察多达2800个以上的芽胞萌发过程。
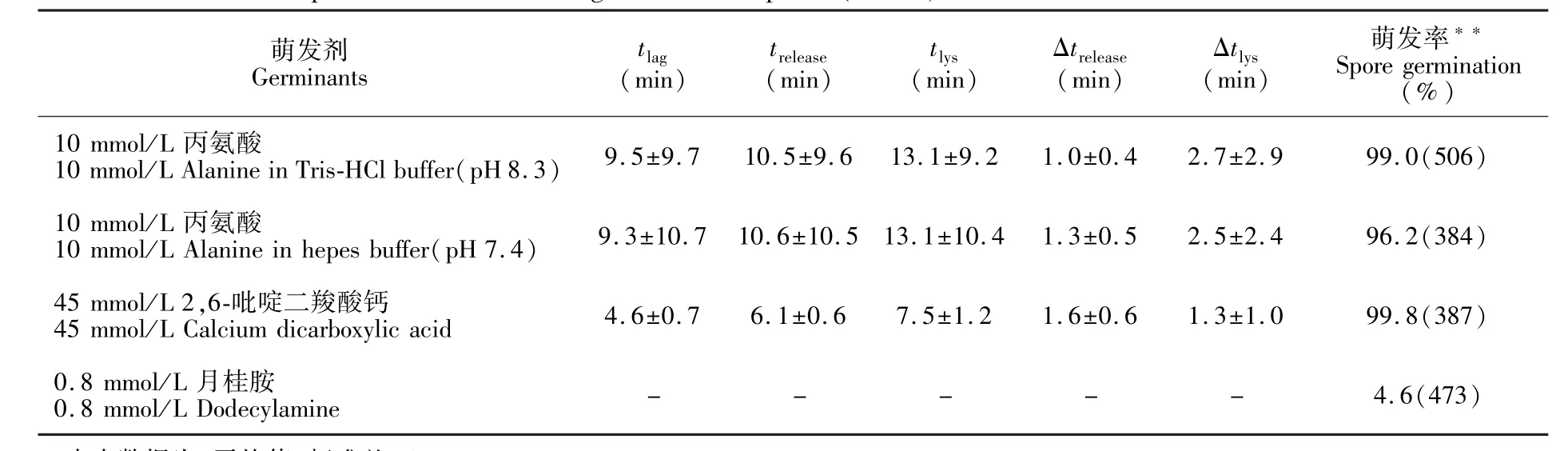
表2 Bt HD-1芽孢在不同的萌发剂、不同缓冲液下的萌发参数*Table 2 Germination parameters of B.thuringiensis HD-1 spores(n=50)
4 结论
通过改造微分干涉差(DIC)显微镜,接入高性能CCD,用显微镜自带的稳焦模块保持图像始终处于同一焦平面上,通过自编程序,每隔一定的时间自动采集一幅DIC图像,观察了Bt芽孢的动态萌发过程。经与拉曼光谱同步监测,孢子释放CaDPA的过程与DIC图像强度变化一致;应用上述实验系统同步观察了大量Bt芽孢在营养萌发剂和非营养萌发剂下的萌发动态发现,Bt芽孢在Tris-HCl(pH 8.3)缓冲液和Hepes(pH 7.4)缓冲液中的萌发情况基本相同,而在非营养萌发剂月桂胺中萌发非常缓慢,在外源CaDPA下却很迅速。在相同的萌发条件下,同一群体内Bt芽孢间的萌发异质性主要体现在参数tlag上。研究结果表明,通过DIC显微镜可以高通量分析单个Bt芽孢萌发的动态过程,阐明其萌发特征,为了解Bt芽孢的萌发机制和异质性提供了极大便利。
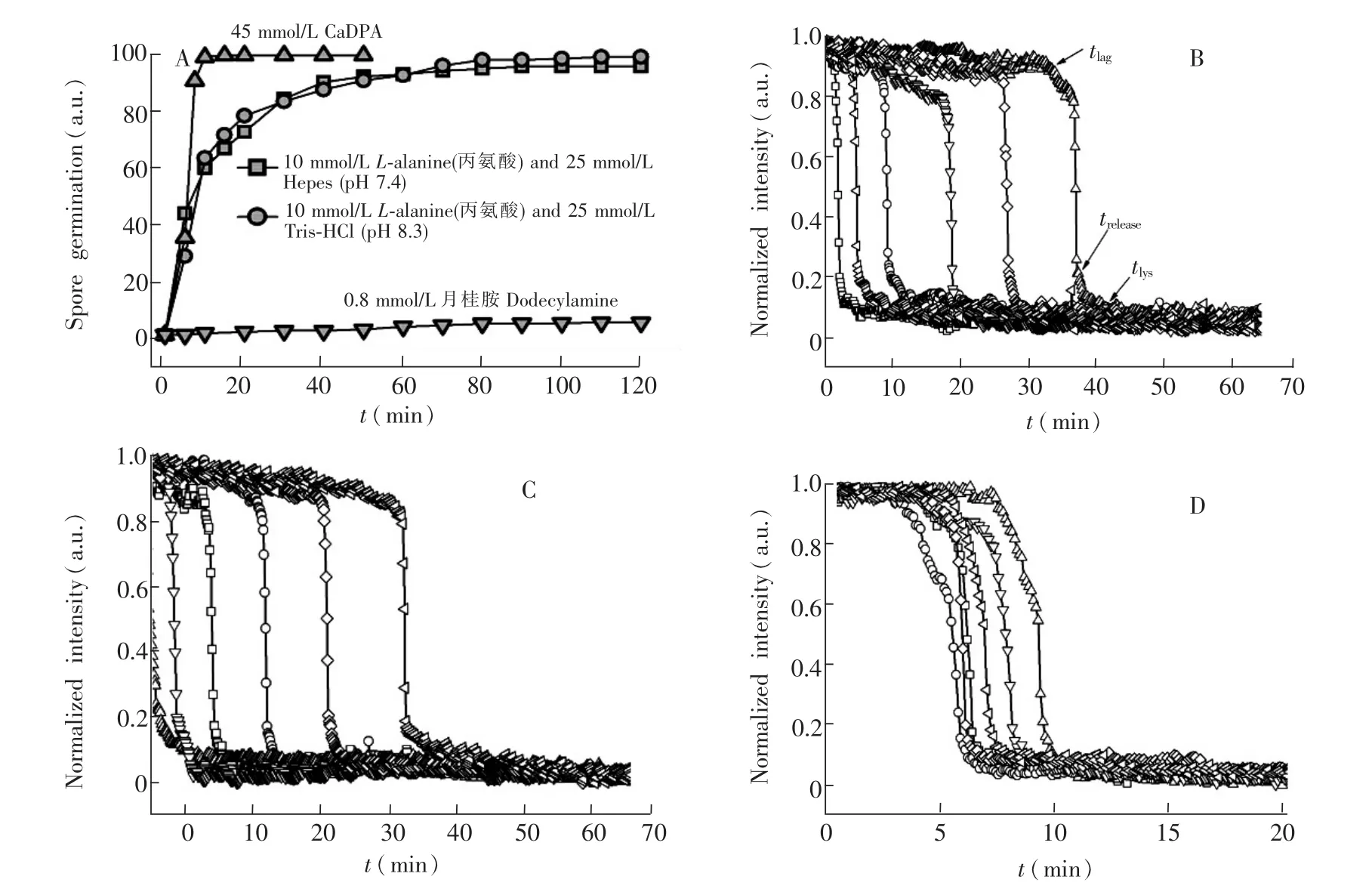
图4 A,Bt HD-1芽孢在不同萌发条件下的萌发曲线;B~D,不同萌发剂条件下6个芽胞各自萌发的动态过程:B,10mmol/L丙氨酸,25mmol/L Tris-HCl(pH 8.3);C,10mmol/L丙氨酸,25mmol/L Hepes (pH 7.4);D,45mmol/L CaDPA。Fig.4 (A)Germination of B.thuringiensis HD-1 spores and(B-D)kinetics of germination of 6 individual spores.Spores were germinated in 25mmol/L Tris-HCl(pH 8.3)(B)or in 25mmol/L Hepes buffer (pH 7.4)(C)with 10mmol/L alanine,or with 45mmol/L calcinm dicarboxylic acid(CaDPA)(D)
1 Paredes-Sabja D,Sarker M R.Future Microbiol.,2009,4(5):519-525
《国网通用设计》因篇幅受限,装配式建筑墙体只推荐了形式,没有详图设计。陕西西安某110 kV变电站,采用《国网通用设计》中全户内变电站110-A2-3方案[3](应用本文时应以《国网通用设计》中该方案的适用条件为准)。该变电站为城市型全户内变电站,《国网通用设计》统一了配电装置楼的墙体材料:外墙采用压型钢板复合板,内墙采用轻钢龙骨石膏板隔墙。在该工程设计时,根据规程规范的防火、节能、降噪等要求,分别对变电站的内隔墙、外墙,进行墙体参数细化设计研究,内墙主要根据墙体材料耐火极限进行设计,外墙根据防火、节能、降噪等要求进行设计计算。
2 Setlow P,Johnson EA.Sporesand Their Significance.In Doyle MP,Buchanan R(ed),Food Microbiology,Fundamentals and Frontiers,4th ed,Washington,DC:ASM Press,2012:45-79
3 Setlow P.Curr.Opin.Microbiol.,2003,6(6):550-556
4 Paredes-Sabja D,Setlow P,Sarker M R.Trends Microbiol.,2011,19(2):85-94
5 Setlow P.J.Appl.Microbiol.,2013,115(6):1251-1268
6 Setlow P.J.Bacteriol.,2014,196(7):1297-1305
7 Aronson A I,Shai Y.FEMSMicrobiol.Lett.,2001,195(1):1-8
8 Rosas-García N M.Recent Pat.Biotechnol.,2009,3(1):28-36
9 Crickmore N.J.Appl.Microbiol.,2006,101(3):616-619
10 Bulla Jr.L A,Rhodes R A,St Julian G.Annu.Rev.Microbiol.,1975,29:163-190
11 Borgonie G,van Driessche R,Leyns F,ArnautG,deWaele D,Coomans A.J.Invertebr.Pathol.,1995,65(1):61-67
12 Wilson G R,Benoit T G.J.Invertebr.Pathol.,1990,56(2):233-236
13 WU Yan-Yan,SUN Chang-Po,GAO Ji-Guo,ZHANG Jie,HUANG Da-Fang,SONG Fu-Ping.J.Agr.Sci.Tech.China, 2007,9(3):98-103
吴艳艳,孙长坡,高继国,张杰,黄大昉,宋福平.中国农业科技导报,2007,9(3):98-103
14 Yan X,Gai Y,Liang L,Liu G,Tan H.Arch.Microbiol.,2007,187(5):371-378
15 Liang L,He X,Liu G,Tan H.Microbiol.,2008,154(Pt5):1333-1340
16 Chen D,Huang SS,Li Y Q.Anal.Chem.,2006,78(19):6936-6941
17 Zhang P,Kong L,Wang G,Scotland M,Ghosh S,Setlow B,Setlow P,Li Y Q.J.Appl.Microbiol.,2012,112(3):526-536
18 ZHOU Bing,LU Ming-Qian,ZHAO Li-Wei,HUANG Shu-Shi,CHEN Li-Mei.Chinese J.Anal.Chem.,2013,41(12):1789-1794
周冰,卢明倩,赵丽伟,黄庶识,陈丽梅.分析化学,2013,41(12):1789-1794
19 QIN Zhao-Jun,LAIJun-Zhuo,PENG Li-Xin,LIU Bin,LIU Jun-Xian,WANGGui-Wen.Chinese J.Anal.Chem.,2014, 42(10):1471-1477
覃赵军,赖钧灼,彭立新,刘斌,刘军贤,王桂文.分析化学,2014,42(10):1471-1477
20 Zhang P,Kong L,Wang G,Setlow P,Li Y Q.Appl.Environ.Microbiol.,2011,77(14):4754-4769
21 Setlow B,Cowan A E,Setlow P.J.Appl.Microbiol.,2003,95(3):637-648
(Received 27 April 2015;accepted 10 August2015)
This work was supported by the National Natural Science Foundation of China(Nos.11264004,31460035)
High-throughput Investigation of Germ ination of Individual Bacillus Thuringiensis HD-1 Spores by Differential Interference Contrast M icroscopy Imaging
CHEN Yue1,2,PENG Li-Xin2,WANG Xiao-Chun2,LIYong-Qing3,LIU Jun-Xian*1,WANG Gui-Wen*21(College of Physics Sciences&Technology,Guangxi Normal University,Guilin 541004,China)
2(Laboratory of Biophysics,Guangxi Academy ofSciences,Nanning 530007,China)
3(Department of Physics,East Carolina University,Greenville,NC 27858,USA)
Bacillus thuringiensis(Bt),a unique bacterium which forms parasporal crystal protein and spore in parallel,is themostwidely used environmentally in compatible biopesticide worldwide.Bt spore has a strong resistance to stress and adversity,and germinates rapidly once conditions are favorable for growth.In this work,differential interference contrast(DIC)microscopy was used tomonitor the germination of individual Bt HD-1 spores,and the germination process was also investigated with Raman spectroscopy simultaneously.Experiment results showed that the decrease in normalized DIC intensity of Bt spore was consistent with the release of pyridine-2,6-pyridine dicarboxylic acid(dipicolinic acid[DPA]) determined by Raman spectroscopy.Temporal resolution of 6 seconds could well describe the dynamic process of spore germination.Bt spore showed similar germination kinetics triggered either by 10mmol/L alanine at 37℃ in 25mmol/L Tris-HCl buffer(pH 8.3)or in 25mmol/L Hepes buffer(pH 7.4).Most spores did not germinate triggered by dodecylamine but germinated rapidly triggered by exogenous Ca-DPA.These results indicated that DIC microscopy imaging could be used to observe germination of individual Bt spores in real-time quantitatively, and help to the understanding ofmechanisms of Bt spore germination and its heterogeneity.
Bacillus thuringiensis;Differential interference contrastmicroscopy;Raman spectroscopy;Spore germination;Single-cell analysis
10.11895/j.issn.0253-3820.100345
2015-04-27收稿;2015-08-10接受
本文系国家自然科学基金项目(Nos.11264004,31460035)资助
E-mail:jxliu@mailbox.gxnu.edu.cn;wguiwen@gxas.cn

