用于检测细胞中亚硝酰氢的近红外荧光探针及其生物应用
刘萍韩潇玥,于法标陈令新(中国科学院海岸带环境过程与生态修复重点实验室,山东省海岸带环境工程技术研究中心,中国科学院烟台海岸带研究所,烟台64003)(中国科学院大学,北京00049)
用于检测细胞中亚硝酰氢的近红外荧光探针及其生物应用
刘萍1韩潇玥1,2于法标*1陈令新*11(中国科学院海岸带环境过程与生态修复重点实验室,山东省海岸带环境工程技术研究中心,中国科学院烟台海岸带研究所,烟台264003)
2(中国科学院大学,北京100049)
亚硝酰氢(HNO)是NO的单电子质子化还原产物。在治疗心血管疾病中,HNO与NO起不同的药理活性。针对HNO活性高,难以实时检测的问题,本实验设计合成了一种新型不含金属离子的近红外荧光探针ER-JN,用于实时检测模拟生理条件下和活细胞内HNO浓度的变化。此探针由荧光团氮杂氟硼吡咯(Aza-BODIPY)和HNO的识别基团三苯基膦两部分组成。探针采用硅胶柱层析分离,洗脱剂为二氯甲烷。产品为墨绿色晶体,产率为28%。此探针具有灵敏性高、选择性强、细胞毒性低等优点,可用于定量检测模拟生理条件下HNO的浓度。检测前后探针的量子产量从0.01增加到0.35。线性范围为0~50μmol/L,探针的检出限(S/N=3)是0.03μmol/L。激光扫描共聚焦显微镜成像分析表明,此探针可以用于可视化检测活细胞内HNO浓度的变化。流式细胞分析的结果显示ER-JN能定性和定量检测细胞内HNO的水平。实验结论表明,探针ER-JN不仅能够检测溶液中的HNO,还能定位于细胞内质网,检测细胞中HNO的变化。可为研究亚细胞、细胞、器官乃及活体中HNO的生理病理功能提供重要的实验依据。
荧光探针;亚硝酰氢;细胞分析;近红外成像
1 引 言
亚硝酰氢(Nitroxyl,HNO)是一氧化氮(NO)的单电子还原并质子化的衍生物。其所具有的生物和药理作用特征与NO迥然不同。由于其潜在的生物药理活性,近年来引起了广泛关注。HNO与心绞痛、急性高血压、动脉粥样硬化等众多心血管疾病有着紧密的关系[1]。有报导证实,在体内外实验中, Angeli′s盐(HNO供体)是强效的血管舒张剂,它能引起离体大动脉、小阻力动脉及完整的冠状动脉舒张[2,3]。另外,在心肌收缩功能方面HNO与NO所起的药理作用也不同,HNO以心肌肌浆的兰尼碱受体为靶点增强心肌收缩[4]。该药理特性为应对心力衰竭提供了一种潜在的治疗方案,并可有效避免硝酸甘油耐受性的问题。尽管越来越多的证据表明了HNO生物药理作用的重要性,然而由于HNO活性高,在生物体环境中极易脱水发生不可逆的二聚化反应生成N2O[1,2,5],使得对细胞內源性HNO作用机制的研究因缺乏有效的检测手段而无法顺利开展。
传统的检测HNO的方法主要有电化学法、电子自旋共振波谱法、化学发光法和比色法等[6,7]。与这些方法相比,荧光探针法不仅具有灵敏度高、操作简单、选择性好、非侵入性等特点,还能对检测对象在原位进行实时监控和观察[8,9]。因此,设计合成能特异性响应HNO的荧光探针凸显重要。目前,检测亚硝酰氢的探针较少,且主要基于铜络合物[10~12]。该类含金属内核的荧光探针易受到细胞内源性还原物种,例如谷胱甘肽和抗坏血酸等的干扰;而且所报道探针的荧光发射大多集中在紫外-可见区域,因为许多生物体及其组织在紫外-可见光的激发下会发射生物背景荧光,会严重干扰生物样品的荧光检测,严重影响了荧光分析的灵敏度和精确性。而近红外荧光探针的最大吸收波长和发射波长位于650~900 nm光区。该光区可有效避免生物背景荧光干扰,使探针能够获得较高的信噪比,并降低生物样品的光损伤[13,14]。本研究组一直致力于开发用于检测活性氮物种、活性硫物种和活性氧物种的荧光探针[13~19]。最近报道了用于检测HNO的荧光探针Lyso-JN和Cyto-JN[20,21],并将其应用于活细胞内HNO水平变化检测,及小鼠体内HNO的荧光成像分析。在此基础上,本研究合成了新的ER-JN荧光探针,并用于定性和定量检测活细胞内的HNO。
2 实验部分
2.1 仪器与试剂
PH-3C型酸度计(上海雷磁公司);RF-5301PC型荧光分光光度计(岛津公司);NanoDrop 2000/2000C型紫外可见分光光度计(Thermo Scientifisher公司);XS105型分析天平(Mettler Toledo公司);Cascade-bio型超纯水系统(Pall公司);AVANCE IIITM 500型核磁共振仪(Bruker公司);FluoView FV1000型激光共聚焦显微镜(Olympus公司);流式细胞仪(BD);小动物活体成像系统(Bruker公司);RAW264.7细胞(中国科学院细胞库);DMEM培养基,胰酶(Gibco公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Sigma公司);实验用水为二次纯水;其它试剂均为市售产品(上海国药集团)。
2.2 探针ER-JN的合成
探针ER-JN合成路线如图1所示。Aza-BODIPY荧光团(52.9 mg,0.1 mmol)、2-(二苯基膦)苯甲酸(61.2 mg,0.2 mmol)、4-二甲氨基吡啶DMAP(24.4 mg,0.2 mmol)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI,19.2 mg,0.1 mmol)溶于25 mL经过干燥二氯甲烷中,常温下搅拌24 h,氩气保护,TLC追踪反应进程。粗产品由NaBr的饱和溶液洗涤至中性,二氯甲烷萃取,蒸干有机相。残余物采用硅胶柱层析分离,洗脱剂为二氯甲烷。产品为墨绿色晶体,产率为28%。1H NMR(500 MHz, DMSO-D6)δ(ppm):8.31~8.01(m,1H),7.53~7.40(m,6H),7.25~7.23(m,23H),7.16(m, 2H),6.98~6.94(m,2H),4.05(m,2H),1.98(m,2H),1.26~0.98(m,37H),13C NMR (125 MHz,DMSO-D6)δ(ppm):165.02,162.82,157.01,152.12,137.63,137.54,134.31,134.14, 133.97,133.63,131.84,131.66,131.00,129.96,129.77,129.63,129.52,125.39,129.31, 129.26,129.21,129.16,122.40,121.27,116.72,60.22,30.01,21.02,14.55.31PNMR(200 MHz, CDCl3-D)δ(ppm):-4.05.LC-MS(ESI-):C71H75BF2N3O3P calcd.1097.56 found 1097.57。

图1 探针分子ER-JN合成路线Fig.1 The synthetic steps for probe ER-JNAzo-BOTIPY:A BF2-chelated tetraarylazadipyrromethane fluorophore.
2.3 探针ER-JN光谱分析
将Tween 80(10%,0.4 mL)加入到10.0 mL比色管中,用HEPES缓冲液(10mmol/L,pH=7.4)稀释到近10.0 mL,然后加入不同浓度的AS(全文以HNO为代表)。最后加入探针ER-JN。将混合液平衡20min后以待测定。紫外-可见吸收光谱在NanoDrop 2000/2000C紫外-可见分光光度计上进行测定。用荧光分光光度计测定荧光光谱。
2.4 细胞培养
小鼠巨噬细胞株(RAW264.7)细胞购自中国科学院生物化学和细胞生物学研究所细胞库,并按照说明进行培养。细胞培养基为含10% 胎牛血清的高糖Dulbecco′smodified Eagle′smedium(DMEM),细胞置于37℃通入5%CO2/95%空气的MCO-15AC培养箱(日本Sanyo公司)中,细胞达到融合状态时,PBS缓冲液洗涤两遍后,0.25%胰酶消化传代。
2.5 细胞毒性实验
RAW264.7细胞培养在含有10%胎牛血清的DMEM中,并置于37℃的通入5%CO2/95%空气的MCO-15AC培养箱中。密度为8000/孔的RAW264.7细胞接种到96-孔板中并培养24 h。随后,分别用浓度0.1~100μmol/L的探针孵育RAW264.7细胞24 h。然后在每个孔中分别加入MTT(Sigma公司)溶液(5.0mg/mL,20μL),在37°C下培养4 h,然后将96-孔板中MTT溶液去除,每个孔加入150μL二甲基亚砜(DMSO),溶解蓝紫色甲瓒(Formazan)晶体。最后将96-孔板放置在微孔板读数器上,振荡10min,用酶联免疫检测仪OD在490 nm处测量各孔的吸光值。
2.6 激光共聚焦显微镜成像
细胞培养皿中充满1 mL新鲜的DMEM培养基,依次加入细胞核染料Hoechst33342(1μg/mL),细胞内质网定位染料DiOC6(3)(3,3′-Dihexyloxacarbocyanine iodide,0.1μmol/L),探针ER-JN(DMSO, 1μmol/L)和HNO(200μmol/L)在细胞培养箱中37℃条件下分别孵育相应的时间。在细胞成像之前,除去培养基,然后用DMEM洗涤细胞3次,除去过多探针等。用激光共聚焦显微镜进行细胞成像(×60)。
2.7 流式细胞仪检测
取对数生长期的RAW264.7细胞,30万个/孔,种于六孔板,置37℃、5%CO2培养箱孵育24~48 h,加入5μmol/L ER-JN孵育15min后,分别加入200μmol/L AS,孵育10和20min,将细胞消化收集到流式管中,用DMEM洗涤两次后,PBS重悬,流式细胞仪(BD Aria)检测,激发波长633 nm,收集波长750~810 nm。
3 结果与讨论
3.1 探针ER-JN的设计
设计合成了一种用于检测HNO的近红外荧光探针ER-JN。该探针可定位于细胞内质网(Endoplasmic reticulum,ER)。如图2所示,荧光探针ER-JN由3部分组成:荧光团Aza-BODIPY、识别单元三苯基膦基团、内质网定位烷基链。荧光团Aza-BODIPY的激发和发射区均位于近红外区。作为HNO的识别单元的三苯基膦基团可与HNO反应生成氮叶立德中间体,氮叶立德继而与分子内合适位置的酯基发生亲核反应形成一个酰胺,脱去后释放出荧光团Aza-BODIPY,使荧光团恢复发射荧光[20,21]。长链脂溶性烷基则具有典型的内质网定位功能。实验结果表明,荧光探针ER-JN可以成功用于检测活细胞内质网的HNO浓度变化。
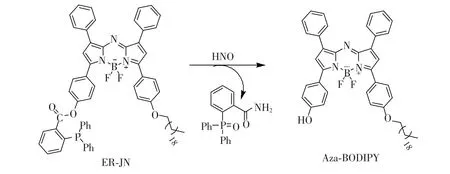
图2 探针ER-JN检测HNO的建议机理Fig.2 Proposed reaction mechanism for HNO detection
3.2 探针光谱特性研究
模拟生理条件下(10mmol/L HEPES缓冲液,pH 7.4,0.5%吐温80)对探针ER-JN的光谱特性进行考察。如图3a所示,探针ER-JN(5μmol/L)最大吸收波长为675 nm(ε=5.2×104mol/L·cm),当加入50μmol/L AS后,675 nm处吸收峰消失,707 nm处出现一个新的吸收峰 (ε=6.9× 104mol/L·cm),表明探针和AS发生反应导致酯键断裂,释放出荧光团Aza-BODIPY。为了评估ER-JN在模拟生理条件下测定HNO浓度的能力,实验选择690nm作为荧光激发波长。向缓冲溶液中添加AS,当HNO的浓度从0增加到50μmol/L时,ER-JN的荧光强度不断增强,相应的荧光最大值在710nm处,量子产量从0.01增加到0.35。此外,当AS浓度在0~50μmol/L之间时,其与荧光强度之间呈良好的线性关系(见图4),线性回归方程是F710nm=6.3CHNO(μmol/L)+39.7(r=0.9981)。探针的检出限(S/N=3)是0.03μmol/L,表明ER-JN对HNO具有较高的灵敏度。结果表明,此探针的吸收和发射波长都在近红外区域,表明荧光探针ER-JN适用于细胞和活体内成像。
3.3 探针检测选择性研究

图3 加入50μmol/LHNO后,探针ER-JN吸收光谱的变化(a);加入0~50μmol/LHNO20min后,探针ER-JN(10μmol/L)的荧光发射光谱变化(b)Fig.3 a.UV-visabsorptionspectralofprobeER-JN(10μmol/L)beforeandafteradditionof50μmol/L HNO;b.FluorescencespectraofER-JN(10μmol/L)uponadditionofHNO(0-50μmol/L)for20min
为了验证ER-JN对HNO的特异性响应,针对生理相关活性氧、活性氮以及其它常见生理物种在溶液中对探针进行了测试。结果表明,在0,5,10,15 和20min后,ER-JN对HNO的荧光的响应超过其它生物相关物种,选择性良好(图5)。探针对谷胱甘肽、半胱氨酸以及其它还原性物质、活性氧物种、活性氮物种的荧光响应极为微弱。有研究表明,GSNO可与HNO发生相似反应,生成酰胺。如图5所示, GSNO能在20min内引发响应,做出有限的荧光响应。然而,其增加的荧光强度远弱于HNO所引起的荧光变化。以上实验结果表明,ER-JN对HNO的选择性明显优于GSNO。与此同时,作为AS的另一分解产物,探针ER-JN对其的前后荧光响应没有显著的差异。因此,在竞争实验中,探针ER-JN对于HNO的识别几乎不受其它生物相关物种的干扰,也就是探针ER-JN表现出对HNO良好的专一性。
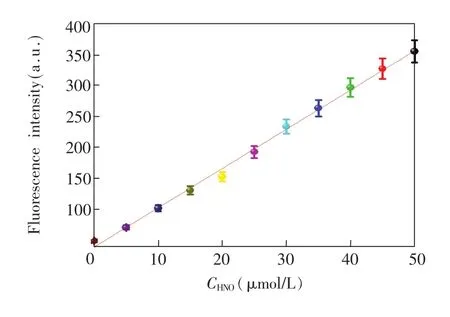
图4 HNO浓度(0~50μmol/L)和波长710nm处的荧光强度之间的线性关系Fig.4 Linearrelationshipbetweenfluorescentintensity at710nmandAngeli′ssalt(AS)(0-50μmol/L)in buffersolution
3.4 探针的细胞毒性研究
低细胞毒性是探针能够应用于活细胞检测的一个重要标准。因此,MTT实验选用RAW264.7细胞为细胞模型进行了测试,以便对此探针的细胞毒性做出评价。检测结果如图6所示,探针的浓度在(0.1~100μmol/L)递增,细胞的24h成活率均大于90%。此探针具有良好的生物兼容性,能够很好地满足细胞实验要求,可用于活细胞内HNO的检测。
3.5 细胞成像
基于探针ER-JN对HNO的检测具有高选择性和高灵敏度等特点,将此探针应用于细胞检测中,利用激光扫描共聚焦显微镜对细胞内HNO的变化进行荧光成像分析。细胞用1μmol/LER-JN孵育15min后,DMEM洗涤去掉过量的探针,细胞呈现微弱的荧光(图7a)。向此细胞体系中加入200μmol/L HNO作用10min后,荧光强度明显增强(图7b),随着时间的推移,细胞发出越来越强的荧光(图7c)。以上结果表明,探针ER-JN能够用于检测细胞内HNO浓度的变化。利用细胞内质网染料DiOC6(3)(3,3′-dihexyloxacarbocyanine iodide)和细胞核染料Hoechst 33342研究探针在RAW264.7中的亚细胞定位。通过细胞复染图可以看出探针与DiOC6(3)的荧光重合度较大,而与细胞核染料Hoechst 33342的荧光几乎没有重合。因此,探针ER-JN具有良好的亚细胞定位功能,可用于活细胞中HNO的荧光检测。探针在细胞中主要定位于细胞内质网。
3.6 流式细胞仪检测
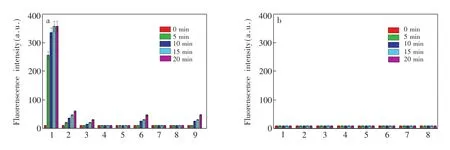
图5 10μmol/L ER-JN对HNO和其他相关物种随时间变化的荧光响应Fig.5 Fluorescence responses of10μmol/L ER-JN to testing species in 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid(HEPES)buffer solution(a)1,50μmol/L HNO;2,20μmol/L S-nitrosoglutathione(GSNO);3,200μmol/L Peroxynitrite(ONOO-);4,50μmol/L 3-(Aminopropyl)-1-hydroxy-3-isopropyl-2-oxo-1-triazene(NOC-5);5,500μmol/L;6,200μmol/L H2O2;7,100μmol/L;8,20μmol/L Methyl linoleate hydroperoxide(MeLOOH);9,200μmol/L ClO-.(b)1,50μmol/L半胱氨酸(L-Cysteine, Cys);2,100μmol/L谷胱甘肽(Glutathione,GSH);3,500μmol/L NaHS;4,200μmol/L抗坏血酸(L-Ascorbic acid,Vc);5,200μmol/L生育酚(Tocopherol,VE);6,100μmol/L柠檬酸盐(Citrate);7,200μmol/L络氨酸(Tyrosine,Tyr);8,50μmol/L羟胺(Hydroxylamine,HA)。

图6 探针ER-JN对RAW264.7细胞的毒性实验。细胞用0.1~100μmol/L的探针孵育24 h。数据代表平均值±标准差,每组设3个平行实验Fig.6 Cell viabilities of ER-JN against RAW264.7 cells.Cells were treated with 0.1-100μmol/L of ER-JN for 24 h.Data were expressed as the means±SD of data obtained from triplicate experiment
激光扫描共聚焦显微镜分析视野中相对少的细胞,而流式细胞仪能够快速检测上百万的细胞,得到更可信的结果。为了进一步验证图7中的实验结果,采用流式细胞技术分析HNO引起的细胞内荧光变化。图8中X轴代表荧光强度,Y轴代表细胞数目。细胞分成4组:(a)对照组;(b)加探针对照组;(c)探针加200μmol/L HNO孵育10min组;(d)探针加200μmol/L HNO孵育10min组。如图8所示,对照组a和b几乎没有显示出荧光。c组荧光有所增强,而d组荧光有了更明显的增强。上述实验结果与图7中荧光成像分析结果的趋势一致。上述结果表明,探针ER-JN能够定性和定量地检测细胞内HNO的浓度变化。
4 结论
本实验设计合成了一种用于检测细胞内HNO浓度变化的近红外荧光探针ER-JN。此探针采用Aza-BODIPY为荧光团,三苯基膦为HNO的响应基团。此探针对HNO具有明显的荧光“开启”功能。此探针具有选择性好、灵敏度高和细胞毒性底等优点。除此之外,探针不仅能够检测溶液中的HNO,还能定位于细胞内质网,检测细胞中HNO浓度的变化。此探针对于研究亚细胞、细胞、器官乃及活体中HNO的生理病理功能具有重要的意义和实用价值。
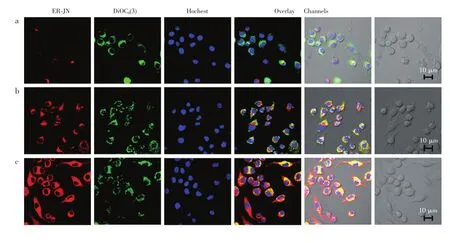
图7 探针ER-JN检测RAW264.7细胞中HNO的激光共聚焦成像分析。(a)细胞体系中加入探针ER-JN(1μmol/L)孵育15min;(b)和(c)细胞同上述a处理过后分别加入200μmol/L HNO孵育10和20min后的荧光成像;各组中:细胞内质网染料DiOC6(3)的荧光成像;细胞核染料Hoechst 33342的荧光成像;3个荧光通道ER-JN、DiOC6(3)、Hochest33342的叠加图像;3个荧光通道场叠加成像。红色通道:ER-JN激发波长690 nm,荧光收集波段700~800 nm;绿色通道:DiOC6激发波长488 nm,荧光收集波段560~600 nm;蓝色通道:Hochest33342激发波长405 nm,收集波长420~480 nmFig.7 Confocal fluorescence images of HNO in RAW 264.7 cells with ER-JN.(a)Cells loaded with 1μmol/L probe for 15min.(b)and(c)Cells treated with 200μmol/L HNO for 10 and 20min, respectively;In each group: ER-JN bioimage from red channel. 3,3′-dihexyloxacarbocyanineiodide (DiOC6)(3)bio-image from green channel.Hochest 33342 bioimage from blue channel.Overlay of red channel,green channel and blue channel,and overlay of red channel,green channel,blue channel and bright field.Red channel:λex=690 nm,λem=700-800 nm;Green channel:λex=488 nm,λem=560-600 nm;Blue channel:λex=405 nm,λem=420-480 nm

图8 探针ER-JN检测RAW264.7细胞中HNO变化的流式细胞分析。(a)对照组;(b)加1μmol/L探针孵育15min后,细胞用DMEM洗3次;(c)细胞按照b)处理后,加200μmol/L HNO孵育10min组;(d)细胞按照c)处理后的细胞,再加200μmol/L HNO孵育20minFig.8 Represent data of flow-cytometric analysis:(a)Control;(b)The cellswere incubated with 1μmol/L ER-JN for 15min,then washed with dulbecco′smodified eagle medixm(DMEM)three times to remove the overdose probe;(c)The cells were treated as described in(b),then incubated with 200μmol/L HNO for 10min;(d)The cellswere treated as described in(c),then exposed to another dosages of200μmol/LHNO for an additional 20min
References
1 Irvine JC,Ritchie R H,Favaloro JL,Andrews K L,Widdop R E,Kemp-Harper B K.Trends Pharmacol.Sci.,2008, 29(12):601-608
2 Paolocci N,Jackson M I,Lopez B E,Miranda K,TocchettiCG,Wink D A,Hobbs A J,Fukuto JM.Pharmacol.Ther., 2007,113(2):442-458
3 Favaloro JL,Kemp-Harper B K.Cardiovasc.Res.,2007,73(3):587-596
4 Paolocci N,Saavedra W F,Miranda K M,Martignani C,Isoda T,Hare JM,Espey M G,Fukuto JM,Feelisch M,Wink D A.Proc.Natl.Acad.Sci.USA.,2001,98(18):10463-10468
5 Dutton A S,Fukuto JM,Houk K.J.Am.Chem.Soc.,2004,126(12):3795-3800
6 Malinski T,Taha Z.Nature,1992,358(6388):676-678
7 Nagano T,Yoshimura T.Chem.Rev.,2002,102(4):1235-1270
8 Li X,Gao X,ShiW,Ma H.Chem.Rev.,2014,114(1):590-596
9 Wang R,Yu C,Yu F,Chen L.TrAC.Trends Anal.Chem.,2010,29:1004-1013
10 Wrobel A T,Johnstone T C,Deliz L A,Lippard S J,Rivera-Fuentes P.J.Am.Chem.Soc.,2014,136(12):4697-4705
11 McQuade L E,Lippard S J.Curr.Opin.Chem.Biol.,2010,14(1):43-49
12 Zhou Y,Liu K,Li J,Fang Y,Zhao T,Yao C.Org.Lett.,2011,13(6):1290-1293
13 Wang R,Yu F,Chen L,Chen H,Wang L,Zhang W.Chem.Commun.,2012,48(96):11757-11759
14 Wang R,Yu F,Liu,Chen L.Chem.Commun.,2012,48(43):5310-5312
15 JING Xiao-Tong,YU Fa-Biao,CHEN Ling-Xin.Process in Chemistry,2014,26(5):866-878
景晓彤,于法标,陈令新.化学进展,2014,26(5):866-878
16 GAO Min,YU Fa-Biao,CHEN Ling-Xin.Process in Chemistry,2014,26(6):1065-1078
高敏,于法标,陈令新.化学进展,2015,87(7):3631-3638
17 Wang R,Chen L,Liu P,Zhang Q,Wang Y Q.Chem.Eur.J.,2012,18(36):11343-11349
18 Gao M,Yu F,Chen H,Chen L.Anal.Chem.,2015,87(7):3631-3638
19 Gao M,Wang R,Yu F,You J,Chen L.Analyst,2015,140(11):3766-3772
20 Jing X,Yu F,Chen L.Chem.Commun.,2014,50(91):14253-14256
21 Liu P,Jing X,Yu F,Lv C,Chen L.Analyst,2015,140(13):4576-4583
(Received 28 May 2015;accepted 21 August2015)
This work was supported by the National Natural Science Foundation of China(Nos.21405172,21575159,21275158 )
A Near-Infrared Fluorescent Probe for Detection of Nitroxyl in Living Cells
LIU Ping1,HAN Xiao-Yue1,2,YU Fa-Biao*1,CHEN Ling-Xin*11(Key Laboratory ofCoastal Environmental Processes and Ecological Remediation, The Research Centre for Coastal Environmental Engineering and Technology, Yantai Institute ofCoastal Zone Research,Chinese Academy of Sciences,Yantai264003,China)
2(University ofChinese Academy ofSciences,Beijing 100049,China)
Nitroxyl(HNO),the one-electron reduced and protonated congener of nitric oxide(NO),has been demonstrated with excellent bio-pharmacological effects in cardiovascular disorder treatment,which is distinctive from that of NO.The high reactivity of HNO challenges the accurate detection.To resolve this problem,a near-infrared(NIR)metal-free fluorescent probe,ER-JN,was developed for the detection of intracellular HNO concentration in simulated physiological conditions and living cells.The probewas consisted of two moieties,the A BF2-chelated tetraarylazadipyrromethane fluorophore(aza-BODIPY)and the HNO recognition unit,diphenylphosphinobenzoyl group.The probewas purified by column chromatography on silica eluting with CH2Cl2to give the product as a green solid with a yield of 28%.Our probe exhibited highsensitivity,good selectivity,and low cytotoxic effect,and could be applied to the fluorescent bio-imaging of HNO in simulated physiological conditions.When detected HNO,quantum yield increased from 0.01 to 0.35.The linear range located at 0-50μmol/L.The detection limit was 0.03μmol/L(S/N=3).With confocal laser scanning microscope imaging analysis,the probe could detect HNO concentration changes in living cells.Furthermore,the results of flow cytometry confirmed that our probe could be employed for the qualitative and quantitative detection of intracellular HNO concentration level.In this work,we found that probe ER-JN could not only detect HNO in aqueous and in living cells,but also targets endoplasmic reticulum.We anticipated that ER-JN would provide experimental bases in studying physiological and pathological functions of HNO in cells,in vitro and in vivo.
Fluorescent probe;Nitroxyl;Cell analysis;Near-infrared bioimaging
10.11895/j.issn.0253-3820.150445
2015-05-28收稿;2015-08-21接受
本文系国家自然科学基金资助项目(Nos.21405172,21575159,21275158)和中国科学院青年创新促进会(Grant2015170)
E-mail:fbyu@yic.ac.cn,lxchen@yic.ac.cn

