全国多中心细菌耐药监测网中血流感染相关金黄色葡萄球菌的分子流行病学研究
毛镭篥, 肖 盟, 王 贺, 赵 颖, 徐英春
·论著·
全国多中心细菌耐药监测网中血流感染相关金黄色葡萄球菌的分子流行病学研究
毛镭篥, 肖 盟, 王 贺, 赵 颖, 徐英春
目的首次研究全国多中心血流感染相关金黄色葡萄球菌(金葡菌)的分子流行病学特征。方法全国17省市34所医院共149株血流感染相关的金葡菌,分析杀白细胞毒素(pvl)基因,多位点序列分型(MLST)和spa分型(编码葡萄球菌A蛋白)及甲氧西林耐药金葡菌(MRSA)琼脂稀释法的药敏结果。结果受试菌计有71株MRSA和78株甲氧西林敏感金葡菌(MSSA)。pvl阳性株为11株,MRSA只占1株。MLST显示有23种不同的序列型(ST)结果,MRSA含6种ST分型,主要型别为ST239及ST5;MSSA有20种ST分型,但是各型别比例均不超过15%。spa分型共45种型别,MRSA含8种型别,优势型别为t030和t037;MSSA有38种型别,优势型别为t091和t189。MRSA对常用抗菌药物耐药率依次为环丙沙星91.18%,左氧氟沙星91.18%,红霉素76.47%,莫西沙星73.53%,克林霉素70.59%,利福平58.82%,甲氧苄啶-磺胺甲口恶唑17.65%;对利奈唑胺、万古霉素、去甲万古霉素、替考拉宁、替加环素等药物均100%敏感。结论血流感染相关MRSA传播的优势型别为ST239-t037和ST239-t030,并对多种抗菌药物存在不同程度耐药,需加强细菌耐药性监测。
金黄色葡萄球菌; Panton-Valentine杀白细胞素基因; 多位点序列分型; 葡萄球菌A蛋白分型; 多重聚合酶链反应; 药敏试验
随着近年来器官移植、骨髓移植及大量侵袭性诊治措施的开展,菌血症和败血症等血流感染不断增加。在引起血流感染的病原菌中,金黄色葡萄球菌(金葡菌)是临床分离的最常见细菌之一,既可以导致社区感染又可造成医院感染。特别是耐甲氧西林金葡菌(MRSA)常引起医院感染的暴发流行,严重威胁着人类的健康。MRSA血流感染患者病死率高达37.10%,显著高于甲氧西林敏感金葡菌(MSSA)血流感染病死率13.51%[1]。了解引起血流感染金葡菌的分子流行病学特征,建立血流感染监测系统,有利于积极预防和控制该菌引起的血流感染。
PV杀白细胞素(Panton-Valentine leukocidin,PVL)是金葡菌分泌的一种双组份异聚体打孔细胞溶解毒素,可通过细胞凋亡和细胞变性坏死等方式对人的多形核白细胞产生特异性的杀伤作用,是金葡菌的主要致病因子[2]。PVL有2个基因编码并且共同转录,即lukS-PV和lukF-PV(lukS/F-PV),由前噬菌体片段携带,并整合在金葡菌的染色体上[]。
MRSA的耐药机制主要是其产生了一种与β内酰胺 类亲和 力极 低的青 霉素结 合蛋 白 2a (PBP2a),此蛋白由mecA基因编码,该基因是独特的、可移动的遗传元件,称为葡萄球菌染色体盒(Staphylococcal Cassette Chromosome mec,SCCmec),即SCCmec。
多位点序列分型(multilocus sequence typing,MLST),是以7个相距一定距离,且基本覆盖整个染色体的管家基因arcc(编码氨基甲酸酯激酶)、aroe(编码苯草酸脱氢酶)、glpf(编码甘油激酶)、gmk(编码鸟甘酸激酶)、pta(编码磷酸转乙酰酶)、tpi(编码磷酸丙糖异构酶)、yqil(编码乙酰辅酶A乙酰转移酶)为基础的分析方法。这7个基因既相对保守,又可以允许局部碱基发生点突变,具有相对变化缓慢的突变累积效应,可以长期追踪菌株间遗传关系和宏观进化过程,结果以序列分型(sequence type,ST)表示。
葡萄球菌A蛋白(spa)是金葡菌细胞壁的组成部分,包括Fc结合区、X域和C末端3个区域。X区基因呈现多态性,含有可变数量的24 bp重复序列,重复序列两端为相对保守区域,利用这种基因的多态性建立的分型方法为spa分型[4]。spa分型是一种基于spa基因的X区重复序列具有多态性为基础的一种分析方法。该方法分辨率高,近年来广泛用于MRSA分子进化和医院暴发流行研究。
因此,本研究设计了多重PCR检测金葡菌的pvl、mecA、femA、16S rRNA,并且采用了MLST、spa分型等技术及药敏试验和回顾性病例资料研究综合分析了中国34所教学医院共149株金葡菌的流行病学特征。
1 材料与方法
1.1 材料
收集2007年SEANIR监测网全国5个省市6所医院(北京协和医院、北京医院、广州市第一人民医院、吉林省人民医院、江苏省人民医院、青岛医科大学附属医院)28株金葡菌,以及2009年10月—2010年3月全国17个省市33所医院(包括第四军医大学西京医院、北京协和医院、天津医科大学总医院、哈尔滨医科大学附属第一医院、哈尔滨医科大学附属第四医院、广西医科大学附一医院、陕西省人民医院、浙江大学医学院附属第一医院、北京市平谷医院、广州医科大学第一附属医院、广西桂林市人民医院、滨州医学院附属医院、青岛大学附属医院、吉林省人民医院、广州市红十字会医院、四川攀枝花医院、广西钦州第二医院、四川省人民医院、广州市第一人民医院、天津市公安医院、昆明医科大学第一附属医院,石河子医学院附院、合肥市一附院、盛京医院、新疆医科大学一附院、安徽医科大学一附院、农垦总局医院、汉中医院、武汉市第三医院、新疆自治区人民医院、同济医院、中国医科大学附一医院、海南医学院附院)中临床分离的金葡菌121株,共计149株。所有菌株均为连续分离的非重复株,同一患者只取第1次分离菌株。标本类型均为血液。
1.2 方法
1.2.1 细菌培养及鉴定 按常规方法分离细菌,血浆凝固酶试验为阳性,并且经由VITEK2 Compact全自动微生物鉴定药敏分析仪鉴定为金葡菌,质控菌株采用金葡菌ATCC25923。
1.2.2 总DNA提取 取血平皿上分纯后新鲜过夜4~6个单个菌落,混悬于0.4 mL含有50 u/mL溶葡萄球菌素(lysostaphin)的TE中(p H 8.0),37℃水浴30 min,95℃煮沸10 min,15 000 r/min离心20 s,将上清液转移到无菌微量离心管中,即为细菌总DNA溶液,-20℃保存备用。
1.2.3 多重PCR检测MRSA和pvl把4对16S r RNA、femA、mecA及lukS/F-PV引物放入同一反应体系建立多重PCR,参照文献[5]。16S rRNA是葡萄球菌属特异性的基因,femA是金葡菌特异基因,属于mecA的调节基因。PCR产物用含2.0%溴化乙锭的1.5%琼脂糖凝胶,在TBE缓冲液中,100V电泳75 min,用紫外凝胶成像系统观察结果。16S rRNA、femA、mecA及lukS/F-PV基因片段长度大小分别为597、450、293、151 bp。597和450 bp 2个条带的为MSSA,同时出现597、450和151 bp 3个条带为含pvl基因的MSSA,同时出现597、450和293 bp 3个条带为MRSA,4个条带均出现的为含pvl的MRSA。
1.2.4 MLST分型 7个管家基因(arcc、aroe、glp、gmk、pta、tpi、yqil)PCR所用的引物参照文献[6]。反应体系为25μL;上下游引物浓度均为0.4 pmol/μL,DNA模板为2μL。PCR产物片段长度分别为456、456、465、429、474、402、516 bp。PCR扩增产物送测序,测序结果与 MLST数据库(http;//www.mlst.net)上公布的相应基因的等位基因进行比较,获得每一管家基因的等位号码,综合所有的等位号码来确定序列型。
1.2.5spa分型 PCR扩增spa的X区,引物参照文献[7]设计。spa分型网(http;//www.ridom.de/spaserver/)上目前已公布465种重复序列和8 699个spa型别。PCR产物送测序,在测序结果中查找已公布的重复序列,根据串联重复序列出现的次数和排列方式确定型别。
1.2.6 药敏试验 琼脂稀释法检测MRSA对环丙沙星、左氧氟沙星、莫西沙星、红霉素、克林霉素、甲氧苄啶-磺胺甲口恶唑、利福平、万古霉素、去甲万古霉素、利奈唑胺、替考拉宁、替加环素的耐药性,质控菌株采用金葡菌ATCC29213和粪肠球菌ATCC29217。
1.2.7 统计学分析 采用SPSS软件对pvl阳性菌株在MRSA和MSSA中的携带率进行统计学分析,率的比较采用Fisher精确概率检验,P<0.05为差异有统计学意义。
2 结果
2.1 多重PCR检测16S r RNA、pvl、femA、mecA基因
149株金葡菌中共有71株MRSA,占临床分离株的47.7%,78株为MSSA,占52.3%。pvl阳性菌株为11株,占临床分离株的7.4%,MRSA中pvl阳性菌株为1株,携带率为1.4%,MSSA中pvl阳性菌株为10株,携带率为12.8%。采用Fisher精确概率检验比较pvl阳性菌株在MRSA和MSSA的分布情况,差异有统计学意义(P<0.05)。多重PCR检测16S rRNA、pvl、femA、mec A基因电泳结果见图1。

图1 多重PCR检测16S rRNA、pvl、femA、mecA基因Figure 1 Multiplex polymerase chain reaction for detection of 16S rRNA,pvl,femAandmecAgenes
2.2 MLST结果
MLST总计23种分型结果,71株MRSA含有6 种ST,包括ST239(81.7%),ST5(11.3%),ST45、ST59、ST72、ST338(各1.4%)。78株MSSA含有20 种ST,包括ST7(15.4%),ST5、ST188(各12.8%),ST88(11.5%),ST25(9.0%),ST398、ST59(各6.4%),ST6、ST72、ST630(各2.5%),ST1、ST8、ST9、ST12、ST15、ST20、ST30、ST95、ST97、ST121(各1.3%),新型ST(5.1%)。11株pvl阳性的金葡菌有5种ST结果,其中1株pvl阳性的MRSA其MLST型别为ST338,10株pvl阳性的MSSA中有4种ST;6株ST88,2株ST25,ST5、ST95各1株。见表1。
2.3spa分型结果
spa总计45种分型结果,71株MRSA含有7个型别,包括t030(53.5%),t037(25.3%),t002 (9.9%),t437(4.2%),t324、t570、t632(各1.4%)。78株MSSA含有37种型别,包括t091(11.5%),t189(10.3%),t002(8.9%),t034和t163(各5.1%),t796(3.8%),t011、t078、t148和t701、t2526(各2.6%),t081、t127、t1425、t1835、t1987、t213、t216、t227、t2310、t242、t2592、t2769、t280、t338、t359、t337、t393、t4016、t4047、t4333、t435、t502、t5229、t5635、t645、t6497(各1.3%),新型别spa7株(8.9%)。spa基因重复序列数为4~11个,其中MRSA的spa基因重复序列数为6~10个,MSSA的spa基因重复序列数为4~11个。见表2。
血流感染相关的MRSA对常用抗菌药物耐药率依次为环丙沙星91.18%,左氧氟沙星91.18%,
红霉素76.47%,莫西沙星73.53%,克林霉素70.59%,利福平58.82%,甲氧苄啶-磺胺甲口恶唑17.65%;对利奈唑胺、万古霉素、去甲万古霉素、替考拉宁、替加环素等药物均100%敏感,见表3。同时发现分子分型结果与药敏结果显示出较好的相关性。如优势型别ST239-t037的MRSA药敏谱为环丙沙星、左氧氟沙星、红霉素、克林霉素均耐药,莫西沙星和甲氧苄啶-磺胺甲口恶唑的耐药率均为83.3%。次要型别ST239-t030的MRSA药敏谱为环丙沙星、左氧氟沙星均耐药,莫西沙星、红霉素和克林霉素的耐药率分别为88.89%、55.56%和55.56%,而对甲氧苄啶-磺胺甲口恶唑均敏感,此结果与优势型别ST239-t037差异较大。另外,次要型别ST5-t002的MRSA药敏谱为环丙沙星、左氧氟沙星、红霉素、克林霉素均耐药,而莫西沙星的耐药率为66.67%,对利福平、甲氧苄啶-磺胺甲口恶唑完全敏感。

表1 71株MRSA的MLST和spa分型结果Table1 The results of multilocus sequence typing and spa typing for 71 methicillin-resistant S.aureus isolates
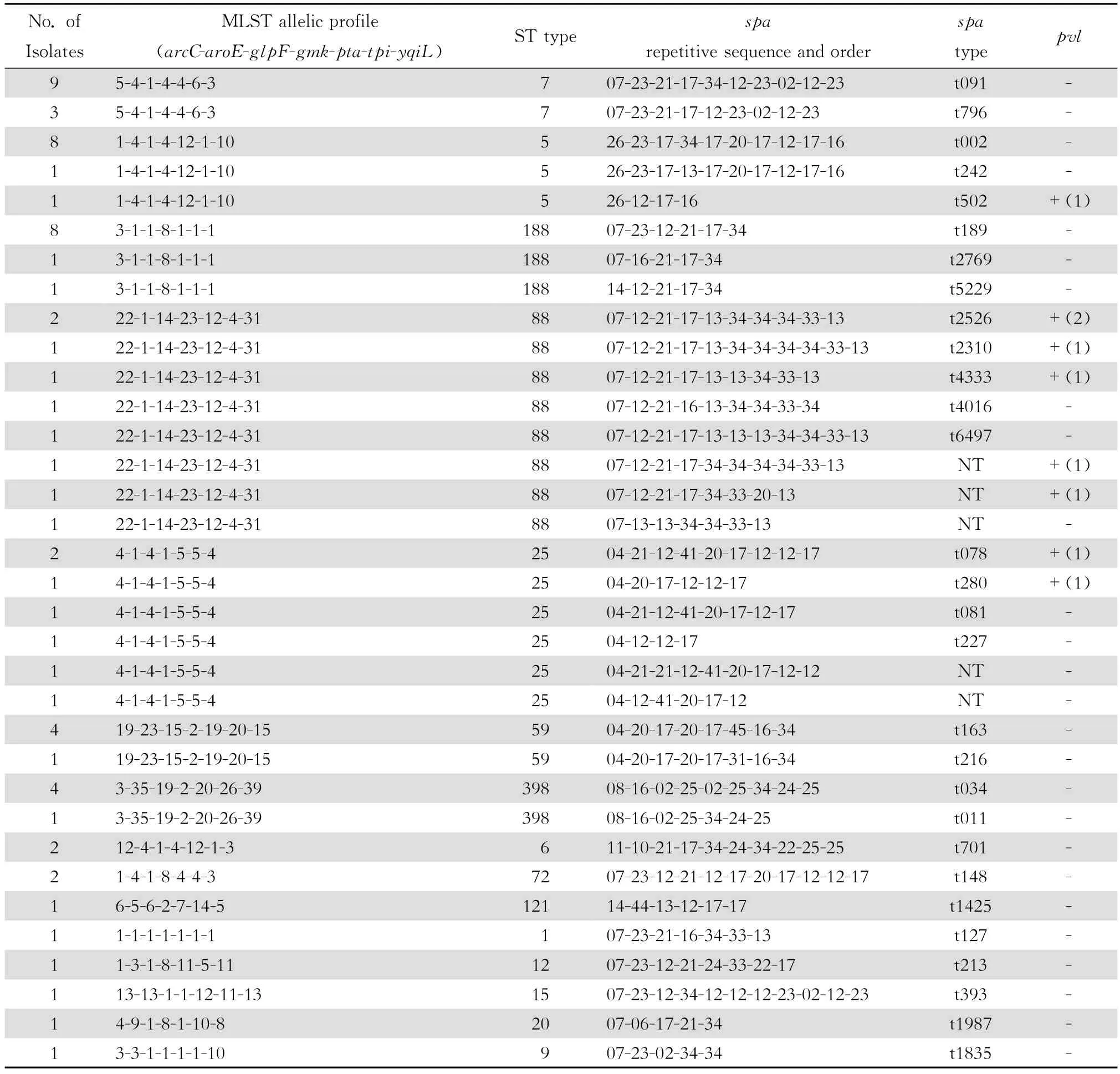
表2 78株MSSA的MLST和spa分型结果Table2 The results of multilocus sequence typing and spa typing for 78 methicillin-susceptible S.aureus isolates

continued table2

表3 血流感染相关MRSA对抗菌药物的耐药率和敏感率Table3 Susceptibility of the methicillin-resistant S.aureus strains associated with bloodstream infection to antimicrobial agents (%)
3 讨论
菌血症和败血症是临床上严重的全身性感染,病情复杂多变,进展迅速,病死率较高。金葡菌是临床上血流感染的常见病原菌。文献报道,临床血流感染MRSA的病死率高于MSSA[1]。
1999年,美国疾病预防控制中心报道4例儿童患者死于pvl基因阳性的金葡菌引起的脓毒症,其中3例合并坏死性肺炎和(或)脓胸,由此引起了高度重视[8]。近年来由产PVL金葡菌所致感染而导致的死亡病例增多。国内少见有pvl阳性的金葡菌感染的致死性报道,可能与实验室pvl基因检测水平及普及程度有关。本研究的149株临床分离的致血流感染金葡菌中,pvl基因阳性率为7.3%,71株MRSA中pvl阳性菌株为1株,携带率为1.4%,78 株MSSA中pvl阳性菌株为11株,携带率为12.8%。两者的pvl携带率的差异有统计学意义。临床资料表明;11株pvl阳性所致血流感染的临床患者见于红斑狼疮、颈部软组织感染、甲状腺功能亢进性皮肤病、急性淋巴细胞性白血病、眼蜂窝组织炎、结缔组织炎、脓毒血症、慢性阻塞性肺疾病(慢阻肺)以及发热等疾病。其中,pvl基因阳性的MRSA所致血流感染的患者为红斑狼疮。这株菌可能是社区获得性的MRSA,但因缺乏足够多的临床资料,未能区别其是社区获得性的还是医院获得性的。MRSA的pvl阳性率较低,可能与菌株来源有一定关系,一是患者主要是医院获得性的血流感染;二是标本均来源于血液。而有文献指出;携带pvl基因的MRSA多为社区获得性,社区获得MRSA的pvl携带率高达70%~100%[2],且多分离自皮肤、软组织的化脓性感染以及严重的肺部感染。本研究发现,MSSA的pvl检出率明显高于MRSA,可见MSSA虽然耐药性低,但其致病性应提醒临床医师关注。
MLST是一种分辨力较高的分型方法,能在不同实验室、地区甚至国家之间进行对比,主要用来研究群体生物性和长期大范围、全球性的流行病学调查研究[9]。如不同国家和地区的MRSA菌株的传播情况。同时MLST技术操作简便,实验数据通过网络数据库易于在实验室间比较。但该方法在针对金葡菌的医院感染方面显得分辨力不够,这是由于在同一地区的菌株其序列型通常都只有较低的多态性。如本研究结果所示,71株MRSA中有58株的等位基因谱均为2-3-1-1-4-4-3,其序列型为ST239,该序列是目前中国内地、中国香港和中国台湾地区最为流行和常见的序列型,并流行于除日本和韩国以外的大多数亚洲国家,包括新加坡、印尼、泰国等[8]。78株MSSA含有20种ST。可见,MSSA虽然与MRSA有3个共同的ST型别,但其分型散在,更具有多样性,与MRSA存在着巨大差异,未见明显优势克隆型。结果提示;多重耐药性的 MRSA更容易在医院内克隆传播。
spa分型是基于单碱基序列分析为基础的分型方法,具有许多优点,如快速、易于操作、重复性好等。本研究发现spa分型显然比MLST法具有更高的分辨率,可以进一步区分相同的ST型别,更适用于金葡菌感染的常规调查。本研究中MRSA菌株主要型别为t030。有文献报道,2000年以前,MRSA的spa型别以t037为主,2000年开始出现少量t030克隆,2002年t030成为优势克隆,此后t030克隆一直为流行克隆[10],与本研究结果一致。78株MSSA含有38种型别,与MRSA只有一种共同的型别,两者明显存在巨大差异。
琼脂稀释法药敏试验结果表明,血流感染相关MRSA虽对利奈唑胺、替加环素、替考拉宁、万古霉素、去甲万古霉素敏感,但对其他多种抗菌药物的耐药性较高,显示出多重耐药性。即使体外药敏试验显示对某些头孢菌素和氨基糖苷类药物敏感,但临床治疗也往往失败。多耐药MRSA还常引起医院感染暴发和流行,并延长患者住院时间、增加治疗费用[11]。因此,为争取早期治疗、及时控制感染、改善预后,依据药敏实验结果,优化选择抗菌药物进行有效治疗尤为重要。
[1] Laupland KB,Ross T,Gregson DB.Staphylococcus aureusbloodstream infections;risk factors,outcomes,and the influence of methicillin resistance in Calgary.Canada,2000-2006[J].Clin Infect Dis,2008,198(3);336-343.
[2] Naas T,Fortineau N,Spicq C,et al.Three-year survey of community-acquired methicillin-resistantStaphylococcus aureusproducing Panton-Valentine leukocidin in a French university hospital[J].J Hosp Infect,2005,61(4);321-329.
[3] Mc Clure JA,Conly JM,Lau V,et al.Novel multiplex PCR assay for detection of the staphylococcal virulence marker Panton-Valentine leukocidin genes and simultaneous discrimination of methicillin-susceptible from-resistant staphylococci[J].J Clin Microbiol,2006,44(3);1141-1144.
[4] Shopsin B,Gomez M,Montgomery SO,et al.Evaluation of protein A gene polymorphic region DNA sequencing for typing ofStaphylococcus aureusstrains[J].J Clin Microbiol,1999,37(11);3356-3563.
[5] Al-Talib H,Yean CY,Al-Khateeb A,et al.A pentaplex PCR assay for the rapid detection of methicillin-resistantStaphylococcus aureusand Panton-Valentine Leucocidin[J].BMC Microbiol,2009,9(1);113.
[6] Enright MC,Day NP,Davies CE,et al.Multilocus sequence typing for characterization of methicillin-resistant and methicillin-susceptible clones ofStaphylococcus aureus[J].J Clin Microbiol,2000,38(3);1008-1015.
[7] Strommenger B,Kettlitz C,Weniger T,et al.Assignment ofStaphylococcusisolates to groups byspatyping,SmaI macro restriction analysis,and multilocus sequence typing[J].J Clin Microbiol,2006,44(7);2533-2540.
[8] Centers for Disease Control and Prevention(CDC).Four pediatric deaths from community-acquired methicillinresistantStaphylococcus aureus;Minnesota and North Dakota,1997-1999[J].Morb Mortal Wkly Rep,1999,48 (32);707-710.
[9] Chongtrakool P,Ito T,Ma XX,et al.Staphylococcal cassette Chromosome mec(SCCmec)typing of methicillin-resistantStaphylococcus aureusstrains isolated in 11 Asian countries;a proposal for a new nomenclature for SCCmec elements[J].Antimicrob Agents Chemother,2006,50(3);1001-1012.
[10] Chen H,Liu Y,Jiang X,et al.Rapid change of methicillinresistantStaphylococcus aureusclones in a Chinese tertiary care hospital over a 15-Year period[J].Antimicrob Agents Chemother,2010,54(5);1842-1847.
[11] Kilgore M,Brossette S.Cost of bloodstream infections[J].Am J Infect Control,2008,36(10);s172.el-s172.e3.
Molecular epidemiology of Staphylococcus aureus associated with bloodstream infection in China;a national multi-center study
MAO Leili,XIAO Meng,WANG He,ZHAO Ying,XU Yingchun.(Department of Clinical Laboratory,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences,Beijing 100730,China)
;ObjectiveTo investigate the molecular epidemiology ofS.aureusassociated with bloodstream infection collected from a national multi-center study in China for the first time.MethodsOne hundred and forty-nineS.aureusisolates associated with bloodstream infection were collected from 34 hospitals in 17 provinces.Thepvlgenes,multilocus sequence typing (MLST),andspatyping were studied.Meanwhile,the susceptibility of MRSA to antibiotics was analyzed.ResultsOverall,71 MRSA isolates and 78 MSSA isolates were identified.Eleven isolates were positive forlukS/F-PVgenes,but only one MRSA strain.MLST revealed 23 different sequence types(STs)among all isolates.MRSA isolates contained 6 STs,the predominant STs were ST239 and ST5.MSSA isolates included 20 STs.Any one ST was accounted for 15%or more.A total of 45spatypes were identified.MRSA isolates covered 8spatypes.The predominantspatypes were t030 and t037.MSSA isolates included 38spatypes.The predominantspatypes were t091 and t189.The MRSA strains were highly resistant to commonly used antibiotics,specifically ciprofloxacin(91.18%resistant),levofloxacin(91.18%),erythromycin(76.47%),moxifloxacin(73.53%),clindamycin(70.59%),rifampicin(58.82%),and trimethoprim-sulfamethoxazole(17.65%).All the MRSA strains were susceptible to linezolid,vancomycin,norvancomycin,teicoplanin,and tigecycline.ConclusionsThe strains identified as ST239-t037 and ST239-t030 types are the prevalent MRSA clones associated with bloodstream infection.MRSA strains were highly resistant to most antibiotics.Antimicrobial resistance surveillance should be strengthened.
;Staphylococcusaureus; PVL gene; multilocus sequence typing;spatyping; multiplex polymerase chain reaction; antimicrobial susceptibility testing
R378.11
A
1009-7708(2015)02-0120-06
2014-03-20
2004-08-25
卫生部公益行业基金(201002021)。
北京协和医院检验科,北京 100730。
毛镭篥(1989—),女,医学学士,初级检验技师,主要从事金黄色葡萄球菌的分子流行病学研究。
徐英春,E-mail;xycpumch®139.com.cn。

