猪全腹腔脏器整体移植术中缺血再灌注损伤的防治
陈 炜,冯春林,黄桂华,冷 凯,主鹤亭
(遵义医学院第三附属医院:1.肝胆外科;2.麻醉科,贵州遵义 563000)
·经验交流·
猪全腹腔脏器整体移植术中缺血再灌注损伤的防治
陈 炜1,冯春林1,黄桂华2,冷 凯1,主鹤亭1
(遵义医学院第三附属医院:1.肝胆外科;2.麻醉科,贵州遵义 563000)
目的探索猪全腹腔脏器整体移植动物实验模型术中缺血再灌注损伤的防治策略。方法将16头健康家猪,随机分为供、受体两组,将供体腹腔全部脏器移植入受体腹腔内。供体开始灌注之前,预阻断腹主动脉2个循环,阻断10 min/再灌注10 min;受体再灌注之初,采用短暂重复缺血-再灌注处理,再灌注60 s/阻断60 s,共6次循环;尽量缩短热缺血和冷缺血的时间;开放血流时先在植入脏器内注满羟乙基淀粉130/0.4氯化钠注射液。结果实验初期5例受体在术中死亡,通过病理证实,死亡原因与缺血再灌注损伤相关,通过上述措施,以及不断总结和完善,减轻缺血再灌注损伤及巨大血流动力学变化对实验的影响,3例实验完成了手术操作,获得成功。结论大型猪全腹腔脏器整体移植手术过程中缺血再灌注损伤,是导致受体死亡的主要原因之一,重视缺血预处理,缺血后处理,尽量缩短热缺血和冷缺血的时间,合理应用药物,是防止和减轻缺血再灌注损伤的关键点。
缺血再灌注损伤;器官移植;猪
全腹腔脏器整体移植(multivisceral transplantation MVTX)是指肝脏、胃、胰十二指肠复合体及小肠的串联移植,所有的移植器官悬吊于一个由腹腔动脉干、肠系膜上动脉及相应的门静脉引流通道组成的中心主干上,作为一个单元整体植入受体腹腔中。
自美国Starzl教授于1960年首先用狗成功进行了MVTX动物实验以来,MVTX在全世界一些著名的移植中心已经被逐渐应用于临床[1],我国于2005、2012年也分别报道了2例MVTX,但患者均在短时间内死亡。高排斥率、感染和手术并发症仍然在阻止MVTX的发展[2]。所以,开展猪MVTX,建立一个理想的实验模型,能够为临床MVTX探索更多有益的经验,提供更多的理论依据。
本科室于 2011年 3月至2013年 3月选用与人解剖、生理及移植免疫极为相似的大动物(猪)为研究对象,共进行了8例实验,本文着重探讨在猪MVTX实验中缺血再灌注损伤(ischemia-reperfusion injury,IRI)的防治方法,并报道如下。
1 材料与方法
1.1 实验动物 供、受体均为健康家猪,共 16 头,体质量65~90 kg,供、受体体质量相近,雌雄不限,随机分为供、受体两组,每组各 8头,未进行组织配型。
1.2 麻醉与监测 给予氯胺酮 15 mg/kg、阿托品1.0 mg、咪唑10.0 mg、芬太尼0.5 mg耳后颈部肌肉注射,基础麻醉成功后将猪称重,固定于手术台,行气管插管。切开颈动脉、颈外静脉,置人深静脉导管,输液,监测平均动脉压、中心静脉压,连续监测心电图及呼吸。术中采用异氟醚、咪唑、氯胺酮、芬太尼、维库溴铵等维持。
1.3 手术方法 供体大十字切口进腹,游离切除全部结肠。游离小肠、双肾、胃、食管及肝脏,灌注后切取全腹腔脏器。将肠系膜上动脉和腹腔干整形为一大吻合口。修剪肝上下腔静脉、肝下下腔静脉。完整切除双肾。取供体胸主动脉长约10 cm,与肠系膜上动脉和腹腔干整形后的共同开口架桥吻合,留待与受体腹主动脉架桥吻合。切除受体全腹腔脏器。将供体脏器整块置入受体腹腔中,行供受体肝上下腔静脉吻合及架桥动脉与腹主动脉吻合,开放血流,复温。吻合肝下下腔静脉。最后行贲门及肠道的吻合。
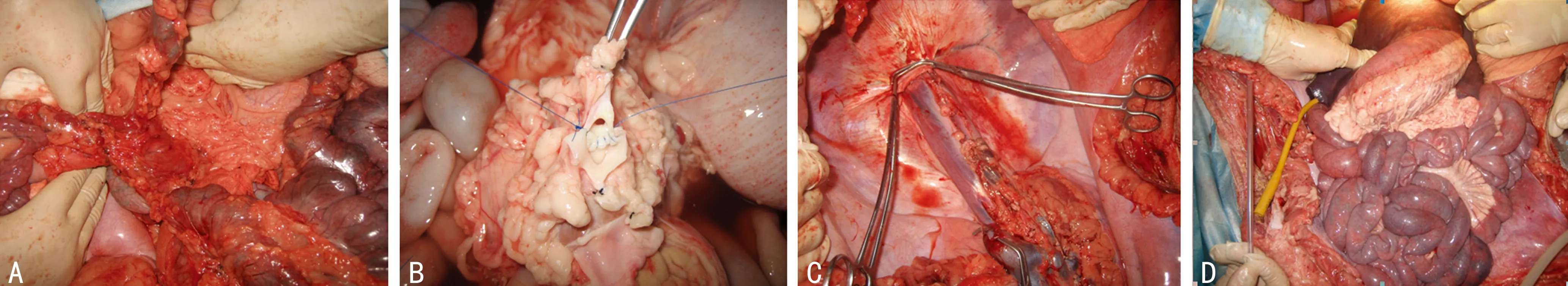
A:供体全腹腔脏器切取;B:供体全腹腔脏器修剪;C:受体全腹腔脏器切除;D:受体全腹腔脏器植入。
图1 主要手术步骤
MVTX实验中,IRI及血流动力学的巨大变化,是导致实验猪死亡的主要原因[3],也是MVTX能否取得成功的关键点。为减轻 IRI及血流动力学变化所造成的损伤,作者在术中采取了一系列的措施。(1)缺血预处理 (ischemic preconditioning,IPC),Reamer于1986 年 首次提出 IPC 的概念,即预先反复短暂缺血可提高组织或器官对后续长期缺血的耐受性,减轻 IRI所造成的损伤。本研究采用的方法是在供体手术开始灌注之前,预阻断腹主动脉2个循环,阻断10 min/再灌注10 min[4];(2)缺血后处理(isehemie posteonditioning,IPO),即在长时间缺血后,再灌注的起始阶段,立刻给予一次或多次短暂重复缺血-再灌注处理,是近年来提出的一种新的 IRI 干预方式。本研究在受体开始再灌注之初,采用6次循环,再灌注60 s/阻断60 s[5];(3)尽量缩短热缺血和冷缺血的时间;(4)药物的应用。开放血流时,大量血液涌入植入腹腔脏器,使得受体血容量急剧减少,4例受体均在此后1 h内死亡,通过不断总结及改进,本研究先在植入脏器内注满羟乙基淀粉130/0.4氯化钠注射液,同时受体大量快速补充新鲜全血,取得了满意的效果。
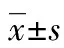
2 结 果
8例实验均顺利完成供体脏器切除、修整,受体脏器切除3个阶段,进入受体全腹腔脏器植入阶段。在切除受体腹腔脏器阶段,开放血流后1 h内,4例受体死亡。分析死亡原因,考虑与IRI,及术中巨大的血流动力学改变相关。另有1例受体因膈肌痉挛,已吻合成功的肝上下腔静脉撕裂,出血无法控制而死亡。实验猪死亡后,本研究对其小肠、肾、肝等做了病理检查,发现肠黏膜上皮坏死,固有层较多淋巴和浆细胞浸润。肾小球体积增大,球囊内有纤维素和淋巴细胞渗出物。肝假小叶内呈灶状肝窦扩张充血,严重淤血,肝细胞固缩坏死。

A:小肠;B:肝;C:肾。
作者认为,上述器官的病理改变可能与IRI相关[6]。经过不断的总结和改进,如缺血预处理,缺血后处理,缩短热缺血和冷缺血的时间,以及药物的使用等措施后,有3例手术顺利度过该阶段,实验得以成功,受体在术后未进行任何特殊治疗的情况下存活30 min、15 h 20 min及32 h。作者将术中死亡的5例受体及实验成功的3例受体的热缺血和冷缺血时间进行了统计学分析,结果见表1。

表1 术中死亡及实验成功受体热缺血和冷缺血时间比较
3 讨 论
Jennings 于1960年首先提出了IRI的概念,即缺血后再灌注不仅不能使组织、器官功能恢复,反而加重组织、器官的功能障碍和结构损伤,这种现象即为IRI。
IRI包括热缺血、冷缺血及再灌注损伤3个过程。(1)热缺血时间是指器官从供体供血停止到冷灌注(冷保存)开始的这段时间。这一期间虽然血流中断,但是器官组织仍继续进行代谢,对器官的损害最为严重,所以,尽量缩短热缺血时间十分重要。(2)冷缺血时间是指器官从冷灌注(冷保存)开始到移植后供血开始的这段时间,不同器官可耐受的缺血时间也不同,同样要求要尽量缩短时间,该时段移植脏器处于持续低温中,低温可延长组织的存活时间,是保存成功的关键因素,但同时低温也会对器官组织的正常功能产生很大影响。(3)再灌注损伤,再灌注后有大量钙内流,并生成大量氧自由基,可导致广泛组织细胞损伤。
IRI并非是单一的病理生理过程,而是一个多细胞参与、多种介质共同发挥作用的过程。其损伤因素远超过机体的自我保护,所以有必要通过各种措施来减少损伤。本实验的整个过程中,重视缺血预处理和缺血后处理,有助于减轻IRI对脏器的损害,稳定该阶段巨大血流动力学变化。对8例实验的热缺血及冷缺血时间进行的统计学分析可以看到,实验成功的受体,无论在热缺血还是冷缺血时间,均较死亡的受体明显缩短,这可能是实验得以成功的关键点之一。开放血流时,先注入羟乙基淀粉有助于改善此阶段巨大血流动力学的变化,同时,羟乙基淀粉在再灌注期间具有防止毛细血管渗漏,减轻组织水肿,增加肠壁血流,提高组织供氧量的作用,减轻了再灌注损伤[7],也是非常重要的因素。
通过上述措施的应用,3例实验取得了成功,作者认为,重视缺血预处理,缺血后处理,尽量缩短热缺血和冷缺血的时间,以及一些药物的合理应用,对于MVTX术中防止和减轻IRI具有非常最大的意义。另外,术中使用血管活性药物收缩血管提高外周阻力,积极通过补充新鲜血及液体来提高血压,手术过程中稳定的麻醉,对减少IRI也有一定的帮助[8]。
MVTX是一个复杂的手术,技术难度大[9],代表了腹腔脏器移植的最高水平。传统外科手术无法切除的腹腔内肿瘤,如肝外胆管癌、壶腹部癌、胰腺癌、小肠癌、肠系膜的硬纤维瘤、胃肠道间质瘤、广泛的胃肠道多发性息肉伴恶变等,以及胃肠道神经性疾病、坏死性小肠炎或结肠炎、肠衰竭、肠系膜血管或腹腔动脉完全栓塞等疾病,均为该术式的手术适应证,具有广泛的患者群。所以,建立一个稳定的动物实验模型,能为更好、更广泛地在临床开展全腹腔脏器移植奠定良好的基础,通过对该实验模型的初探,作者总结出了一些有益的经验,尤其是在防止和减轻IRI方面,当然,建立更加稳定的MVTX动物实验模型,还需要进一步探索和研究。
[1]Tzakis AG,Kato T,Levi DM,et al.100 multivisceral transplants at single center[J].Ann surg,2005,242(2):480-493.
[2]Madariaga JR,Reyes J,Mazariegos G,et al.The long-term efficacy of multivisceral transplantation[J].Transplant Proc,2000,32(6):1219-1220.
[3]Chen HX,Yin L,Peng CH,et al.Abdominal cluster trapsplantation andmanagement of perioperative hemodynamic changes[J].Hepatobiliary Pancreat Dis Int,2006,15(1):28-33.
[4]潘明新,孔凡东,吴志峰,等.缺血预处理对小型猪肝移植的影响[J].南方医科大学学报,2007,27(3):250-253.
[5]黄汉飞,宋 飞,张玉君,等.缺血后处理在大鼠肝移植缺血再灌注损伤中的作用[J].世界华人消化杂志,2010,18(34):3627-3631.
[6] Komokata T,Nishida S,Ogata S,et al.Abdominal multivisceral transplantation in pigs[J].J Hepatobiliary Pancreat Surg,2000(7):188-192.
[7]谢云飞,徐亮.小肠缺血再灌注研究进展[J].西南军医,2012,14(1):90-92.
[8]David AI,Chida VV,Lee AD,et al.Multivisceral transplantation in pigs:a model for research and trairing[J].Einstein,2011,9(3 Pt 1):372-376.
[9] Zhu Y,Furukawa H,Nakamura K,et al.Multivisceral allotransplantation in pigs[J].Transplant Proc,1996,28(5):2725.
10.3969/j.issn.1671-8348.2015.26.034
陈炜(1973-),本科,副主任医师,主要从事肝胆胰病的基础与临床研究。
R657
B
1671-8348(2015)26-3696-03
2015-03-15
2015-06-26)

